2024-06-21 スイス連邦工科大学ローザンヌ校(EPFL)
<関連情報>
- https://actu.epfl.ch/news/membrane-protein-analogues-could-accelerate-drug-3/
- https://www.nature.com/articles/s41586-024-07601-y
可溶性で機能的な膜タンパク質類似体の計算デザイン Computational design of soluble and functional membrane protein analogues
Casper A. Goverde,Martin Pacesa,Nicolas Goldbach,Lars J. Dornfeld,Petra E. M. Balbi,Sandrine Georgeon,Stéphane Rosset,Srajan Kapoor,Jagrity Choudhury,Justas Dauparas,Christian Schellhaas,Simon Kozlov,David Baker,Sergey Ovchinnikov,Alex J. Vecchio & Bruno E. Correia
Nature Published:19 June 2024
DOI:https://doi.org/10.1038/s41586-024-07601-y
Abstract
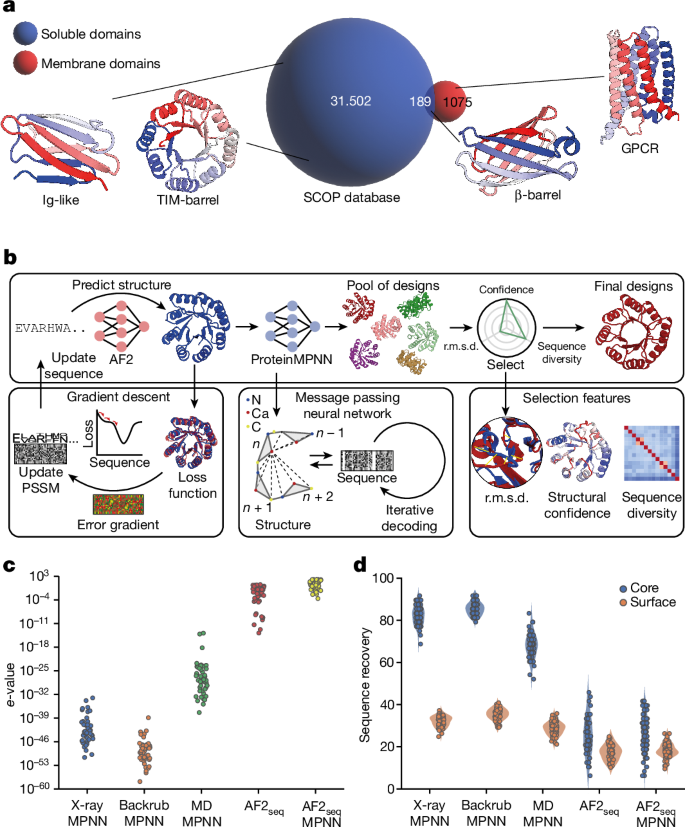
De novo design of complex protein folds using solely computational means remains a substantial challenge1. Here we use a robust deep learning pipeline to design complex folds and soluble analogues of integral membrane proteins. Unique membrane topologies, such as those from G-protein-coupled receptors2, are not found in the soluble proteome, and we demonstrate that their structural features can be recapitulated in solution. Biophysical analyses demonstrate the high thermal stability of the designs, and experimental structures show remarkable design accuracy. The soluble analogues were functionalized with native structural motifs, as a proof of concept for bringing membrane protein functions to the soluble proteome, potentially enabling new approaches in drug discovery. In summary, we have designed complex protein topologies and enriched them with functionalities from membrane proteins, with high experimental success rates, leading to a de facto expansion of the functional soluble fold space.