2024-08-30 理化学研究所,東京工業大学
理化学研究所(理研)生命機能科学研究センター(BDR)先端NMR開発・応用研究チームの石井 佳誉 チームリーダー(東京工業大学 生命理工学院 教授)、東京工業大学(東工大)生命理工学院のモハンマド・ジャファー・テヘラーニ 東京工業大学特別研究員、松田 勇 研究員、理研 生命機能科学研究センター タンパク質機能・構造研究チームの山形 敦史 上級研究員、白水 美香子 チームリーダー、理研 環境資源科学研究センター 質量分析・顕微鏡解析ユニットの豊岡 公徳 上級技師、佐藤 繭子 技師らの国際共同研究グループは、家族性アルツハイマー病[1]で観察される綿花状の老人斑[2]を再現するアミロイド線維[2]を作成し、その凝集体に含まれる新規構造モチーフ[3]をクライオ電子顕微鏡[4]と固体NMR[5]の統合解析により解明しました。
本研究は、線維構造の違いがアルツハイマー病(AD)の病態や進行を大きく変える可能性を示した先駆的な研究です。若年性ADに対する創薬や、ADのサブタイプによって異なる病態が生じる仕組みの解明に貢献すると期待されます。
家族性ADは遺伝子変異を伴うADの一つで、一般に若年で発症します。中でもβ-アミロイド(Aβ)[2]の22番目のアミノ酸であるグルタミン酸がグリシンに変異した家族性ADは、綿花状の巨大な老人斑など特異な病態を示すため注目されています。
今回、国際共同研究グループは、この綿花状の老人斑の特徴を再現するAβの線維を脳由来試料を全く使わずに化学的に作成することに成功し、クライオ電子顕微鏡と固体NMRにより解析しました。その結果、βシート[6]がW字型に折り畳まれた新規構造モチーフを発見し、脳由来の物質ではなくアミロイド線維の構造により綿花状の凝集体の特異性が説明できることを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(8月15日付)に掲載されました。
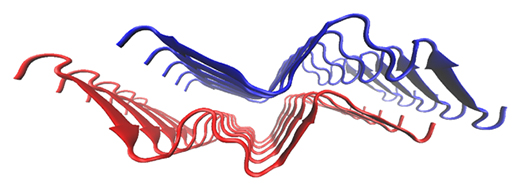
βシートがW字型に配置された新規構造モチーフを持つアミロイド線維の分子構造
背景
アルツハイマー病(AD)の脳内では、β-アミロイド(Aβ)の線維状の凝集体(アミロイド線維)が老人斑に蓄積し、これがADを引き起こすと考えられています。一般的に酵素などのタンパク質の機能はその分子構造によって決まりますが、ADで観測される病態や病気の進展と、Aβ線維の構造がどのように関連するかは長らく不明でした。
Aβは、主として40アミノ酸から成るAβ40と42アミノ酸のAβ42の2種類が脳内に存在しますが、老年期に発症する通常のADでは、直径10マイクロメートル(μm、1μmは100万分の1メートル)程度の直径の老人斑の核に、42残基のAβ42が線維を形成する形で蓄積することが知られています。近年の固体NMRやクライオ電子顕微鏡を使った研究により、Aβ42線維の構造は、βシートと呼ばれる平たい構造がS字型に折り畳まれ、多数のAβ42が平行に連なって長い繊維を作ることが明らかになってきています。
他方で、AD患者の中には通常の老人斑とは大きく異なる病態を示すサブタイプに分類できるケースがあります。Aβの22番目のアミノ酸であるグルタミン酸(E)がグリシン(G)に換わることで起きるE22G変異は、早期の発症を伴う家族性ADを引き起こすことが知られています。この家族性ADでは、cotton wool(綿花状)老人斑と呼ばれる直径100μmを超える巨大な綿花状の老人斑が形成されることが症例として見られます。綿花状老人斑は通常型ADとは異なり、中心にはAβ40の線維が蓄積し、その周囲にAβ42とAβ40の線維がリング状に形成される特徴的なコア-シェル構造を示します。また、綿花状老人斑は、PET検査[7]でADの老人斑を検出するために広く利用されるピッツバーグ試薬[7]に対して反応が低いという特徴も持ちます。この綿花状老人斑は遺伝子変異を伴わない通常型のADでも見られますが、このような特異なADのサブタイプと考えられる病態が生じるメカニズムや、この病態とAβ線維の構造やその他の要素がどのように関係するかについては、長年大きな謎とされてきました。
近年になって、E22G変異を持つ家族性AD患者の脳から取り出したAβ線維の構造解析が行われましたが注1)、綿花状老人斑などのこの家族性ADの特異性を反映した特徴のあるAβ線維の構造は得られておらず、複数の構造を持つAβ線維が試料に混在しているため、E22G Aβ線維の構造と家族性AD特有の病態の関連に関して分子レベルの理解を深めることは難しい状況でした。
注1)Yang, Y. et al. Cryo-EM structures of amyloid-β filaments with the Arctic mutation (E22G) from human and mouse brains. Acta Neu- ropathol. 145, 325-333 (2023).
研究手法と成果
今回、国際共同研究グループは、患者の脳からアミロイド線維を抽出するのではなく、化学合成したE22G Aβ40を用いて、合成生物学的なアプローチで綿花状老人斑の特徴を再現するアミロイド線維を作成しました。綿花状老人斑の特異性がE22G Aβのアミロイド線維に由来するという仮説はこれまでありませんでした。また、化学合成したE22G Aβ40を用いて線維を作成する試みはこれまでも行われていましたが、従来法では出来上がった線維が短く不均一であるなど(図1a)、構造解析には不向きでした。今回は作成条件を最適化し、均一な構造を持つ形で単離することに成功しました。均一な構造の存在は、固体NMRで確認されました。
通常のAβの線維は複数の線維が束を作りコンパクトな構造になりますが、今回単離されたE22G Aβ40線維は分散性が高く、一本ごとに分離していることが電子顕微鏡写真で分かりました(図1b)。このため、同じ重量でも野生型のAβ40線維と比べて約12倍の大きさを持つ密度の低い凝集体を作ることが分かりました(図2)。また、ピッツバーグ試薬と同じ分子骨格を持つ蛍光試薬(チオフラビンT)では検出しにくいことも示されました。これらのE22G Aβ40線維の特徴は、綿花状の老人斑で観測されているアミロイド線維の多くの特徴とよく一致します。さらに、通常のADでは脳内に多く存在するAβ40よりも少数派の42残基のAβ(Aβ42)が老人斑の形成を促すと考えられていますが、国際共同研究グループはE22G変異があるとAβ42よりもAβ40が早く凝集をすることを、老人斑が蓄積する細胞外環境の溶液状態に似せた試験管内の実験で示しました。

図1 合成生物学的なアプローチで作成したE22G Aβ40線維の透過電子顕微鏡像
(a)従来法で作成したE22G Aβ40線維。さまざまな形状の線維が混ざっており、束を作っていることが分かる。このような不均一で分散性の低い試料はクライオ電子顕微鏡での構造解析が難しく、固体NMRによる解析でも複数の異なる構造の存在が示唆された。
(b)条件を最適化して得た線維。(a)の観察像では分からなかった強いねじれ(黄色矢印)を伴う線維が観測された。均一な形状が得られており、クライオ電子顕微鏡と固体NMRによる構造解析に最適である。この線維は、温度や振とう条件などを最適化して得た線維を超音波で破砕し、それを鋳型として凝集していないE22G Aβ40モノマーを加えて線維を成長させることを5回繰り返して得られた。

図2 E22G Aβ40線維が作る密度の低い凝集体
化学合成したAβを染色して試験管内で遠心沈殿させた観察像。
上段
(a)線維なしの試料。
(b)対照試料としての、アミノ酸変異を持たない野生型(WT)Aβ40線維。
(c)最適化して作成したE22G Aβ40線維。
下段(b)、(c)を同じ倍率で拡大した画像。E22G Aβ40線維の沈殿の大きさが、同じ重量でも面積ベースでWTAβ40線維と比較して12倍程度大きいことを示し、綿花状の老人斑で大きく広がった老人斑を再現したものと考えられる。この理由として、図1bで確認されたように通常の線維のように束を作らず、分散しているために同じ量でも線維の分布範囲が大きく広がるためと説明できる。
国際共同研究グループは、今回単離されたE22G Aβ40に対して、クライオ電子顕微鏡と固体NMRによる統合構造解析を行いました。解析の結果、E22G Aβ40はこれまで観測されたことのない、βシートがW字型に折り畳まれた新規構造モチーフを持つことが分かりました(図3)。C末端の40番目のアミノ酸が他の残基と強く相互作用していないことから、Aβ42がE22G Aβ40線維の末端に吸着しても、C末端にある41と42残基が邪魔にならず相互作用可能で、Aβ42の共凝集を引き起こしやすいことがこの構造より示唆されました。
実際にこのE22G Aβ40線維を、凝集していない野生型のAβ42(WT Aβ42)のモノマー(単分子)に混ぜて実験を行ったところ、WT Aβ42の線維化が促進され、E22G Aβ40とWT Aβ42の共凝集が起こることが確認できました。さらに、得られた構造を基に分子動力学計算[8]を行ったところ、E22G Aβ40とWT Aβ42が混ざった線維(キメラ線維)もW字型構造で安定であることが示唆されました。WT Aβ42で見られるS字型の構造ではAβ40の共凝集が起こりにくいことが以前から知られていましたが、今回観察されたW字型構造はAβ40とAβ42の共凝集を促進すると考えられます。
以上の結果より、E22G変異を伴う家族性ADでは、凝集の早いE22G Aβ40が分散性の高いW字型構造を持つE22G Aβ40線維を生成することで、Aβ40の大きなコアができると説明できます。さらにこのAβ40の大きなコアの周りに、Aβ42モノマーが共凝集によりリクルートされてAβ42の線維が蓄積することが、綿花状の老人斑に特有のコアーシェル構造の生成メカニズムであると示唆されました。
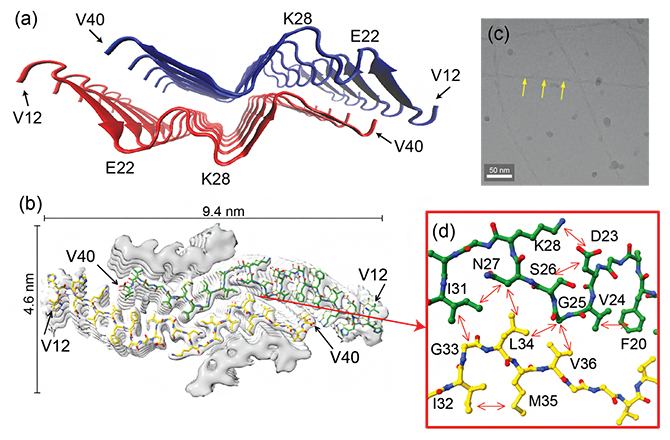
図3 W字型にβシートが折り畳まれた新規構造モチーフ
(a)W字型の新規構造モチーフを示すE22G Aβ40線維の構造。幅広のリボンの矢印はβシート構造を示し、赤と青の構造は180度回転するとほぼ対称形のW字になっている。
(b)クライオ電子顕微鏡で得られた密度マップ(分子内部密度の高低を白と灰色のアウトラインで表示)と得られた構造(緑と黄色の構造)の重ね合わせ。初期構造では内層の2層の他に外層の2層のβシート構造(灰色)も密度マップで示されたが、固体NMRで得られた構造情報と一致する内層の構造のみを示した。なおAβ40のN末端側11アミノ酸はおそらく定常的な構造を取っていないため、密度マップとして得られなかった。
(c)クライオ電子顕微鏡で得られた線維の画像。黄色矢印は、透過電子顕微鏡像で見られたねじれ(図1b)に対応する構造。
(d)クライオ電子顕微鏡で得られた構造に、固体NMRで観測された原子間の相互作用情報(矢印)を重ね合わせたもの。両者の位置関係がよく一致している。
今後の期待
今回の合成生物学的なアプローチにより、ADのサブタイプに分類され得る家族性ADの特異な老人斑の性質が、脳由来の物質を必要とせず化学合成された物質だけで説明できることが示されました。異なる病態を示すADのサブタイプは複数報告されていますが、Aβ線維の構造的な差異と、異なる病態の明確な関連は従来の研究では示されていませんでした。今回の研究は老人斑が異なる病態を示すADに対する発症メカニズムの理解と、それに対する適切な創薬のターゲットを選ぶ上で、関連するAβ線維の単離と構造の同定がキーになり得ることを示しています。
今回の研究はまた、E22G変異を伴う家族性ADでは、通常のADとは違い、Aβ42ではなくAβ40がまず線維化してAβ40の大きなコアができ、その周囲でのAβ42の共凝集が促進されて、家族性ADに特徴的な老人斑形成につながることが示されました。遺伝子変異により発症の第一幕であるAβ凝集の主役がAβ40に変更されることで、脇役となったAβ42を含む異なる種類のAβの間の相互作用でより複雑な病態が生まれることが示唆されました。Aβ凝集のメカニズムとAβ線維の構造を理解することで、複雑で手掛かりが少なかった家族性ADの発症プロセスと創薬のターゲットも理解できるようになり、有効な治療へとつながることが期待できます。
本研究は現在科学技術振興機構(JST)の未来社会創造事業注2)の大型プロジェクトで開発中である1.3ギガヘルツ(GHz)超高磁場NMRの利用を広げる研究の一例として行いました。今回の研究では、900メガヘルツ(MHz)の高磁場固体NMRを用いて、化学合成したAβ試料を解析しました。NMRは磁場が高くなるほど高感度になるため、1.3GHz NMRなどの超高磁場が実現すれば、ヒトやマウス由来など極微量の試料でも固体NMRとクライオ電顕の統合構造解析が可能となることが期待できます。これにより応用可能な試料の幅が大きく広がり、他の病気の理解にも適用できることが期待されます。
補足説明
1.家族性アルツハイマー病
アルツハイマー病(アルツハイマー型認知症、AD)には、遺伝が関係しない孤発性と遺伝が関係する家族性の二つのタイプがある。本研究の対象としたβ-アミロイドの22番目のアミノ酸であるグルタミン酸(E)がグリシン(G)に換わる遺伝子変異は、スウェーデン北部の家族性アルツハイマー病患者で見つかったことから「北極変異(arctic mutation)」と呼ばれている。
2.老人斑、アミロイド線維、β-アミロイド(Aβ)
β-アミロイド(Aβ)は、アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。Aβが凝集したアミロイド線維が、アルツハイマー病患者の脳で見られるタンパク質の沈着(老人斑)の構成成分として発見されたことから、Aβの過剰な蓄積が発症の引き金と考えられている。Aβはアミノ酸の数で種類が分類され、40アミノ酸残基から成るAβ40、42アミノ酸残基から成るAβ42が脳内の主要な種として同定されている。
3.構造モチーフ
多くのタンパク質に共通する構造パターンを構造モチーフと呼ぶ。新規の構造モチーフの発見は新しいタンパク質の動作機序や機能の発見につながるために価値を持つ。本研究では新しい構造モチーフの発見が、新しい機能を持つAβアミロイド線維の発見につながっている。
4.クライオ電子顕微鏡
液体エタン(-183~-160℃)中で急速に凍結させることにより非晶質(アモルファス)の氷に閉じ込めた試料を、液体窒素温度(-196℃)で観察する電子顕微鏡。生体分子が生体内に存在している状態と同様の水溶液中に居る状態を電子顕微鏡で観察できる。
5.固体NMR
核磁気共鳴(NMR)法は、磁場中に置かれた原子核の核スピンの共鳴現象(核磁気共鳴現象)により、物質の分子構造や物性を解析する方法。分子の相互作用などの情報も得られるため、生命科学、医薬、化学、食品、材料物性といった幅広い分野で利用されている。磁気共鳴画像(MRI)法でもこの共鳴現象が用いられている。測定対象となる物質を溶媒に溶かす溶液NMR法に対し、固体状態の物質を測定するNMR法を固体NMR法と呼ぶ。NMRはnuclear magnetic resonanceの略。
6.βシート
タンパク質の代表的な二次構造の一つ。タンパク質の直鎖状の部分が2本以上隣り合って並び、水素結合で形成された平面構造。
7.PET検査、ピッツバーグ試薬
PETは、陽電子を放出する放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定して分子の体内分布を見る方法。臨床では、PET検査として主にがんの診断に用いられている。ピッツバーグ試薬は、Aβに結合する低分子を放射性同位体で標識したもので、アルツハイマー病のPET検査に用いられる。PETはpositron emission tomographyの略。
8.分子動力学計算
コンピュータを用いた分子シミュレーション法の一つ。分子を構成する各原子の間に働く力を、経験的に定められたポテンシャルエネルギー関数を用いて計算し、その運動をニュートン方程式F=maに基づいて数値的に解くことで、分子の動きを予測し解析する方法。
国際共同研究グループ
理化学研究所
生命機能科学研究センター
先端NMR開発・応用研究チーム
チームリーダー 石井 佳誉(イシイ・ヨシタカ)
(東京工業大学 生命理工学院 教授)
上級研究員 小林 直宏(コバヤシ・ナオヒロ)
タンパク質機能・構造研究チーム
上級研究員 山形 敦史(ヤマガタ・アツシ)
チームリーダー 白水 美香子(シロウズ・ミカコ)
環境資源科学研究センター
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
東京工業大学 生命理工学院
東京工業大学特別研究員 モハンマド・ジャファー・テヘラーニ(Mohammad Jafar Tehrani)
(理研 生命機能科学研究センター 先端NMR開発・応用研究チーム リサーチアソシエイト)
研究員 松田 勇(マツダ・イサム)
(理研 生命機能科学研究センター 先端NMR開発・応用研究チーム 客員研究員)
大学院生 児玉 有(コダマ・ユウ)
(理研 生命機能科学研究センター 先端NMR開発・応用研究チーム 研修生)
助教 松永 達弥(マツナガ・タツヤ)
(理研 生命機能科学研究センター 先端NMR開発・応用研究チーム 客員研究員)
イリノイ大学(アメリカ)シカゴ校 化学科
NMR施設長 Dan McElheny
研究支援
本研究は、米国National Institutes of Health、NIGMSのU01グラント「Structures and Propagation of Pathologically Relevant Amyloids in Alzheimer’s(研究代表者:石井佳誉)」、科学技術振興機構(JST)未来社会創造事業(大規模プロジェクト型)「エネルギー損失の革新的な低減化につながる高温超電導線材接合技術」研究領域の研究課題「高温超電導線材接合技術の超高磁場NMRと鉄道き電線への社会実装(研究開発代表者:小野通隆)」、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「超高分解能固体NMRと自動解析による非結晶性生体高分子と先端材料構造解析の新機軸(研究代表者:石井佳誉)」、同学術変革領域研究(A)「神経変性疾患に関わる凝集体の形成・抑制のin situ構造生物学(研究代表者:山形敦史)」による助成を受け、理化学研究所運営費交付金(生命機能科学研究、戦略的研究展開事業)で一部の研究を実施して行われました。
原論文情報
Mohammad Jafar Tehrani, Isamu Matsuda, Atsushi Yamagata, Yu Kodama, Tatsuya Matsunaga, Mayuko Sato, Kiminori Toyooka, Dan McElheny, Naohiro Kobayashi, Mikako Shirouzu, Yoshitaka Ishii, “E22G Aβ40 fibril structure and kinetics illuminate how Aβ40 rather than Aβ42 triggers familial Alzheimer’s”, Nature Communications, 10.1038/s41467-024-51294-w
発表者
理化学研究所
生命機能科学研究センター 先端NMR開発・応用研究チーム
チームリーダー 石井 佳誉(イシイ・ヨシタカ)
(東京工業大学 生命理工学院 教授)
タンパク質機能・構造研究チーム
上級研究員 山形 敦史(ヤマガタ・アツシ)
チームリーダー 白水 美香子(シロウズ・ミカコ)
環境資源科学研究センター
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
東京工業大学 生命理工学院
東京工業大学特別研究員 モハンマド・ジャファー・テヘラーニ(Mohammad Jafar Tehrani)
研究員 松田 勇(マツダ・イサム)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課


