2024-10-11 理化学研究所
理化学研究所(理研)生命機能科学研究センター 比較コネクトミクス研究チームの鶴谷 雅文 大学院生リサーチ・アソシエイト、宮道 和成 チームリーダーらの研究チームは、社会性コミュニケーション[1]の不調を示すモデルマウスにおいて、社会性をつかさどるオキシトシン神経細胞[2]の一群が選択的に機能不全を起こしていることを明らかにしました。
本研究成果は、自閉スペクトラム症[3]など社会性の不調を伴う発達障害の理解に新たな概念を提供し、将来的な治療標的の設定に貢献するものです。
社会性の不調を伴う発達障害は、数百種類に上る遺伝的なリスク因子と、母胎内における環境要因とが複雑に交絡(こうらく)して発症に至ると考えられています。そのため、脳の中でどのような神経細胞が機能低下して社会性の不調に至るのかよく分かっていません。
研究チームは、環境要因(薬物服用)による社会性不調モデルマウス[1]において、組織学的な観察と網羅的な遺伝子発現パターン解析を用いて、機能低下した神経細胞を探索しました。その結果、社会性行動の制御に重要なオキシトシン神経細胞の一群が遺伝子発現パターンの顕著な異常を示し、オキシトシンを合成できない状態に陥っていることが分かりました。この機能不全は、オキシトシン神経細胞を一過的に興奮させることで持続的に回復し、社会性行動も改善することが判明しました。
本研究は、科学雑誌『Nature Communications』オンライン版(10月6日付)に掲載されました。
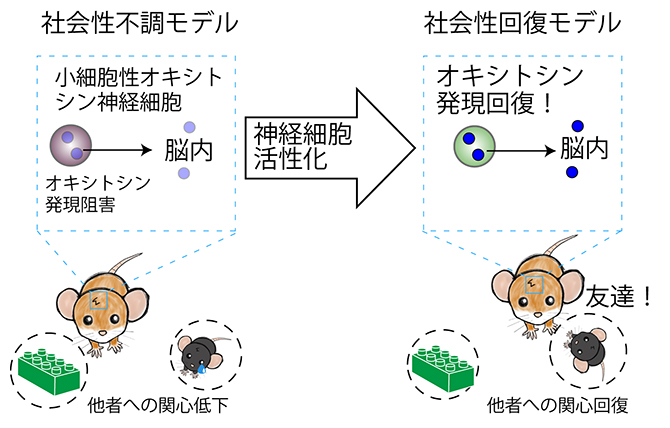
社会性不調モデルマウスにおけるオキシトシン神経細胞の機能不全と回復
背景
近年、自閉スペクトラム症などの社会性コミュニケーションの不調を伴う発達障害に関心が集まっています。世界保健機関(WHO)の報告では、全世界で約1%の子供が自閉スペクトラム症と推定されています注1)。また米国疾病予防管理センター(CDC)の調査では、米国における子供の罹患(りかん)率は約36人に1人にも上ります注2)。ひきこもりなども含め、広義の社会性コミュニケーションの不調は、現代社会の直面する大きな課題です。
自閉スペクトラム症の患者を用いた大規模な遺伝子スクリーニングの結果から、数百種類を超える膨大なリスク遺伝子の存在が明らかになっています。さらに、一卵性双生児を用いた調査などから、自閉スペクトラム症には、脳の発達に重要な胎児期の環境要因も関与することが知られています。しかし、多様な遺伝子の変異がどのように環境要因と交絡して社会性の不調という共通した病態を引き起こすのかという根本的な疑問は未解明のままです。
研究チームは、社会性の不調を引き起こす胎児期の環境要因に着目しました。一般的に、妊婦の飲酒、喫煙、薬物服用は子の社会性の発達に悪影響を与えると考えられています。抗てんかん薬として知られるバルプロ酸[4]は、妊娠中の女性が服薬すると、子の自閉症リスクが上昇すると報告されています。バルプロ酸の影響はマウスやラットなどのげっ歯類でモデル化されており、胎児期にバルプロ酸に暴露されると社会性コミュニケーションが低下することが知られていました。しかし、バルプロ酸に暴露されたマウスにおいて、どのような脳領域のどのような神経細胞がいかなる影響を受けているのか、よく分かっていませんでした。
脳の視床下部と呼ばれる領域には、社会性行動の制御に関わる視床下部室傍核(しつぼうかく)[5]があり、社会親和性を亢進(こうしん)させる作用を持つホルモンの一つ、オキシトシンを合成するオキシトシン神経細胞もここに存在します。本研究では、胎児期のバルプロ酸暴露による視床下部室傍核のオキシトシン神経細胞への影響について調査することにしました。
注1)World Health Organization /Newsroom/Fact sheets/Detail/Autism Autism
注2)An official website of the United States government “Data and Statistics on Autism Spectrum Disorder”
研究手法と成果
研究チームはまず、健常マウスと、バルプロ酸を投与した妊娠マウスから生まれた社会性不調モデルマウス(図1A)の両群において、視床下部室傍核のオキシトシン神経細胞数とオキシトシンの発現を組織学的に観察し、両者を比較しました。視床下部室傍核のオキシトシン神経細胞には、脳内にオキシトシンを分泌する小細胞性オキシトシン神経細胞と、下垂体・全身にオキシトシンを分泌する大細胞性オキシトシン神経細胞の2種類が存在し、一般に、社会性行動の制御に関与するといわれているのは小細胞性オキシトシン神経細胞です。
実験の結果、どちらのオキシトシン神経細胞の数にも両群で違いはありませんでした。しかし、小細胞性オキシトシン神経細胞でのオキシトシン合成は、社会性不調モデルマウスで選択的に阻害されていることが分かりました(図1B、 C)。興味深いことに、この小細胞性オキシトシン神経細胞の異常は、バルプロ酸とは異なる別の社会性不調モデル(妊娠期高脂肪食)でも再現されました。これらのことから、小細胞性オキシトシン神経細胞は、さまざまな胎児期の環境要因が共通して悪影響を及ぼす標的になっている可能性が考えられます。
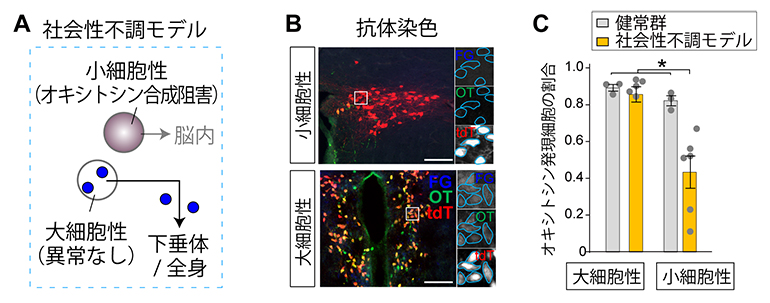
図1 社会性不調のモデルマウスにおけるオキシトシン発現の定量
A.社会性不調モデルマウスにおけるオキシトシン発現の模式図。下垂体・全身を担当する大細胞性オキシトシン神経細胞には大きな変化がなかったが、脳内にオキシトシンを分泌する小細胞性オキシトシン神経細胞でのオキシトシン合成が阻害された。
B.代表的な蛍光顕微鏡観察像。上が小細胞性、下が大細胞性オキシトシン神経細胞。カラー画像は、オキシトシン神経細胞を赤色色素(tdT)で、大細胞性オキシトシン神経細胞を選択的に青色色素(FG)で、オキシトシンに対する抗体染色を緑色(OT)で標識し、同時観察したもの。右の三つの拡大画像は、それぞれの蛍光色のみを検出するフィルターを通して観察したモノクロ画像で、蛍光シグナルの存在は白色で示される。小細胞性オキシトシン神経細胞では、オキシトシン神経細胞の存在を示す赤色色素(tdT)のシグナルは観察されるが、オキシトシンの緑色(OT)のシグナルが観察されない。スケールバーは200マイクロメートル(µm、1µmは1,000分の1mm)。
C.健常群と社会性不調モデルにおけるオキシトシン発現率の比較(オキシトシン神経細胞数に対する、オキシトシン発現細胞の割合)。社会性不調モデルでは、小細胞性オキシトシン神経細胞のオキシトシン発現が選択的に障害されている。*は有意水準0.05において有意な違いがあることを示す。
ここで小細胞性オキシトシン神経細胞の異常は、遺伝情報からタンパク質が作られた後の障害なのか、それとも遺伝子発現レベルの障害なのか、という疑問が持ち上がりました。また、バルプロ酸の影響は小細胞性オキシトシン神経細胞に特異的なものか、あるいは視床下部室傍核に多数存在する別の機能を持った神経細胞群にも影響しているのか、という疑問も湧いてきました。
これらの疑問を解決するため、研究チームは視床下部室傍核の全細胞の遺伝子発現を網羅的に調べることのできる一細胞RNA sequence法[6]を用いて、健常群と社会性不調モデルを比較しました(図2A、B)。その結果、社会性不調モデルマウスでは、小細胞性オキシトシン神経細胞のオキシトシン遺伝子の発現が低下していました。このことから、図1の状況は遺伝子発現レベルの異常を反映していることが分かりました。また、視床下部室傍核の他の神経細胞を含め、社会性不調モデルマウスで発現が変動する遺伝子がオキシトシン遺伝子以外にも多く見つかりました。詳しく調べると、小細胞性オキシトシン神経細胞では、変動する遺伝子がシグナル伝達や神経機能などの重要な機能に偏っているのに対し、大細胞性オキシトシン神経細胞ではこのような偏りが見られないことが分かりました(図2C)。これらの結果は、社会性不調のモデルマウスにおいては視床下部室傍核を構成する細胞の脆弱(ぜいじゃく)性に違いがあり、小細胞オキシトシン神経細胞は特にダメージを受けやすいことが分かりました。
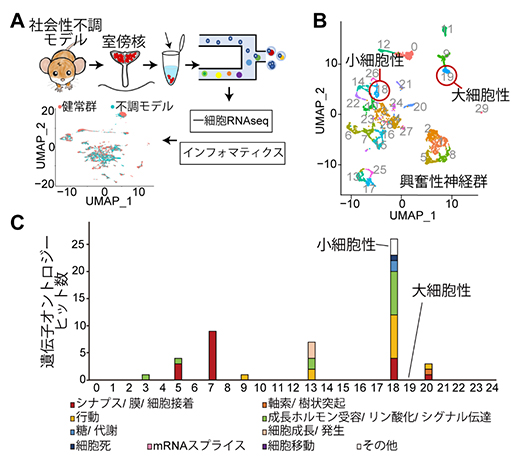
図2 社会性不調のモデルマウスにおける一細胞RNA sequence解析
A.一細胞RNA sequence解析のフロー。社会性不調モデルマウスと健常群から視床下部室傍核を切り出し、一細胞に分離したのちに全RNAを回収してライブラリを構築し、次世代シーケンスに供した。得られた遺伝子発現データから、視床下部室傍核を構成する細胞一つ一つがどのような特徴を持っているかをインフォマティクス(UMAPと呼ばれる統計学的手法)で解析し、2次元グラフ上の2色の点(社会性不調モデルマウス:マゼンタ、健常群:緑)で示した。
B.オキシトシン神経細胞を含む興奮性神経細胞の遺伝子発現パターンを2次元表示したグラフ。興奮性神経細胞は、全遺伝子発現の特徴から30のクラスター(細胞種に相当する)に分類された。そのうち大細胞性オキシトシン神経細胞(クラスター#19)、小細胞性オキシトシン神経細胞(クラスター#18)を赤丸で示した。
C.社会性不調モデルマウスにおいて発現の減少した遺伝子群を入力データとして、遺伝子オントロジーのエンリッチメント解析(入力データとして用いた遺伝子群が、遺伝子データベース上で有意に多く検索される機能を抽出する解析)を行った。大細胞性オキシトシン神経細胞(クラスター#19)にヒットが見られない条件で、小細胞オキシトシン神経細胞(クラスター#18)にはシグナル伝達や神経機能(シナプス、軸索など)を中心に多くの生体プロセスに関わる遺伝子の発現が変化していることが分かった。横軸の数字は、興奮性神経細胞のクラスター上位25種類までの結果を示す。
研究チームは最後に、出生直後の新生期や思春期(5週齢)のマウスにおいてオキシトシン神経細胞を一過的に活性化することで、機能不全を改善できるかを試しました。オキシトシン神経細胞を任意の時期に活性化する実験には、薬理遺伝学[7]と呼ばれる手法を用いました。その結果、いずれの時期に活性化させた場合でも、社会性行動が改善され、小細胞性オキシトシン神経細胞におけるオキシトシンの発現量も顕著に上昇することが分かりました(図3A、B、C)。特に、生後2日目のまだ社会性行動を示さない幼若なマウスでも、オキシトシン神経細胞の活性化が有効で、その効果は成熟後まで持続しました。この社会性回復モデルにおいて視床下部室傍核の細胞の発現遺伝子を一細胞RNA sequence法で網羅的に解析すると、小細胞性オキシトシン神経細胞において発現の低下していた遺伝子が回復傾向にあることが明らかになりました(図3D)。その中には、オキシトシン遺伝子自身も含まれていました。これらの結果は、社会性の発達障害に対して新生期や思春期の介入治療が原理的に可能であることを示しています(図4)。
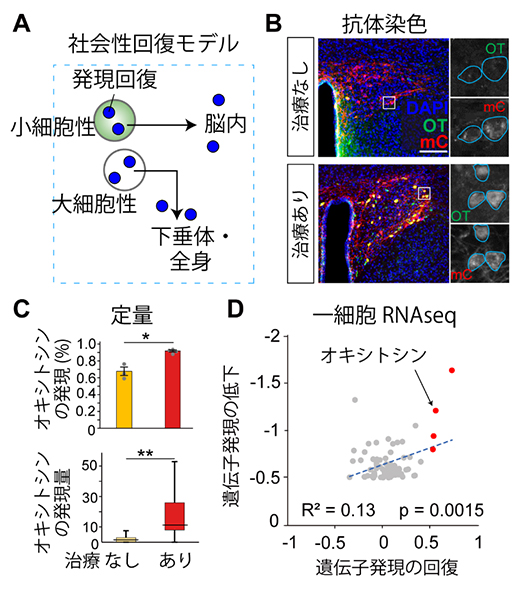
図3 社会性不調の回復モデル
A.社会性不調モデルマウスのオキシトシン神経細胞を新生期あるいは思春期に一過的に活性化させると持続的に機能回復することを発見し、社会性回復モデルと名付けた。
B.小細胞性オキシトシン神経細胞の抗体染色像。白色四角で囲われたエリアを右に拡大して示す。上が新生期に治療しなかった対照群、下が治療した群。赤のmCherry(mC)はオキシトシン神経細胞の標識を示す。緑はオキシトシン(OT)に対する抗体染色。青はDAPIによる核染色。スケールバーは200µm。
C.小細胞性オキシトシン神経細胞におけるオキシトシン発現の定量。オレンジが対照群、赤が治療群を示す。治療群では有意に発現量の上昇が見られる。*、**はそれぞれ有意水準0.05、0.01において有意な違いがあることを示す。
D.社会性回復モデルにおける一細胞RNA sequence解析の一例。縦軸はバルプロ酸暴露による社会性不調モデルで小細胞性オキシトシン神経細胞における遺伝子の発現低下を示し、横軸は社会性回復モデルにおける発現変化を示す。いずれ単位はlog2変化量であり、横軸の数値が大きい位置にある点が、発現回復した遺伝子となる。R2は決定係数を示し、p値は相関なしを帰無仮説とする検定の結果。正の相関が認められることから、社会性不調時に発現低下していた遺伝子ほど、社会性回復モデルにおいて発現上昇する(回復する)傾向にあることが分かる。
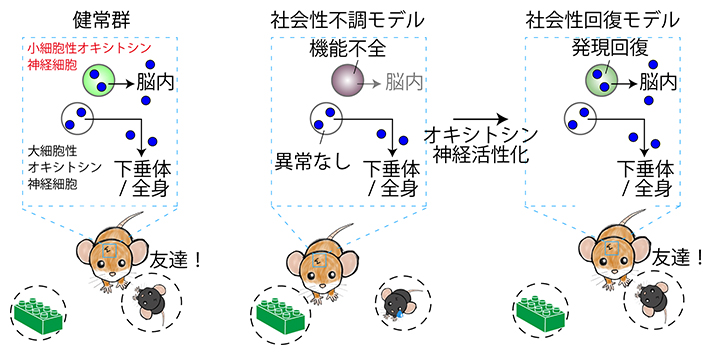
図4 社会性不調モデルマウスにおけるオキシトシン神経細胞の機能不全と回復
本研究のまとめ。視床下部室傍核の細胞のうち、脳内にオキシトシンを分泌する小細胞性オキシトシン神経細胞が環境要因により機能不全となると、オキシトシン合成が阻害されて社会性が不調となる(他個体に対する関心が無生物に対する関心と同程度に低下する)。しかし、新生期もしくは思春期に小細胞性オキシトシン神経細胞を人為的に活性化すると、社会性行動が回復し、この効果はその後も持続する。
今後の期待
今回の研究では、妊娠期のバルプロ酸投与という環境要因による社会性不調モデルマウスを用いることで、社会性の発達障害の背景に小細胞性オキシトシン神経細胞の脆弱性があり、この神経細胞に対する刺激治療が有効である可能性が示されました。これまでに、このような特定の神経細胞の脆弱性は、パーキンソン病におけるドーパミン神経細胞など神経変性疾患ではよく知られていましたが、社会性の不調を伴う発達障害のモデルで体系的に検討されたのは初めてのことです。今後は、さまざまな遺伝子変異による社会性不調モデルマウスでも共通して、小細胞性オキシトシン神経細胞に選択的なダメージがあるのかを検討することが重要です。また、小細胞性オキシトシン神経細胞の脆弱性が生じる原因についてもさらなる研究が必要です。
自閉スペクトラム症の治療戦略の一環として、鼻粘膜からオキシトシンを吸収させる経鼻スプレーが試されていますが、現時点では治療効果は限定的であると考えられています。本研究で確立した社会性不調の回復モデルは、遺伝子組み換えを伴う薬理遺伝学の手法を用いているため直ちにヒトへと応用することはできません。しかし、社会性回復モデルにおける刺激条件や遺伝子発現回復のメカニズムを深く理解することは、ヒトの社会性不調の治療標的を検討する上でも重要なステップになると期待されます。
補足説明
1.社会性コミュニケーション、社会性不調モデルマウス
社会性コミュニケーションとは、自分の気持ちや感情を他人に伝えたり、他人の感情や言葉の意図を理解して行動したりするなど社会性に関わるコミュニケーションを指す。マウスの社会性を評価する実験の一つとして、対象となるマウスが他者(一緒に過ごしたことのないマウス個体)と無生物のどちらにより興味を示したかの行動観察を行い、他個体に対する関心が無生物よりも高くなかった場合を「社会性不調」とする。社会性不調モデルマウスは、遺伝子変異や環境操作によりこの行動が再現されるマウスのこと。
2.オキシトシン神経細胞
視床下部室傍核や視索上核に存在しペプチドホルモンオキシトシンを生産する神経。下垂体に投射して血中にオキシトシンを分泌する大細胞性オキシトシン神経細胞と中枢神経系にオキシトシンを分泌する小細胞性オキシトシン神経細胞が知られる。20世紀には出産時の子宮筋の収縮や授乳時の射乳における重要性に着目した研究がなされてきた。近年、小細胞性オキシトシン神経細胞が着目され、社会性行動を亢進させる作用について活発な研究が進められている。
3.自閉スペクトラム症
自閉スペクトラム症は神経発達障害の一種。主に社会性コミュニケーションの低下、特定の物事への強いこだわりや反復行動を特徴とする。多数の関連する遺伝子変異や胎児期の環境要因が報告されているが、いまだ多くの自閉スペクトラム症は原因が分かっていない。
4.バルプロ酸
バルプロ酸ナトリウムは広く使用される抗てんかん薬、抗躁薬。脳内で抑制性伝達物質GABAのシグナルを増強することで鎮静作用をもたらす。しかし、妊婦が服用した場合、量によっては子に中枢神経の障害や自閉症などの発達障害が発症する危険性が増えることが報告されている。バルプロ酸は遺伝子を制御する酵素(ヒストン脱アセチル化酵素)の働きを妨げることが知られており、高次機能障害の原因と考えられている。
5.視床下部室傍核(しつぼうかく)
脳視床下部は、内分泌や自律機能の調節を担い生理機能をつかさどる中枢領域。視床下部は特定の機能をつかさどる数多くの神経核(細胞の集まり)から構成されており、室傍核や視索上核はその一つである。特に室傍核はオキシトシン神経細胞のほか、抗利尿ホルモンとして有名なバソプレシンや、ストレス応答に重要なコルチコトロピン放出ホルモンを分泌する神経細胞などから構成され、神経内分泌の中枢の一つである。
6.一細胞RNA sequence法
DNAシーケンサーを用いて、一細胞中に含まれるRNAの量や種類を網羅的に決定する手法。細胞ごとの遺伝子発現プロファイルを基に細胞集団を分類し、各集団に含まれる細胞タイプ、割合、特徴的な遺伝子発現を同定できる。疾患に伴う遺伝子発現状態の変化を細胞タイプごとに観察できるため、バルクの解析では埋もれていた遺伝子発現状態の変化や細胞ごとの変化を検出できる。一細胞の単離が難しい神経細胞では、細胞の代わりに単離した核を用いるのが一般的で、本研究でも核を用いた解析を実施している。
7.薬理遺伝学
神経科学のツールとしての薬理遺伝学とは、ある薬剤に特異的に応答して神経活動を操作できる人工的な受容体を用いて、特定の神経細胞集団の活動を操作する技術を指す。本研究では、ヒトのアセチルコリン受容体を改変して薬剤CNOにより人為的に活性化され、神経活動を亢進させるhM3Dq受容体が用いられた。
研究チーム
理化学研究所 生命機能科学研究センター 比較コネクトミクス研究チーム
チームリーダー 宮道 和成(ミヤミチ・カズナリ)
研究員 後藤 哲平(ゴトウ・テッペイ)
大学院生リサーチ・アソシエイト 鶴谷 雅文(ツルタニ・マサフミ)
テクニカルスタッフ 萩原 光恵(ハギハラ・ミツエ)
テクニカルスタッフ 入江 さつき(イリエ・サツキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、理化学研究所大学院生リサーチ・アソシエイト制度「自閉症スペクトラム(ASD)モデルマウスにおけるオキシトシン神経回路(鶴谷雅文)」、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「ニューロンの個性と接続パターンとを結び付ける新規技術で解明する脳の性差と進化(研究代表者:宮道和成)」などによる助成を受けて行われました。
原論文情報
Masafumi Tsurutani, Teppei Goto, Mitsue Hagihara, Satsuki Irie, Kazunari Miyamichi, “Selective Vulnerability of Parvocellular Oxytocin Neurons in Social Dysfunction”, Nature Communications, 10.1038/s41467-024-53092-w
発表者
理化学研究所
生命機能科学研究センター 比較コネクトミクス研究チーム
チームリーダー 宮道 和成(ミヤミチ・カズナリ)
大学院生リサーチ・アソシエイト 鶴谷 雅文(ツルタニ・マサフミ)
報道担当
理化学研究所 広報室 報道担当