2024-12-04 京都大学iPS細胞研究所
ポイント
- BMP-9が進行性骨化性線維異形成症(FOP)の異所性骨化の初期段階にみられる細胞増殖を促す作用をもつことを明らかにした。
- FOPマウスモデルにおいて、異所性骨化の原因となる骨格筋の損傷後、BMP-9が産生されることを見出した。
- FOPマウスモデルにおいて、BMP-9の作用を阻害することにより異所性骨の形成を抑制できることを示した。
1. 要旨
池谷真 准教授(CiRA臨床応用研究部門)、趙成珠 准教授(重慶医科大学検査医学院、元:CiRA同部門 研究員)らの共同研究グループは、進行性骨化性線維異形成症(FOP)の異所性骨化の初期段階でみられる間葉系間質細胞注1)の増殖にBMP-9注2)が関わることを明らかにしました。今後、FOPの進行を早期に抑える治療法の開発に役立つと考えられます。
この研究成果は2024年12月3日(英国時間)に国際科学誌「EMBO Molecular Medicine」でオンライン公開されました。
2. 研究の背景
FOPは難治性遺伝性疾患の一つで、筋肉や腱、靭帯などに徐々に骨ができてしまう病気です。筋肉などの組織中に存在する間葉系間質細胞が刺激を受けて増殖し(フレアアップ)、軟骨細胞への変化を経て、最終的に骨組織を形成する「異所性骨化」が進行することで、手足の動く範囲が狭くなったり、背中が変形したりします。これまでの研究により、骨形成に関わるBMPの受容体の一つであるACVR1遺伝子に突然変異が生じ、変異したACVR1が通常と異なる働きをすることでFOPの症状が引き起こされることがわかっています。
間葉系間質細胞が増殖するフレアアップでは、筋組織の破壊、免疫細胞の侵入、増殖性の線維組織の形成がみられ、その後に異所性骨化へと移行していきます。フレアアップは、患部の腫れや痛みなどの原因となり、患者さんに苦痛をもたらします。そのため、本研究では、FOPの進行を早期に抑える治療法開発のため、異所性骨化の前段階であるフレアアップの仕組みを解明することを目指しました。
研究グループはこれまでに、間葉系間質細胞をFOP患者さん由来のiPS細胞(疾患iPS細胞)から作製し(CiRAニュース2015年3月13日)、FOP患者さんの幹部の細胞を高精度に再現した疾患モデル細胞としてFOPの症状の悪化につながる因子の解明(CiRAニュース2015年12月1日)や骨化を抑える治療薬の候補の発見(CiRAニュース2017年8月1日)などの成果につなげてきました。本研究では、疾患iPS細胞から作製した間葉系間質細胞を増殖させるリガンド注3)を新たに探索し、BMP-9がTGF-βシグナル経路を活性化させることで細胞を増殖させることを突き止めました。
同様に、本研究グループがこれまでに開発したFOPモデルマウスでもBMP-9がTGF-βシグナルを活性化させ、患部の細胞増殖を促すことを確認しました。さらに、BMP-9を阻害することで、フレアアップや異所性骨化を軽減できることを明らかにしました。
これらの研究成果は、FOP患者さんの異所性骨化が進行する早期の病態の理解を深め、新たな治療法の開発に役立つと期待されます。
3. 研究結果
1)BMP-9はFOP原因遺伝子変異のある間葉系間質細胞の増殖を促進する
FOP患者さん由来のiPS細胞と、そこからFOP原因遺伝子ACVR1の変異を正常に戻したiPS細胞を用いて間葉系間質細胞(FOP-iMSCおよびresFOP-iMSC)をそれぞれ作製し、FOP-iMSCをより活発に増殖させるリガンドを探索しました。
TGF-βスーパーファミリーと呼ばれるリガンド群が2種類の間葉系間質細胞を増殖させる作用を比較した結果、多くのリガンドは、どちらも増殖させるか、どちらにも増殖作用を示しないものでした。一方で、BMP-9はresFOP-iMSCに対するFOP-iMSCの増殖促進作用が大きいことがわかりました(図1)。
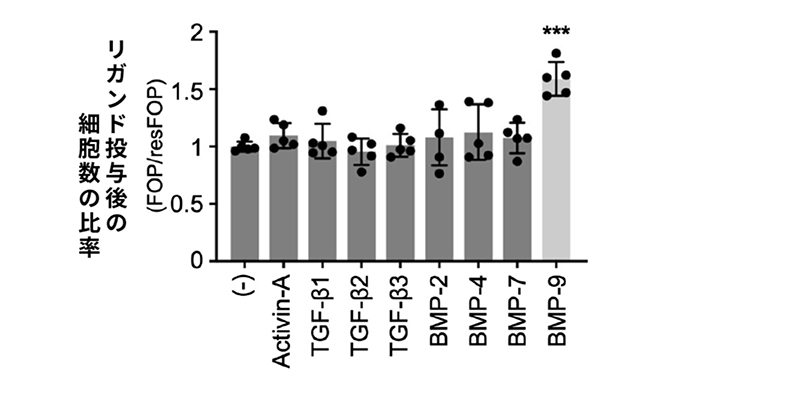
図1. BMP-9によるFOP-iMSCの増殖促進作用
次に、薬剤を投与することでACVR1の変異を誘導できるFOPモデルマウスを用いて、生体でもBMP-9がフレアアップで見られる細胞増殖に作用するかを調べました。その結果、ACVR1変異を誘導したFOPモデルマウスにおいて、BMP-9を投与した部位に腫れが生じ、間葉系間質細胞が有意に増殖することを確認しました(図2)。
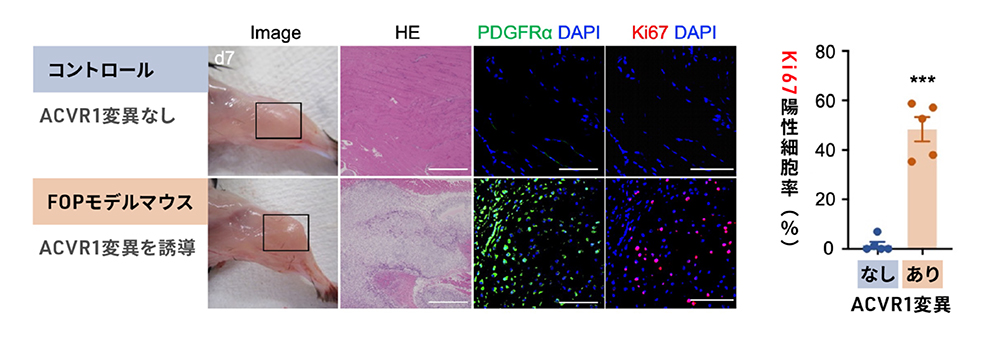
図2. FOPモデルマウスへのBMP-9投与による細胞増殖促進作用
左:FOP原因遺伝子(ACVR1)の変異を誘導したマウスと、変異を誘導しないマウスそれぞれにBMP-9を投与してから7日目の様子。左から、BMP-を投与したマウス脚部の様子(Image)、BMP-9投与部分をHE染色した組織の顕微鏡画像(HE)、間葉系間質細胞で発現するタンパク質PDGFRαの免疫染色(PDGFRαDAPI)、増殖している細胞で発現するタンパク質Ki67の免疫染色(Ki67DAPI)。DAPIは細胞核を示す。
右:患部において、増殖活性のあるKi67陽性細胞が占める割合の比較。
2)FOPモデルマウスの骨格筋の損傷によりBMP-9が生産される
BMP-9は創傷治癒や組織の再生が起きている部位で発現することが知られています。そこで、骨格筋の壊死を引き起こす毒性をもつカルディオトキシン(CTX)を用いてFOPモデルマウスの筋肉に損傷を与えたとき、FOPの異所性骨化においても、実際に生体でBMP-9が生産されるかどうかを調べました。
その結果、カルディオトキシン投与後、1日目から14日目にかけて、徐々に血清中のBMP-9量が上昇し、患部の組織でもBMP-9を発現した細胞がみられました(図3)。カルディオトキシン投与後、3日目では損傷部位に集まったマクロファージでBMP-9がみられましたが、7日目には間葉系間質細胞でBMP-9が発現するようになり、異所性骨化が進む14日後には細胞外マトリクスに存在することがわかりました。
これらの結果は、フレアアップから異所性骨化へと進行する過程で、BMP-9が持続的に組織中に存在し間葉系間質細胞の増殖を促す一方で、BMP-9を産生する細胞は経時的に変化することを示しています。
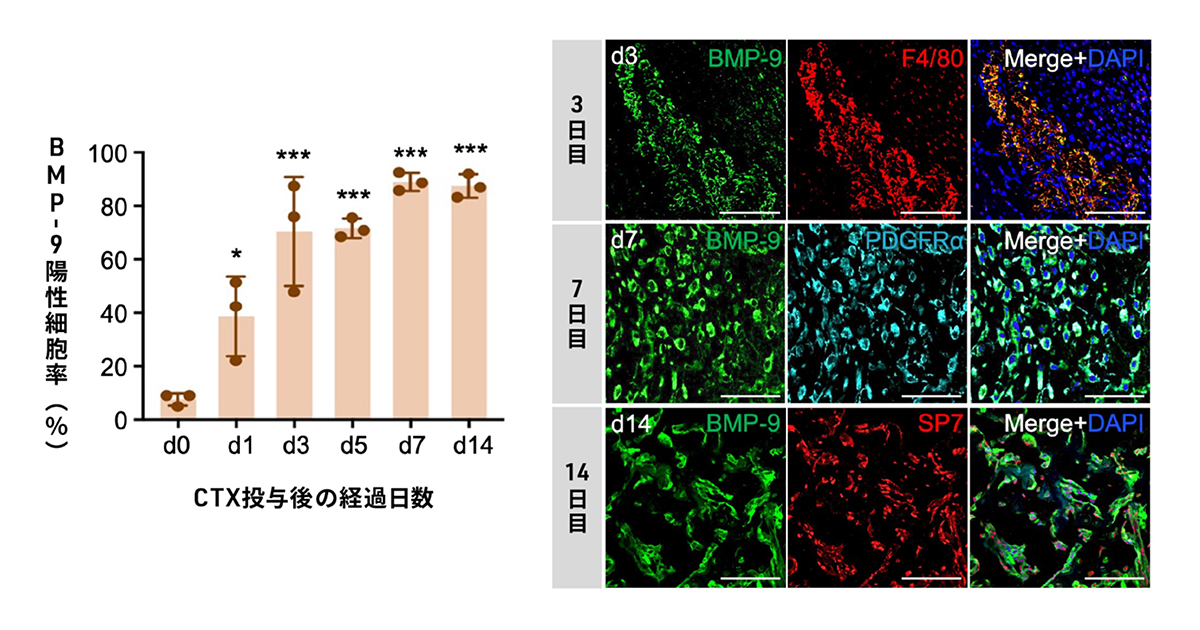
図3. 骨格筋の損傷部位におけるBMP-9陽性細胞
左:CTX投与後0日目(d0)から14日目(d14)における損傷部位のBMP-9陽性細胞の割合
右:CTX投与後3日目(d3)、7日目(d7)、14日目(d14)のBMP-9陽性細胞の免疫染色。F4/80はマクロファージの指標。SP7は、骨や軟骨の指標。
3)FOPモデルマウスにおけるBMP-9の抑制は異所性骨化を軽減する
次に、BMP-9を欠失させたFOPモデルマウスを作製し、BMP-9が存在しない場合に異所性骨が形成されるかを調べました。その結果、ACVR1の変異を誘導し、カルディオトキシンを投与したBMP-9欠損マウスにおいて、BMP-9をもつ同様のFOPモデルマウスと比較して、異所性骨の形成が抑制されることがわかりました(図4A)。
また、FOPモデルマウスにおいて、カルディオトキシン投与後に、BMP-9の活性を抑えることのできる抗体を投与した結果、初期の病変形成が抑えられることがわかりました(図4B)。
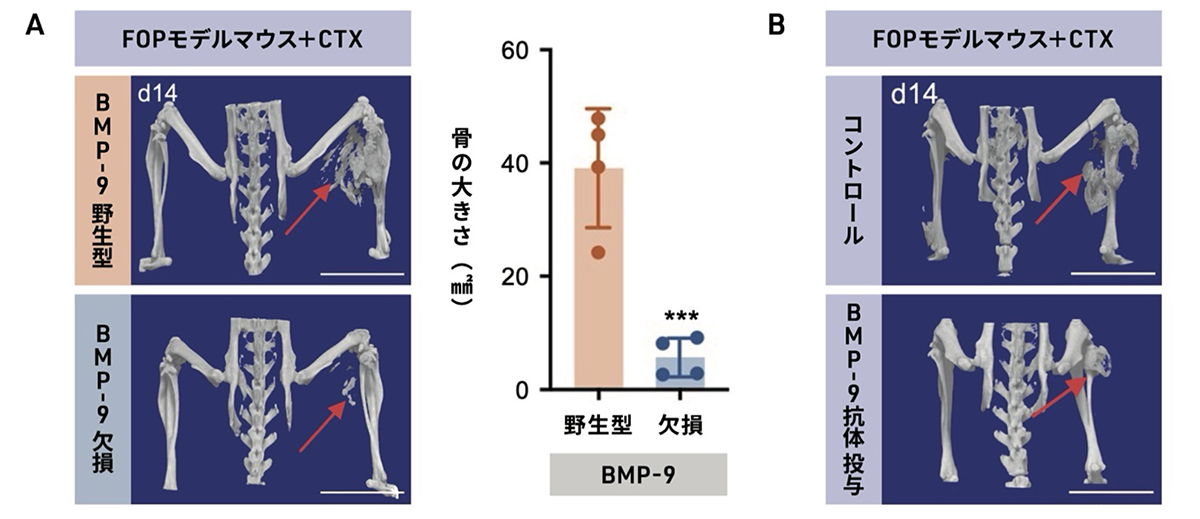
図4. BMP-9の抑制による異所性骨形成への効果
A: BMP-9遺伝子をもつ(野生型)FOPモデルマウスと、BMP-9遺伝子を欠損したFOPモデルマウスに、カルディオトキシン(CTX)を投与した。その結果、BMP-9欠損FOPモデルマウスは、異所性骨の形成が有意に抑えられた。
B:FOPモデルマウスにカルディオトキシン(CTX)を投与直後から2週間、BMP-9を抑制する抗体を作用したところ、異所性骨の形成が有意に抑えられた。
4)BMP-9はFOP-iMSCおよびFOPモデルマウスのTGF-βシグナルを活性化する
BMP-9によりFOP-iMSCおよびFOPモデルマウスにおいて誘導される細胞増殖のメカニズムを調べました。その結果、ACVR1変異をもつ間葉系間質細胞およびマウスにおいて、TGF-βシグナル系が亢進していることが明らかになりました。さらなる解析の結果、BMP-9が受容体である変異したFOP原因遺伝子ACVR1を介して、通常ではみられないシグナル伝達経路の活性化を起こすことが明らかになりました。
4. まとめ
本研究では、研究グループがこれまでに開発した、FOP患者さんiPS細胞由来間葉系幹細胞やFOPモデルマウスなどの疾患モデルを活用し、FOPにおける異所性骨化の早期であるフレアアップの分子メカニズムの一端を新たに明らかにしました。本研究成果がFOP患者さんの異所性骨化を早期に抑える新たな治療法の開発に役立つことが期待されます。
5. 論文名と著者
論文名
BMP-9 mediates fibroproliferation in fibrodysplasia ossificans progressiva through TGF-β signaling
ジャーナル名
EMBO Molecular Medicine
著者
Chengzhu Zhao1,2,*, Yoshiko Inada2, Souta Motoike2, Daisuke Kamiya2,3, Kyosuke Hino2,4,
Makoto Ikeya2,3,*
著者の所属機関
- 重慶医科大学 検査医学院
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 住友ファーマ株式会社
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
– 再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」
– 再生・細胞医療・遺伝子治療実現加速化プログラム「再生・細胞医療・遺伝子治療研究中核拠点」 - 日本学術振興会 科学研究費(19K16540, 21K06855)
- 中国国家自然科学基金委員会 青年科学基金プロジェクト(No.82202655)
- 重慶市自然科学基金(CSTB2024NCSQ-MSX0457)
- iPS細胞研究基金
7. 用語説明
注1)間葉系間質細胞
骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。本報では、iPS細胞から作製したものをiMSC(induced Mesenchymal Stromal Cell)としている。
注2)BMP-9
骨組織や軟骨の分化を誘導、促進するタンパク質群BMPファミリーうちの一つ。
注3)リガンド
特定の受容体に特異的に結合する物質。