2024-12-20 理化学研究所
理化学研究所(理研)脳神経科学研究センター タンパク質構造疾患研究チームのハワード・チ・ハオ・シェン 国際プログラム・アソシエイト(研究当時)、小見 悠介 研究員(研究当時)、中川 幸姫 学振特別研究員PD、田中 元雅 チームリーダーらの共同研究グループは、酵母シャペロンタンパク質[1]のアミロイド[2]への結合部位を決定し、新たなアミロイドの脱凝集メカニズムを解明しました。
本研究成果は、これまで治療困難であった神経変性疾患[3]の創薬開発に貢献すると期待されます。
今回、共同研究グループは、核磁気共鳴法(NMR)[4]などを用いて安定同位体元素でラベルされた酵母のプリオンタンパク質[5]「Sup35」と各種酵母シャペロンタンパク質の結合部位を同定しました。さらに、Sup35のカルボキシル末端(C末端)側に、熱ショックタンパク質の一つ、Hsp70であるSsa1の結合アミノ酸配列を付与したSup35アミロイドを作製して、酵母シャペロンタンパク質による分断効果を調べました。Sup35アミロイドの17番目のセリンをアルギニンに置換した(S17R)変異体アミロイドは、Sup35の野生型アミロイドと比較して、通常、酵母シャペロンタンパク質による分断効果が低いのですが、このS17R変異体アミロイドでも、脱凝集が促進されることを見いだしました。以上から、Sup35アミロイドの分断にはSsa1のアミロイドへの結合が重要であることが分かりました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences(PNAS)』オンライン版(12月10日付)に掲載されました。
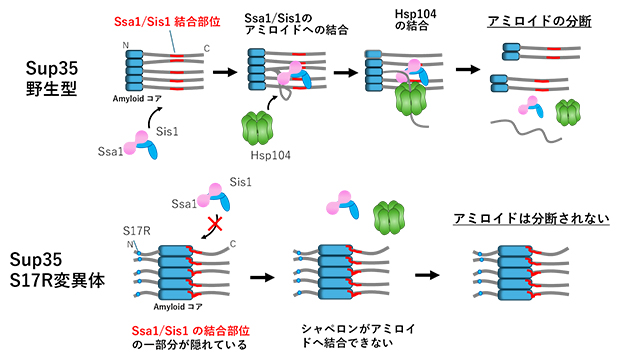
シャペロンタンパク質によるアミロイドの分断メカニズム
背景
アルツハイマー型認知症やハンチントン病などの多くの神経変性疾患では、原因タンパク質の凝集に伴って線維状の凝集体(アミロイド)が形成されるという特徴があります。神経変性疾患の発症や進行には、アミロイドが脳内に存在する細胞から周りの細胞へと伝播することが深く関わっています。これまで田中チームリーダーらはアミロイドの伝播機構を明らかにするために、その解析がしやすい「酵母プリオンの系」を用いてきました。
酵母のSup35は、酵母細胞内でアミロイド線維状のプリオン凝集体を形成しますが、それは細胞内で脱凝集されて小さなシード(種)となり、細胞分裂後の娘細胞に伝播されることが分かっています。このように細胞間伝播に重要なアミロイドの脱凝集にはSsa1のほかSis1、Hsp104という三つのシャペロンタンパク質の関与が示唆されていますが、脱凝集の詳しいメカニズムは不明なままでした。
研究手法と成果
共同研究グループは安定同位体元素でラベルしたSup35と高度に精製したシャペロンタンパク質を用いて核磁気共鳴法(NMR)によって、Sup35アミロイド内におけるSsa1、Sis1、Hsp104の各シャペロンタンパク質の結合部位を調べました。特に、Ssa1とSis1はSup35アミロイドに最初に結合することが以前の田中チームリーダー、中川学振特別研究員PDらの研究注1)で分かっているため、それらシャペロンタンパク質の結合部位の解明に注力しました。その結果、Sup35アミロイドにSsa1のみを加えたときと、Ssa1とSis1の両方を加えたときは同じ部位(143-164番目のアミノ酸)に結合することが分かりました(図1)。一方でSis1のみを加えたときの結合部位(181-193と212-222番目のアミノ酸)は、Ssa1の結合領域とは異なりました。
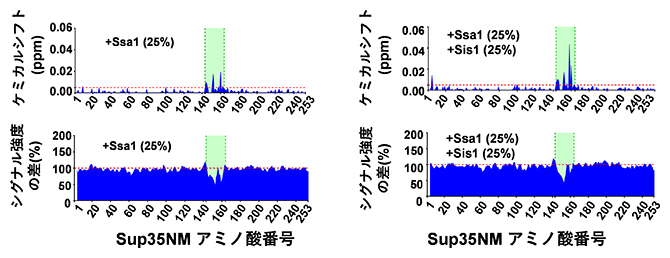
図1 NMRを使ったシャペロンタンパク質のSup35への結合領域の解析
NMRを使って、安定同位体元素(15N)でラベルしたSup35とシャペロンタンパク質の混合溶液を測定することでSup35へのシャペロンタンパク質の結合を測定した。Sup35の143-164アミノ酸領域でシャペロンタンパク質(Ssa1もしくはSsa1/Sis1の複合体)とSup35の結合を示すNMRシグナルの変化が見られている(緑)。
この結果はSsa1とSis1は複合体を形成し、143-164番目のアミノ酸領域に結合することでアミロイドの脱凝集を開始させることが示唆されました。そこで、Ssa1の結合部位を欠損させたSup35アミロイドを作製し、Ssa1/Sis1/Hsp104シャペロンタンパク質によるアミロイドの脱凝集を、アミロイドに特異的に結合する蛍光分子チオフラビンTでモニターしました。その結果、Ssa1の結合部位を欠損させたSup35アミロイドではSsa1/Sis1/Hsp104の添加で蛍光が下がらず、シャペロンタンパク質による脱凝集が抑制されました(図2右:ピンクのライン)。
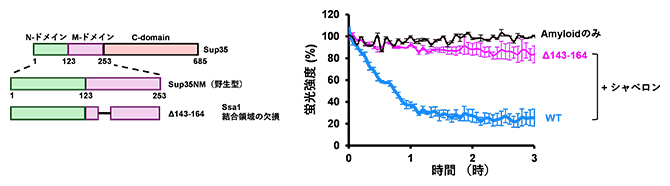
図2 Ssa1シャペロンタンパク質のSup35アミロイドへの結合が脱凝集に与える影響
シャペロンタンパク質(Ssa1)の結合領域を欠損させたSup35アミロイドを作製して(左)、シャペロンタンパク質による脱凝集を、アミロイドへ特異的に結合する蛍光分子チオフラビンTの蛍光強度から検出した(右)。Ssa1の結合領域の欠損( 143-164)では脱凝集の阻害が見られた(右:ピンクのライン)。WT:野生型Sup35。
次に、アミロイドの構造が野生型のSup35と異なるS17R変異体のアミロイドを脱凝集実験に用いたところ、これまでの田中チームリーダーらの研究注2)から予想された通り、脱凝集されないことが分かりました。そこで、S17R変異体にSsa1の結合部位をC末端側に付与させたM1[S17R]アミロイドを作製して用いたところ、シャペロンタンパク質によるアミロイドの脱凝集が促進されることを見いだしました(図3右:緑のライン)。
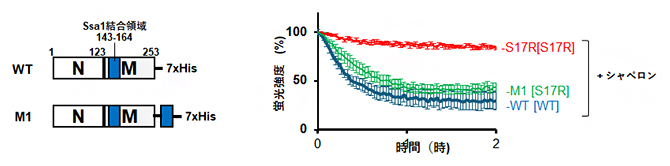
図3 Ssa1結合領域の付与による脱凝集への影響
Ssa1を付与した変異体を作製して(左)、シャペロンタンパク質による脱凝集を、アミロイドへ特異的に結合する蛍光分子チオフラビンTの蛍光強度から検出した(右)。Ssa1の結合領域をSup35のC末端に付与した変異体(M1)では、本来脱凝集されにくいS17Rのアミロイドでも野生型のアミロイドと同様に脱凝集された(右:赤と緑、紺色のラインの比較)。WT:野生型Sup35、His:ヒスチジン(タンパク質を構成するアミノ酸の一つ)。
また、それぞれ別の蛍光色素で標識したS17R変異体のアミロイドとS17R変異体にSsa1の結合領域を付与したM1[S17R]アミロイドを用いて、Ssa1またはHsp104の結合を蛍光顕微鏡下で観察しました。その結果、S17R変異体アミロイドへはシャペロンタンパク質の結合がほとんど見られないのに対して、M1[S17R]変異体アミロイドでは各シャペロンタンパク質の結合が見られました。
これらの結果は、S17R変異体のアミロイドコア(81-148アミノ酸領域)から離れた部位にSsa1結合領域を付加させることで、本来脱凝集できないようなS17R変異体のアミロイドでも脱凝集させることができることを示しています。
さらに、HAP/ClpPというタンパク質を分解する酵素をHsp104の代替としたハイブリッド酵素を用いることで、野生型のSup35アミロイドだけでなく、S17R変異体のアミロイドも、脱凝集にとどまらず、分解もすることができました。
注1)2022年2月18日プレスリリース「アミロイドの脱凝集メカニズムを解明」
注2)2018年3月22日プレスリリース「アミロイド構造の多様性の原因解明」
今後の期待
本研究は、酵母プリオンSup35アミロイドの脱凝集の過程で、アミロイドコアから離れ露出したアミノ酸領域へのSsa1の結合が重要であることを明らかにしました。
本研究成果は、酵母プリオンの伝播機構だけでなく、ヒトの神経変性疾患の原因となり得るアミロイドの脱凝集過程の理解につながります。さらに、シャペロンタンパク質による脱凝集や分解は、将来的に新たな治療戦略としても期待されます。
補足説明
1.シャペロンタンパク質
タンパク質の正しいフォールディング(折り畳み)を助けるなど、凝集を解きほぐす機能を持つタンパク質の総称であり、原核生物から真核生物まで保存されているものも多い。
2.アミロイド
βシート構造に富んだ線維状のタンパク質の凝集体。界面活性剤やタンパク質分解酵素に抵抗性があるため、組織に蓄積しやすく、アルツハイマー病やプリオン病などのヒト疾患の原因となる。
3.神経変性疾患
神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起こると考えられている。アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)、プリオン病などが知られている。
4.核磁気共鳴法(NMR)
強い磁場で分子の核スピンをそろえ電磁波をパルスとして照射することで核磁気共鳴を起こし、電磁波の吸収の周波数や強度の変化からタンパク質の構造や分子間の相互作用を解析する方法。NMRはnuclear magnetic resonanceの略。
5.プリオンタンパク質
プリオンとはタンパク質から成る遺伝因子であり、プリオンを構成するタンパク質のことをプリオンタンパク質と呼ぶ。哺乳類では、狂牛病などの原因となるプリオンタンパク質(PrP)が知られている。出芽酵母では、Sup35やUre2などのプリオンタンパク質が知られている。
共同研究グループ
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(タナカ・モトマサ)
国際プログラム・アソシエイト(研究当時)ハワード・チ・ハオ・シェン(Howard C.-H. Shen)
学振特別研究員PD 中川 幸姫(ナカガワ・ヨシコ)
研究員 野村 高志(ノムラ・タカシ)
テクニカルスタッフⅡ 木村 寛美(キムラ・ヒロミ)
研修生(研究当時)志田 俊信(シダ・トシノブ)
テクニカルスタッフⅠ ジョン・バーク(John Burke)
研修生 玉井 真悟(タマイ・シンゴ)
研究員(研究当時)小見 悠介(コミ・ユウスケ)
(現神経変性疾患連携研究チーム研究員)
創発物性科学研究センター 創発生体関連ソフトマター研究チーム
チームリーダー 石田 康博(イシダ・ヤスヒロ)
岐阜大学 糖鎖生命コア研究所
助教 鎌足 雄司(カマタリ・ユウジ)
研究支援
本研究は、RIKEN Pioneering Projects 「Biology of Intracellular Environments(研究代表者:田中元雅)」、同「Long-timescale Molecular Chronobiology(研究代表者:田中元雅)」により実施し、日本医療研究開発機構(AMED)AMED-CREST「アミロイドの生成・脱凝集過程に着目した神経変性疾患の病態解明と医療応用(研究代表者:田中元雅)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「細胞内を模倣した再構成系の開発とアミロイドの伝播機序解明(研究代表者:田中元雅)」、同学術変革領域研究(A)「クロススケール細胞内分子構造動態解析が解明するタンパク質凝集化による神経変性機構(研究代表者:田中元雅)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「エントロピー増大に逆らう革新材料『力学極性ゲル』による物質・エネルギー・生物の整流化(研究代表者:石田康博)」、武田振興科学財団研究費「アミロイドの人工的制御を目指して(研究代表者:田中元雅)」などによる助成を受けて行われました。
原論文情報
Chih-hao Howard Shen, Yusuke Komi, Yoshiko Nakagawa, Yuji O. Kamatari, Takashi Nomura, Hiromi Kimura, Toshinobu Shida, John Burke, Shingo Tamai, Yasuhiro Ishida, and Motomasa Tanaka, “Exposed Hsp70-binding site impacts yeast Sup35 prion disaggregation and propagation”, Proceedings of the National Academy of Sciences(PNAS), 10.1073/pnas.2318162121
発表者
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(タナカ・モトマサ)
国際プログラム・アソシエイト(研究当時)ハワード・チ・ハオ・シェン(Howard C.-H. Shen)
学振特別研究員PD 中川 幸姫(ナカガワ・ヨシコ)
研究員(研究当時)小見 悠介(コミ・ユウスケ)
報道担当
理化学研究所 広報室 報道担当