2021-10-07 東京大学,日本医療研究開発機構
発表者
吉崎 歩(東京大学医学部(皮膚科学)/東京大学医学部附属病院 皮膚科 講師)
江畑 慧(東京大学医学部附属病院 皮膚科 助教)
佐藤 伸一(東京大学大学院医学系研究科 皮膚科学/東京大学医学部附属病院 皮膚科 教授)
発表のポイント
- 全身性強皮症に対する新たな保険適用の治療薬として、リツキシマブ(注1)を用いることが可能となりました。
- リツキシマブは全身性強皮症の原因の一端と考えられているB細胞(注2)を除去する作用を持ち、従来の全身性強皮症治療薬と比較して、より根本的な治療薬である可能性があります。
- これまで全身性強皮症に対して保険適用となっている治療法はわずかしかなく、新たな治療法の登場が待ち望まれていました。今回の薬事承認により、患者さんへ保険適用の新たな治療の選択肢を提示できることになります。
発表概要
東京大学医学部附属病院皮膚科の佐藤伸一教授、吉崎歩講師、江畑慧助教らの研究グループによる研究成果に基づいて、全身性強皮症(以下、強皮症)に対する新たな治療薬が厚生労働省より薬事承認されました。
強皮症は、全身に線維化病変(注3)を来す、膠原病に属する自己免疫疾患(注4)の一つです。病気の原因は不明ですが、佐藤伸一教授らは長年の研究によってB細胞が病態形成に重要な役割を果たしていることを見いだしていました(図1)。そして2017年11月から2019年11月にかけて行われた、多施設共同プラセボ対照二重盲検並行群間比較試験(注5)によって、B細胞を除去する薬剤であるリツキシマブの強皮症に対する有効性が証明されました[Ebata S, Yoshizaki A, Sato S, et al. Lancet Rheum 3:e489-97,2021]。本治験は吉崎歩講師を治験調整医師・責任医師とする医師主導治験(注6)として実施されました。この結果をもとに、リツキシマブの製造販売元である全薬工業株式会社より医薬品の規制当局である厚生労働省へ承認申請がなされ、強皮症に対する新たな治療薬として、厚生労働省より2021年9月27日に承認され、保険適用されることとなりました。今回の承認は、公知申請(注7)以外で強皮症そのものに対する治療薬が承認を受けた、初めての事例となります。同時にこれは、新たな治療選択肢を難病である強皮症患者さんへ提示出来るようになったことを意味しています。
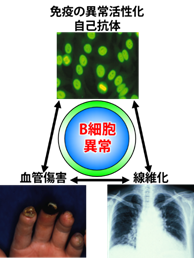
図1.強皮症の病態におけるB細胞の重要性強皮症は自己免疫異常、線維化、血管障害の3つの主な病態から成り立っています。その中心にB細胞異常が存在すると考えられています。[Yoshizaki A, Sato S. Systemic sclerosis. Springer Inc., pp21-37, 2016]
発表内容
強皮症は、皮膚をはじめ、内臓を含めた全身に、線維化病変を来す、膠原病に属する自己免疫疾患です。国内では、少なくとも20,000人以上が罹患していると推測されており、診断基準を満たさない軽症例を含めると40,000人以上の患者が存在すると考えられています。病気の原因は不明で、根本的な治療は存在せず、厚生労働省が定める指定難病(注8)に認定されています。未治療のまま放置すると、症状がしばしば進行し、特に肺線維症と呼ばれる肺に生じた線維化病変は、ときとして致命的となります。
病気の原因は不明ですが、佐藤伸一教授らはこれまでに、強皮症の発症と進展にはB細胞が重要な役割を果たしていることを数多くの基礎的研究によって示してきました。実際、2019年に報告された臨床研究においても、リツキシマブを用いたB細胞除去療法は、従来標準療法であるシクロホスファミド療法よりも有用であることが示唆されており[Ebata S, Yoshizaki A, Sato S, et al. J Dermatol. 2019, 46:1006-13]、諸外国からも強皮症に対するリツキシマブの有効性を支持する結果が報告されていました。従って、リツキシマブによるB細胞除去療法は、強皮症の新たな治療になり得ると国内外から期待されていました。
新たな治療薬が保険適用として使えるようになるまでには、国内においては薬剤の製造販売元が主体となって医師に依頼して治験を行い、その結果を医薬品医療機器総合機構(PMDA)が審査し、厚生労働省が承認するという一連のステップが必要となります。しかしながら、B細胞除去療法は多くの他疾患においても有効であることが示唆されており、リツキシマブの治験が待たれている疾患が数多く存在していたため、製造販売元である全薬工業株式会社に強皮症の治験をすぐに行う予定はありませんでした。そこで、東京大学医学部附属病院皮膚科では吉崎歩講師を「自ら治験を実施する者」とする体制で、多施設共同医師主導治験が実施されました。この治験は、国立研究開発法人日本医療研究開発機構(AMED)「難治性疾患実用化研究事業」の支援と、リツキシマブの製造販売元である全薬工業株式会社の支援(治験費用の一部と治験薬の無償供与)を受け、東京大学医学部附属病院治験審査委員会の承認のもと、プラセボ対照二重盲検並行群間比較試験として実施されました(ClinicalTrials.gov:NCT04274257,UMIN-CTR:UMIN000030139)。
2017年11月より国内の4施設で開始されたこの治験は2019年11月に完了し、主要評価項目(注9)として設定された皮膚硬化の指標である修正ロドナンスキンスコアと、副次評価項目として設定された肺線維症の指標である%努力性肺活量において、リツキシマブによる有意な改善が認められました。この結果は、膠原病分野を代表する雑誌の一つである英国誌The Lancet Rheumatology誌(オンライン版:日本時間2021年5月27日)に掲載されました。さらにこの治験は、過去に行われた臨床研究の結果から、主要評価項目である皮膚硬化に対するリツキシマブの有効性を予め統計学的に予測し、これを検証する形で行われた検証的治験でした。つまり、この治験結果により、リツキシマブは強皮症の皮膚硬化に対して有効であることが科学的に証明されたことになります。これらのことは、PMDAの審査でも認められ、その結果、厚生労働省より、リツキシマブは強皮症の合併症に対してではなく、強皮症自体に対する治療薬として、公知申請以外では初めて薬事承認されるに至りました。B細胞は強皮症を引き起こす病態の根元に近いと考えられていますので、リツキシマブによるB細胞除去療法は従来療法と比べて、より根本的な新しい強皮症治療薬と言えます。これにより、従来よりも多くの強皮症患者さん達へ、新たな治療の選択肢を届けられることが期待されています。
用語解説
- (注1)リツキシマブ
- B細胞にあるCD20というタンパク質に結合し、B細胞を体内から除去する作用を持つ、分子標的薬と呼ばれるお薬のひとつです。
- (注2)B細胞
- 人体に備わる免疫は、細菌やウイルスといった体外からやってきた異物を攻撃し、排除します。B細胞はこの免疫系を構成する細胞の一つで、リンパ球と呼ばれる集団に属します。B細胞は抗体を産生することによって、異物を排除する機能を持っています。
- (注3)線維化病変
- 膠原線維(コラーゲン)と呼ばれる細胞同士の隙間を埋め、肌の張りなどを保っているタンパク質が異常に増え、皮膚や内臓などの組織が硬くなる病変のことを指します。
- (注4)自己免疫疾患
- 外来異物から自身を守る免疫が、何らかの原因で、自分自身を攻撃してしまうようになり、これによって生じる疾患を総称して自己免疫疾患と呼びます。
- (注5)二重盲検並行群間比較試験
- 二重盲検比較試験とは、実施に関わるすべての人が、投与される薬がプラセボか実薬かを知らされずに行われる試験のことです。この方法を採用することで、評価に主観やプラセボ効果が入ることを防げます。プラセボ対照並行群間比較試験は、被験者を無作為に、実薬を投与するグループとプラセボを投与するグループに分け、両群同時に、同じ期間、薬を投与する試験デザインです。この手法により、被験薬の効果や安全性を相対的に評価することが可能になります。両者を組み合わせたプラセボ対照二重盲検並行群間比較試験は、新規の治療薬の有効性・安全性を正確に評価できるので、薬事承認の可否を決定する目的で実施される治験の中で、最も標準的な手法です。
- (注6)医師主導治験
- 製薬会社が行う一般的な治験とは異なり、対象疾患を専門とする医師が中心となって、自ら行う治験のことです。実際に患者さんの診療に当たっている医師らが、日常の診療から、ぜひ解決する必要があると考えた医学的な課題に基づいて計画されます。
- (注7)公知申請
- 国内における医薬品のうち、その疾患に対する治療薬として十分な科学的根拠があり、国外で既に治療薬として承認されていて、十分な使用実績がある、等の様々な条件を満たした場合、治験の全部または一部を省略しても承認申請できる制度のことです。
- (注8)指定難病
- 「難病の患者に対する医療等に関する法律(難病法)」第5条第1項にもとづき指定される疾病です。難病の定義である4つの条件(1:発病の機構が明らかでない、2:治療方法が確立していない、3:希少な疾病、4:長期の療養を必要とする)を満たし、患者数が国内において一定の人数(0.1%程度)に達せず、客観的な診断基準が確立していること等の要件を満たす疾病が必要な手続きを経て指定難病に定められています。
- (注9)評価項目
- 治験において評価される項目は主に主要評価項目と副次評価項目に分けられます。主要評価項目は、治験薬の有効性を評価する目的で、治験開始前に設定しておく、最も優先度が高い評価項目です。臨床的な意義が確立されており、なおかつ客観的に評価しやすい項目を、通常一つだけ設定します。主要評価項目が達成されることで初めて、治験薬の効果を立証することが出来ます。一方、主要評価項目以外の補足的な評価項目は、副次評価項目と呼ばれます。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 皮膚科
講師 吉崎 歩(よしざき あゆみ)
広報担当者連絡先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
AMED事業に関するお問い合わせ先
日本医療研究開発機構
創薬事業部 創薬企画・評価課
難治性疾患実用化研究事業担当