2024-12-20 量子科学技術研究開発機構
ポイント
- 細胞中のDNAに生じた傷には、その傷の種類ごとに異なる修復方法が働くことが知られていますが、細胞が死に至る程重篤なDNAの傷がどのような構造で、尚且つどのように修復されるのか明らかではありませんでした。
- 独自のナノレベル観察技術を用い、重篤なDNAの傷の修復方法を初めて特定しました。
- この修復方法を阻害する薬剤を開発すれば、重粒子線治療によって十分な殺傷効果が得られにくかったがん細胞に対し、より効果的に消滅させることも可能となります。
概要
量子科学技術研究開発機構「(理事長 小安重夫。以下「QST」)関西光量子科学研究所 量子応用光学研究部 照射細胞応答研究プロジェクトの中野敏彰上席研究員、赤松憲上席研究員、鹿園直哉プロジェクトリーダーらは、細胞内で生じる重篤なDNAの傷の修復メカニズムを、独自のナノレベル観察技術を駆使して解明しました。この発見は、極めて効率的ながん治療法の確立に繋がると期待されます。
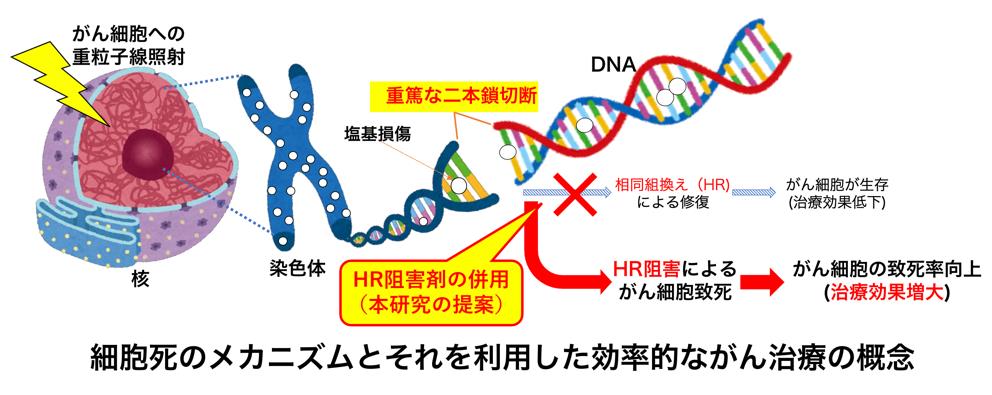
DNAの傷の中でも、特に細胞死に至るほどの重篤な傷は、放射線の一種である重粒子線を細胞に当てた時に生じます。この重粒子線をがん組織に集中させることで、がんのDNAに重篤な傷を負わせ、効率的にがん細胞のみを消滅させる治療法が、重粒子線がん治療(用語解説)です。この治療法は正常細胞への影響も少なく、非常に効果的ではありますが、一部の症例では効果が低く、がんのDNAに付けた傷が何らかのメカニズムで修復されてしまっていると考えられていました。
メカニズムの特定のために、重篤な傷の状態を詳しく調べる必要がありました。従来の一般的な蛍光顕微鏡では分解能が低いため、本研究グループは、DNAの傷の一つ一つに目印をつけた後原子間力顕微鏡(AFM)で観察するという、ナノスケールで解析可能な顕微技術(用語解説)を開発しました。このDNAの傷を直接観察する独自の技術を駆使して、重粒子線によって生じた重篤なDNAの傷(二本鎖切断)のうち、切断部に塩基損傷(用語解説)を含む複雑な構造を持つものが最も重篤であることを明らかにしました。さらに、この最も重篤な二本鎖切断であっても「相同組換え(HR)」と呼ばれるメカニズムが働いて修復されることを発見しました。
今回の発見により、最も重篤な傷の修復を阻害する薬剤を開発し、重粒子線治療と併用することができれば、重粒子線の治療効果を大幅に向上させることが可能となり、極めて効率的ながん治療法につながると期待されます。
本研究は、科学研究費助成事業(JP21K12248, JP24K03084)の助成を一部受けて実施されたもので、オックスフォード大学出版局発行の「Nucleic Acids Research」の(オンライン版)に令和6年12月20日に掲載されました。
研究開発の背景と目的
炭素イオンなどの重粒子を使う放射線がん治療の一種である重粒子線治療は、非常に効果的な先進的手法として広く認識されています。この治療法は、正常細胞への影響を最小限に抑えつつ、がん細胞へ集中的に放射線を照射することが可能であり、高い治療効果と安全性を兼ね備えた画期的な手法です。これまでの研究により、重粒子線照射では修復が困難なDNA損傷を引き起こすと考えられています。がん細胞に修復が困難なDNA損傷が生じると、これが鍵となって細胞死を誘導し、がん細胞が組織から排除されることで治療効果が得られると考えられます。一方で、重粒子線治療でも根治が難しい場合が知られています。この場合は、DNA損傷の一部が修復されてしまい、その結果、治療効果の低下を招いているのではないかと仮説をたてました。そこで、私たちは修復困難なDNA損傷を特定し、その修復メカニズムを明らかにすることで、重粒子線治療のさらなる効率化を目指して研究を進めてきました。
研究の手法と成果
放射線によって様々な種類のDNA損傷(塩基損傷や鎖切断)が生じることは知られており、その中でも二本鎖切断は細胞にとって特に重篤なDNA損傷であり細胞死に大きく影響すると考えられています。また、これまでの研究から、修復されやすい二本鎖切断と修復困難な二本鎖切断が存在することが知られていました。しかしながら、そのメカニズムは十分に解明されていませんでした。
我々は、修復されやすい二本鎖切断と修復困難な二本鎖切断が存在するのは、単純な構造と複雑な構造を持つ二本鎖切断が存在することが原因であると考え、特に複雑な二本鎖切断の生成とその修復を詳細に調べました。既存の蛍光顕微鏡では分解能が低く二本鎖切断の複雑度がわからないため、我々のグループで開発した、原子間力顕微鏡(AFM)を利用してDNA損傷を直接観察する方法(図1)(→用語説明)を用い、複雑な二本鎖切断の形態と切断が生じてから修復されるまでの時間経過を調べ、修復速度を比較しました。どのような修復方法が用いられているのかを明らかにするために、二本鎖切断を修復することが知られている2つの修復メカニズムである、非相同末端結合(NHEJ)(→用語解説)の機能と、相同組換え(HR)(→用語解説)の機能をそれぞれ欠損させたヒト細胞(TK6)の突然変異株を用意し、高複雑二本鎖切断の修復速度を調べました(図2)。その結果、塩基損傷が存在する高複雑二本鎖切断は、修復が困難であることがわかりました。さらにNHEJの機能を欠損させた突然変異株(図2赤線)ではNHEJが機能している野生株(図2黒線)と比べて同程度に修復されるのに対し、HRが欠損した突然変異株(図2青線)では修復が明らかに遅くなることがわかりました。この結果は、塩基損傷が存在する高複雑二本鎖切断は主に相同組換えによって修復されることを示しています。
本研究により、修復困難な二本鎖切断がDNA末端に塩基損傷が存在するタイプの二本鎖切断であること、また、このタイプの二本鎖切断は一般的な修復経路であるNHEJでは処理されず、より複雑なHRを必要とすることを初めて明らかにしました。これらの発見は、細胞にとって重篤な損傷の詳細、さらにその修復プロセスを初めて明らかにした点で意義があり、重粒子線が細胞を死に至らしめるメカニズムの理解を格段に進めるものです。
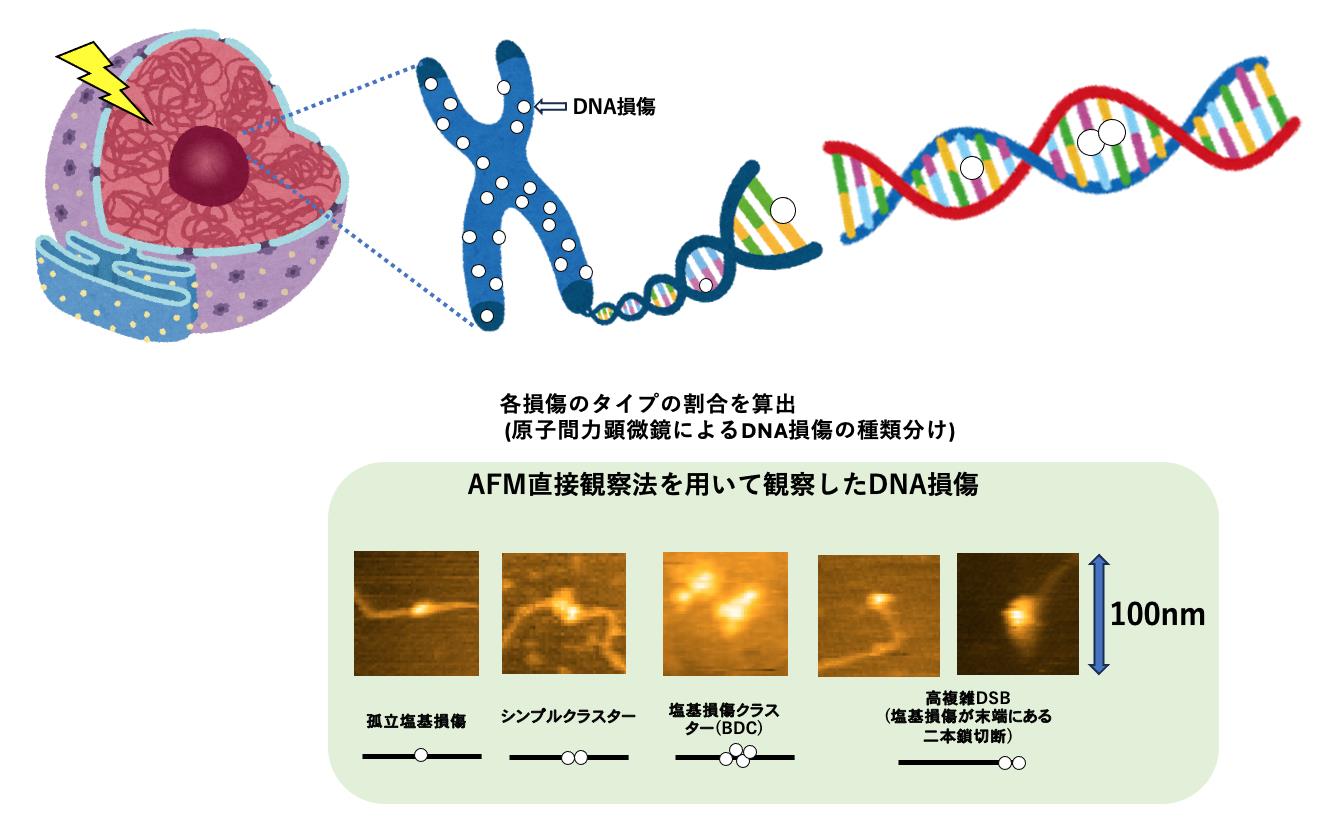
図1 AFM直接観察法を活用したDNA損傷の種類
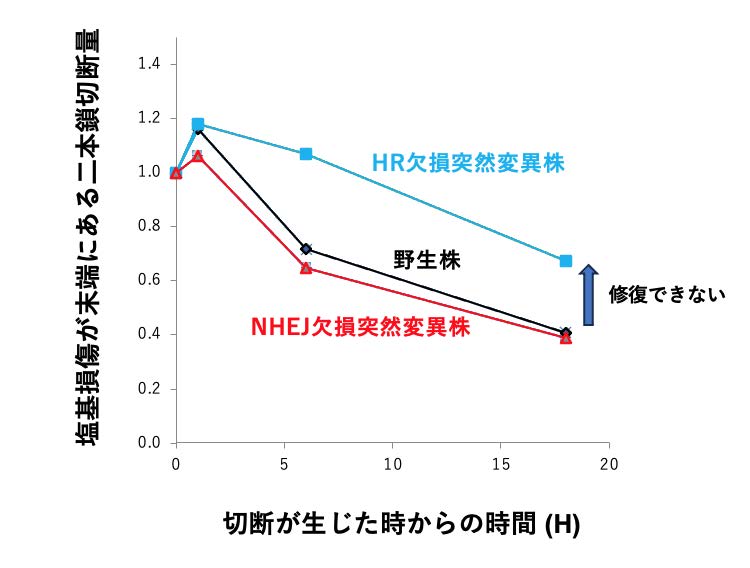
図2 塩基損傷が末端にある高複雑二本鎖切断量の時間経過
今後の展開
修復困難な、塩基損傷を含む二本鎖切断をHRが主に修復している、という知見は、がん治療に応用可能です。例えば、重粒子線治療においては、がん細胞に集中的に放射線を照射することでDNA損傷を与え、がん細胞を殺傷します。HR修復を阻害する薬剤を開発し、それを重粒子線治療と併用することができれば、がん細胞の修復能力を抑制してより多くのがん細胞を死に至らしめることが可能となり、治療効果をさらに向上させることが期待できます(図3)。このように、がん細胞に対する治療効果を高める全く新しいアプローチを得ることができます。
今後、この技術は医療分野での応用がさらに広がり、安全性が高く、より効果的な重粒子線治療につながると考えられます。
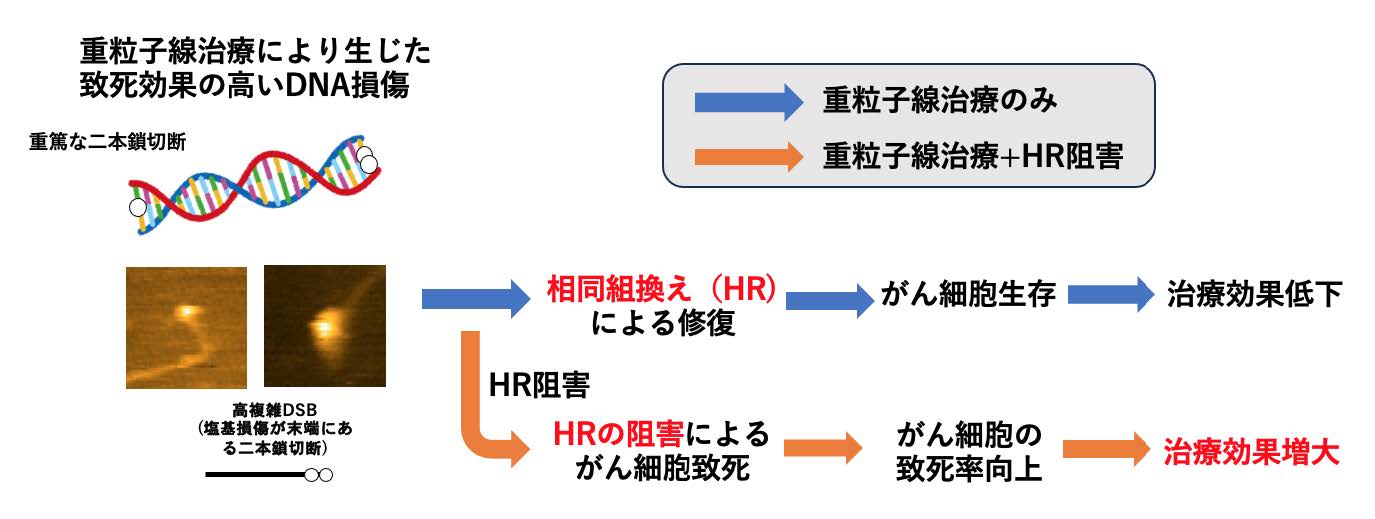
図3 HR修復を阻害する薬剤を併用した重粒子線がん治療の概念図
謝辞
本研究は、QSTのHIMAC共同利用研究の一環として行われました。
用語解説
1)重粒子線治療
重粒子線治療は、炭素イオンなどの重い粒子を利用した放射線治療法で、主にがん治療に用いられます。従来のX線やガンマ線に比べて、腫瘍部位に高いエネルギーを集中させ、周囲の健康な組織への影響を最小限に抑えられる特徴があります。これにより、腫瘍への精密な照射が可能であり、治療効果の向上が期待されています。
2)塩基損傷
DNAを構成する塩基(アデニン、グアニン、チミン、シトシン)は、放射線や化学物質、代謝によって損傷を受け、その化学構造が変わった塩基を指します。この塩基に損傷が生じたものを塩基損傷、塩基が抜け落ちて無くなるものを脱塩基部位といいます。これらのDNA損傷があると、DNAが正しく複製されたり、遺伝情報が正しく転写されたりすることが難しくなり、その結果として突然変異が生じ、最終的にはがん化の原因になることが知られています。
3)原子間力顕微鏡(AFM)を用いてDNA損傷を直接観察する方法
原子間力顕微鏡(AFM)を用いたDNA損傷の直接観察方法として、損傷部位に目印として比較的大きなタンパク質を結合させ、観察するこの目印となるタンパク質の凹凸をナノレベルで観察できるAFMを用いて視覚化することにより、DNA損傷の位置を特定します。この技術により、DNAの損傷部位を直接可視化することが可能となります。
4)非相同末端結合(NHEJ)
非相同末端結合(NHEJ)は、DNA二重鎖切断を修復する主要なメカニズムの一つです。この修復経路では、切断されたDNA末端が直接連結されるため、相同な配列を必要としません。NHEJは特に細胞周期に関わらず働くことが可能で、迅速に損傷を修復しますが、誤って末端を結合することがあり、その結果、変異が導入される可能性があることが知られています。
5)相同組換え(HR)
相同組換え(HR)は、DNAの二重鎖切断を高精度で修復する経路です。この過程では、損傷を受けた染色体の相同配列を鋳型として利用し、元のDNA配列を正確に再構築します。HRは分裂している細胞の特定の期間にのみ働き、細胞のゲノム安定性を維持します。
掲載論文
タイトル:Nucleic Acids Research, 2024, Deciphering repair pathway of clusterd DNA damage in human TK6 cells: insights from atomic force microscopy direct visualization,
著者:Toshiaki Nakano*, Ken Akamatsu, Masaoki Kohzaki, Masataka Tsuda, Ryoichi Hirayama, Akira Sassa, Manabu Yasui, Mahmoud I. Shoulkamy, Takeshi Hiromoto, Taro Tamada, Hiroshi Ide, Naoya Shikazono*
責任著者所属:Kansai Institute for Photon Science, National Institutes for Quantum Science and Technology (QST), Kizugawa-shi, Kyoto, Japan
雑誌名:Nucleic Acids Research
DOI: 10.1093/nar/gkae1077