細胞の社会の中で情報が拡散するためには
2018-10-12 生命創成探究センター,基礎生物学研究所,大阪大学
動物の組織や器官は数多くの細胞から成り立っています。各々の組織や器官には固有の形や機能がありますが、それらが作り出されかつ維持されるためには、細胞同士のコミュニケーションが欠かせません。Wnt(ウィント)に代表される情報分子(シグナルタンパク質)は、組織の中の特定の細胞から分泌され、周囲の細胞に受容されることにより、細胞間コミュニケーションを担うことが知られています。Wntがどの程度遠くの細胞にまで拡散されるのかは、組織や器官における細胞間コミュニケーションの特性を理解する上で重要な問題ですが、Wntの拡散範囲がどのように決まるのかについてはこれまで分かっていませんでした。
今回、生命創成探究センター(ExCELLS)および基礎生物学研究所の高田律子研究員、三井優輔助教および高田慎治教授らの研究グループは、大阪大学の内山進教授(生命創成探究センター客員教授)、産業技術総合研究所の佐藤主税研究グループ長、理化学研究所の佐甲靖志主任研究員のグループと共同し、細胞外に分泌されたWntタンパク質が3量体を最小ユニットとする複合体を形成することを明らかにするとともに、Wntタンパク質複合体の凝集と解離のバランスによってWntが拡散する範囲が決まるという新しい考え方を提唱しました。
Wntは動物の発生、細胞の分化、幹細胞の維持、がん化など様々な生命現象において重要な働きをするシグナルタンパク質として、これまで大きな注目を集めてきました。しかしながら、多くの研究者の努力にもかかわらず、発見後40年近い年月を経てもなお、Wntタンパク質の高次構造や拡散機構は未解決の重要課題として残されていました。研究グループは様々な試行錯誤の末、蛍光検出器を搭載した超遠心分析法や、カラムクロマトグラフィー、電子顕微鏡を用いた単粒子解析などの方法を組み合わせることにより、細胞外に分泌されたWntタンパク質がホモ3量体を形成すること、そしてこの3量体は相互に凝集する性質と、受容体等のWnt結合因子によって容易に解離する性質を併せ持つことを発見しました。さらに、このような集積と解離は胚体内でも起きていることを突き止めるとともに、凝集した多量体は拡散性が低いのに対し、解離してWnt結合因子とヘテロ複合体を形成すると拡散性が高まることが明らかになりました。
本研究は、Wntの拡散範囲を決める基本的なしくみを明らかにしたものであり、組織や器官の形成や維持の基盤となる細胞間コミュニケーションの分子機構を解明する上で重要な発見であると言えます。
本研究成果は2018年10月10日付でCommunications Biology誌に掲載されました。
【研究の背景】
Wntに代表されるシグナルタンパク質は、細胞間の情報伝達を担う分子です。Wntはヒトやマウスでは19種類の構造的に類似のタンパク質が存在することが知られており、それらは胚発生、細胞の分化、幹細胞の維持、がん化など様々な生命現象において重要な働きをすることが多くの研究から明らかにされて来ました。Wntのようなシグナルタンパク質は組織の中の特定の細胞から分泌され、細胞間の隙間を通して拡散し、周囲の細胞に受容されることにより機能する(情報を伝える)と考えられています。細胞間の隙間を拡散するシグナルタンパク質は濃度勾配を形成し、周囲の細胞はその濃度を感知して反応するものと一般的には考えられています。しかしながら、分泌細胞のごく近傍の細胞にのみWntが作用するいう報告もあり、Wntを含むシグナルタンパク質が細胞の社会をどのようにコントロールするのかという点については未だに多くの謎が残っています。
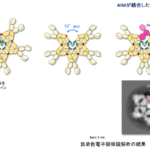
Wntタンパク質には不飽和脂肪酸であるパルミトレイン酸が付加しています。そのため、Wntタンパク質は疎水性のパルミトレオイル基を表面に露出させないような構造を取る必要があると考えられます(図1)。そこで、Wntがリポタンパク質粒子やエクソソームと呼ばれる細胞外小胞に載って運搬・拡散されるというモデルが提唱されて来ました。しかしながら、リポタンパク質粒子は特定の臓器でのみ産生されることや、Wntがエクソソームによって拡散されることを裏付けるデータが乏しいことなどから、これらの粒子・小胞によってWntが運搬されるというモデルは慎重に検討をする必要があると考えられます。一方、別のタンパク質と結合することでWntのパルミトレイン酸を覆い隠し、細胞外でWntを安定に運搬・拡散するというモデルも提唱されています。そのような働きを持つタンパク質として、ショウジョウバエではSwimと呼ばれるリポカインタンパク質が、脊椎動物ではsFRPというWnt結合タンパク質が報告されています。また最近では新たなモデルとして、サイトネームと呼ばれる長い細胞突起を介してWntなどのシグナルタンパク質やそれらの受容体が移動し、遠く離れた細胞にもシグナルが伝達されることも提唱されています。このように、Wntの運搬・拡散については数多くのモデルが提唱されていますが、実際にWntがどのような様式で運搬・拡散するのか、また多様な様式が実際にあるとした場合にそれらはどのように使い分けられるのかなど、解決すべき多くの問題が存在します。
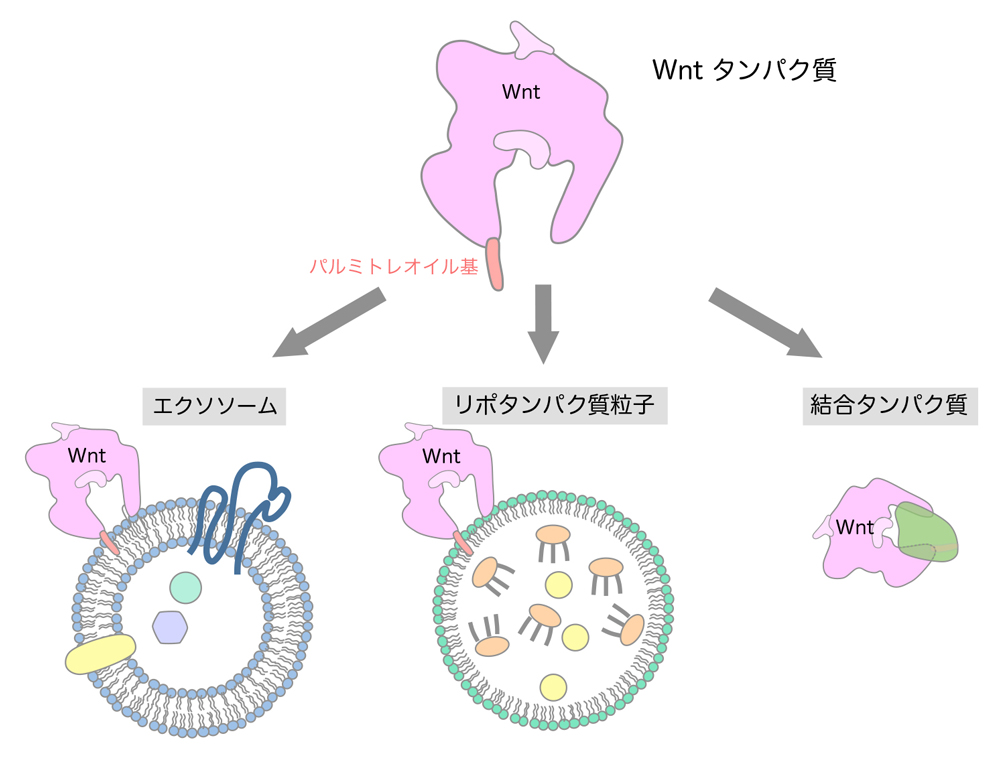 図1:Wntタンパク質に付加されているパルミトレオイル基を覆い隠し、Wntを運搬・拡散する方法としてこれまでに提唱されてきたモデル
図1:Wntタンパク質に付加されているパルミトレオイル基を覆い隠し、Wntを運搬・拡散する方法としてこれまでに提唱されてきたモデル
このような問題に直接的に切り込む方法の一つは、細胞外に分泌されたWntタンパク質を生化学的方法により直接解析することです。Wnt遺伝子が発見されてから40年近い年月が経過しましたが、多くの研究者の努力にもかかわらず、Wntタンパク質の性状を解析することは未だに難しい課題とされています。その大きな原因は、Wntタンパク質が容易に凝集してしまうため、一般的な生化学的手法では解析できないことにあります。凝集を避けるために、高濃度の界面活性剤を用いてWntタンパク質を精製することは可能ですが、このようにして精製されたWntタンパク質は界面活性剤によって本来の高次構造が壊されていることが懸念されるため、Wntの運搬・拡散のしくみを理解するための研究には不向きです。研究グループは細胞外に分泌されたWntタンパク質をありのままに解析する方法を長年に渡り探し求めた結果、蛍光検出器を搭載した超遠心分析法(注1)がこの目的に有効であることを見出し、本研究の成果へと繋げました。
【研究の成果】
この研究のポイントは、Wntの一つであるWnt3aが細胞外においてホモ複合体(注2)として存在することを初めて明らかにし、さらに複合体の凝集と解離によってWntの拡散範囲が規定されるという全く新しいモデルを提唱したことです。
本研究ではまず、細胞の培養上清に分泌されたWnt3aタンパク質を超遠心分析法により解析しました。超遠心分析法はタンパク質などの高分子やそれらの複合体の沈降係数(分子量)を測定する方法として以前から用いられて来ましたが、精製した試料を大量に準備することが必要であるため、精製過程の操作によってすぐに凝集してしまうWntのようなタンパク質を解析するには不向きな方法でした。しかしながら、蛍光検出器を搭載した遠心機が開発され、精製をしていないタンパク質であってもこの方法により解析することが可能になりました。そこで、研究グループは蛍光タンパク質GFPを結合したWnt3aを培養細胞に発現させ、その培養上清を超遠心分析により直接解析するという方法をとることにより、世界で初めて細胞外に分泌されたWntタンパク質をありのままに解析することに成功しました。その結果、すでに報告されているように分泌されたWnt3aタンパク質の一部は培地に含まれる血清成分の一つであるアファミンというタンパク質とヘテロ2量体を形成していることが確認されましたが、その一方で、より高分子量の複合体が存在することが新たにわかりました。この高分子量複合体をさらに詳しく解析した結果、これら複合体はWnt3aホモ3量体(図2)を最小単位として凝集したものであり、Wnt受容体であるFrizzled8やWnt結合タンパク質sFRP2との相互作用によって解離し、新たにFrizzled8やsFRP2とヘテロ複合体を形成することがわかりました(図3)。一方、培養上清中では活性のないWnt3aの点突然変異体(C77A)は、凝集するものの解離しにくいことが明らかになり、容易に解離できるような複合体であることが、Wntが活性を維持するために重要ではないかと考えられました。
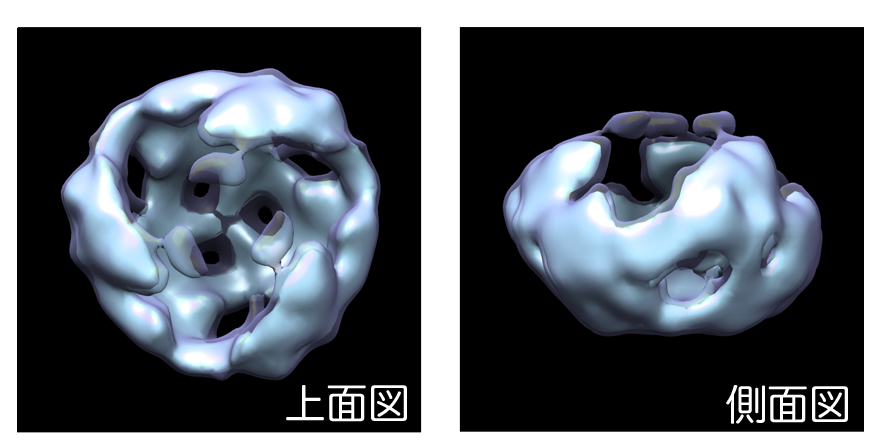 図2:電子顕微鏡を用いた単粒子解析によるWnt3aタンパク質ホモ3量体の構造
図2:電子顕微鏡を用いた単粒子解析によるWnt3aタンパク質ホモ3量体の構造
本研究による一連の解析からWnt3a複合体の最小ユニットがホモ3量体であることが明らかになった。
培養細胞だけでなく、生体内においてもWnt多量体が形成されているかを調べるため、アフリカツメガエル胚に蛍光標識したWnt3aを発現させて解析をしました。蛍光相互相関分光法(FCCS)(注3-2)という方法により解析を行ったところ、GFPやmCherryという異なる色の蛍光タンパク質でラベルしたWnt3aが確かに複合体を形成して細胞外に存在し、培養細胞を用いた実験結果と同様にそれらはFrizzled8やsFRP2により解離することが確認できました。さらに、蛍光相関分光法 (FCS)(注3-1)と免疫組織染色法(注4)を駆使して細胞間隙におけるWntの挙動を解析した結果、高分子量複合体は拡散が遅いのに対し、sFRPと結合したWnt3aヘテロ複合体は拡散性が高くより離れた細胞にまで伝搬されることがわかりました。以上の結果から、細胞外に分泌されたWnt3aホモ3量体は、相互に凝集することにより拡散性を失う一方、Wnt結合因子によって容易に解離してヘテロ複合体を形成し、広い範囲に拡散するものと考えられます(図3)。
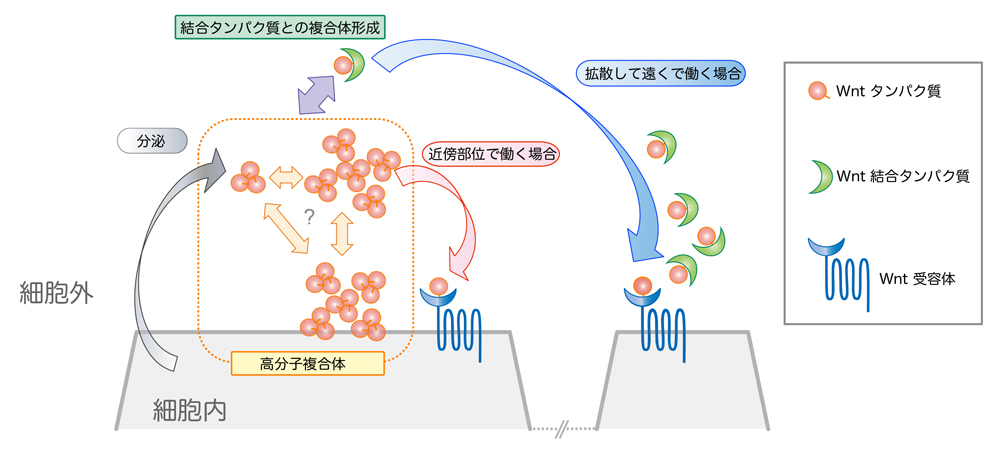 図3:Wntの拡散を説明する新たなモデル
図3:Wntの拡散を説明する新たなモデル
Wntホモ3量体は凝集して拡散性を失い、近傍の細胞にのみ作用する。一方、Wnt結合タンパク質であるsFRP2は高分子量のWnt複合体を解離しWnt/sFRPヘテロ複合体を形成することで、拡散性を高める。
【今後の展望】
今回の研究によりWntの拡散を規定する分子基盤が明らかにできたことから、この知見を糸口にしてWntの拡散機構についての研究が進むのではないかと期待されます。例えば、Wntの拡散性は元をただせばWnt複合体に凝集しやすくかつ容易に解離できるという性質があることに起因するものであり、そのような性質がWnt複合体のどのような構造的特徴により説明できるのかということを明らかにすることが、Wntによる多細胞社会の制御メカニズムを理解することに繋がると考えられます。また、Wnt3量体がタンパク質の合成後分泌に到るまでの過程の中でどのように作り上げられていくのかを解明することも大事な問題です。
一方、Wntの作用範囲は組織や器官によっても異なることが考えられることから、様々な組織ごとにWntの拡散範囲を解析し、それがどのように制御されているのかを調べていくこと、さらには今回得られた知見を基にして拡散範囲をコントロールし、組織や器官の形を人為的に制御することなども期待されます。
【用語解説】
注1:超遠心分析法
タンパク質溶液を超高速で遠心してタンパク質が沈降する様子を時間経過をおって観察することにより、タンパク質の大きさや分子の形状を明らかにする方法。タンパク質の検出方法にUV吸光度を用いるものと蛍光を用いるものがある。
注2:ホモ複合体
同じ種類の蛋白質のみからなる複合体をホモ複合体と呼ぶ。一方、異なる種類の蛋白質からなる複合体をヘテロ複合体と呼ぶ。
注3:蛍光相関分光法(fluorescence correlation spectroscopy, FCS)および蛍光相互相関分光法(fluorescence cross-correlation spectroscopy, FCCS)
蛍光相関分光法(fluorescence correlation spectroscopy, FCS)
蛍光分子の拡散(ブラウン運動)などの動きを定量的に解析し、拡散の速さ、分子の大きさ、濃度などの情報を得る手法。顕微鏡の対物レンズの焦点付近の微小空間において、ブラウン運動によって出入りする蛍光分子の動きを蛍光強度でモニターし、その時間的変動を自己相関関数を用いて解析する。
蛍光相互相関分光法(fluorescence cross-correlation spectroscopy, FCCS)
上記のFCSに類似した手法で、2種類の蛍光物質を同時に観察することでそれらの間の相互作用に関する情報を得る手法。例えば蛋白質Aを赤蛍光、蛋白質Bを緑蛍光で標識して、それぞれの蛍光を同時に観察し、仮に赤と緑の蛍光の時間的変動が同期していればAとBが複合体をつくると考えられる。
注4:免疫組織染色法
免疫において主要な役割を担う抗体蛋白質は非常に高い特異性で目的の蛋白質に結合する。これを利用して、例えばWnt蛋白質に対する抗体を用いれば、多種多様な蛋白質が存在する組織の中でWnt蛋白質のみを染色することが可能である。
【発表雑誌】
雑誌名:Communications Biology 2018年10月10日 掲載
論文タイトル:Assembly of protein complexes restricts diffusion of Wnt3a proteins
著者:Ritsuko Takada, Yusuke Mii, Elena Krayukhina, Yuusuke Maruyama, Kazuhiro Mio, Yoshikazu Sasaki, Takao Shinkawa, Chan-Gi Pack, Yasushi Sako, Chikara Sato, Susumu Uchiyama, and Shinji Takada
DOI: 10.1038/s42003-018-0172-x
URL: https://doi.org/10.1038/s42003-018-0172-x
【研究グループ】
本研究は、生命創成探究センターおよび基礎生物学研究所の高田律子研究員、三井優輔助教および高田慎治教授らの研究グループを中心として、大阪大学の内山進教授(生命創成探究センター客員教授)、産業技術総合研究所の佐藤主税研究グループ長、理化学研究所の佐甲靖志主任研究員らのグループからなる共同研究チームにより実施されました。
【研究サポート】
本研究は、科学研究費助成事業、CREST、およびシスメックス株式会社などの支援を受けて行われました。
【本研究に関するお問い合わせ先】
自然科学研究機構 生命創成探究センター/基礎生物学研究所
教授 高田 慎治(たかだ しんじ)
大阪大学大学院 工学研究科 生命先端工学専攻/自然科学研究機構 生命創成探究センター
教授 内山 進(うちやま すすむ)
【報道担当】
自然科学研究機構 生命創成探究センター 広報担当
基礎生物学研究所 広報室
大阪大学 工学研究科 総務課評価・広報係