2025-01-13 東京大学
- 肥満・糖尿病モデルマウスが新型コロナウイルス感染症(COVID-19)の重症化・致死モデルとして有用であることを示した。
- 2光子励起顕微鏡を用いた生体イメージングシステムを活用することで、新型コロナウイルス(SARS-CoV-2)に感染したマウスの肺を生きたまま高解像度で観察することに成功した。
- SARS-CoV-2に感染したマウスの肺では、血管内の好中球における細胞間接着分子の発現が増加することにより血管壁への接着性が増加し、その結果として血小板凝集と肺血流障害が引き起こされていることを明らかにした。
- COVID-19患者の末梢血単核細胞のscRNA-seqデータの解析により、COVID-19重症患者の好中球において、マウスモデルと同様に細胞間接着に関する遺伝子の発現レベルが健康なグループと比較して上昇していることを明らかにした。
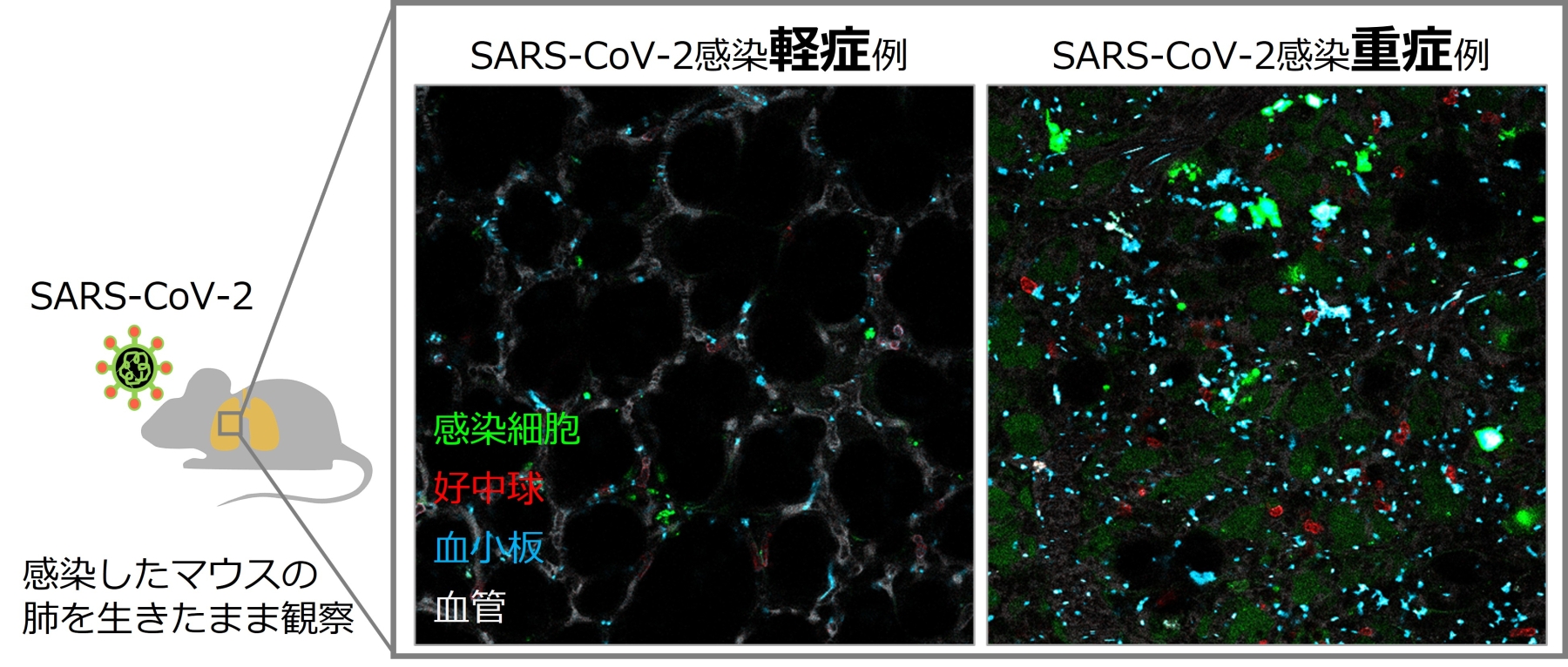
新型コロナウイルスに感染したマウスの肺を生きたまま高解像度で観察
発表内容
国立国際医療研究センターの植木紘史主任研究員と同センター並びに東京大学国際高等研究所 新世代感染症センターの河岡義裕センター長/機構長らの研究グループは、新型コロナウイルス感染症の重症化メカニズムを明らかにするため、SARS-CoV-2重症化・致死マウスモデルとCOVID-19患者検体を用いて解析を行いました。
COVID-19の症例の多くは発熱、咳、鼻汁、咽頭炎などの呼吸器症状を伴う軽症ですが、高齢者や肥満、糖尿病、高血圧症などの基礎疾患を持つ患者では重症のウイルス性肺炎を発症し、深刻な合併症や死に至ることもあります。重症のCOVID-19患者ではサイトカインストームに代表される免疫系の調節障害に加えて、血栓症の発症が頻繁に報告されており、これも重症化の一因となっている可能性が指摘されています。血栓形成に関わる因子は時空間的に制御されており多段階にわたるプロセスであるため、COVID-19の剖検サンプルやSARS-CoV-2に感染した動物を用いた従来の組織学的アプローチでは、これらの動的な事象を観察することは困難でした。そのため、重症COVID-19患者における血栓形成過程がどのように進行するのかは依然として不明でした。本研究では、SARS-CoV-2が肺血管内の血栓形成過程に与える影響を理解するため、SARS-CoV-2重症化・致死マウスモデルを用いて、感染マウスの肺を生きたまま観察する2光子励起顕微鏡(注1)を用いた生体イメージング(注2)解析を行いました。さらに、COVID-19患者サンプルのscRNA-seq(注3)データを解析し、マウスモデルで得られた知見との関連性を検証しました。
まず、重症COVID-19患者の症状を模倣できる動物モデルを探索するため、7系統の基礎疾患マウスモデルに、我々が以前に作製したマウス順化型(MA)SARS-CoV-2を感染させ、感染後の生存率を評価しました。肥満・糖尿病モデルマウスであるOb/Obマウスでは、野生型マウスと比較してSARS-CoV-2感染後の生存率が著しく低下しました(図1a)。感染マウスの各臓器におけるウイルス量を解析したところ、野生型マウスとOb/Obマウスの両グループの肺および鼻甲介で大量のウイルスの増殖が認められました。マイクロCT解析により、MA-SARS-CoV-2に感染したOb/ObマウスではCOVID-19肺炎に類似する不均一で境界不明瞭な肺炎像を呈することが明らかになりました(図1b)。病理組織学的解析では、MA-SARS-CoV-2に感染したOb/Obマウスでは好中球や単核球などが肺胞領域へ浸潤していることが確認され、肺胞および細気管支上皮細胞においてウイルス抗原が検出されました。これらの結果から、MA-SARS-CoV-2に感染したOb/Obマウスが、重症COVID-19の病態を反映する動物モデルとして有用であることが示されました。

図1. 肥満・糖尿病モデルマウス(Ob/Ob)におけるマウス順化型SARS-CoV-2の病原性解析
(a) MA-SARS-CoV-2を感染させたOb/Obマウスの感染後の生存期間を測定した。(b) MA-SARS-CoV-2に感染したマウスの胸部CT画像を示す。MA-SARS-CoV-2に感染したOb/Obマウスでは、感染した野生型マウスと比較して肺病変が顕著に認められた(赤丸)。
続いて、SARS-CoV-2感染時の肺の病態生理学的変化を生体イメージングシステムで解析するため、蛍光レポーター遺伝子(Venus)を組み込んだマウス順化型SARS-CoV-2(MA-SARS-CoV-2-Venus)をOb/Obマウスに感染させました。ウイルスに感染したOb/Obマウスの肺では、多数の感染細胞が観察され、血栓形成の増加、および好中球と血小板の複合体形成率の上昇が認められました(図2a-c, 動画1: https://bit.ly/Neutrophil_1)。MA-SARS-CoV-2-Venusに感染したマウスの肺血流動態を解析すると、感染したOb/Obマウスでは肺血流が阻害されていることが明らかになり(図2d, 動画2: https://bit.ly/Neutrophil_2)、好中球の血管壁への異常接着に伴う血小板の凝集がその一因であることが判明しました(図2e, 動画3: https://bit.ly/Neutrophil_3)。好中球は細胞間接着に関する分子を介して血管壁に接着することが知られていることから、SARS-CoV-2感染マウスの好中球における細胞間接着に関わる分子の発現レベルを解析しました。その結果、MA-SARS-CoV-2感染Ob/Obマウスの肺血管内好中球では、CD62L、CD44、E-selectinの発現レベルが上昇していることが判明しました(図2f)。マウスモデルを用いたこれらの結果から、SARS-CoV-2感染により好中球の血管壁への接着性が増加し、それに続く血小板凝集によって肺血流が阻害されることが示唆されました。
最後に、SARS-CoV-2感染マウスで認められた血管内好中球における接着分子の発現上昇が、ヒトのCOVID-19肺炎の病態でも認められるかどうかを検証するため、COVID-19患者の臨床検体から得られた公開データ(Wilk et al., Nature Medicine, 2020)を用いて再解析を実施しました。その結果、CD44遺伝子およびSELL遺伝子(CD62Lをコードする)の発現レベルが、健常者群と比較してCOVID-19重症群で有意に上昇していました(図2g)。これらの知見は、重症COVID-19患者の末梢血好中球でも接着分子の発現が増加していることを示唆しており、SARS-CoV-2感染症の重症化機序がヒトとマウスで共通している可能性を示しています。
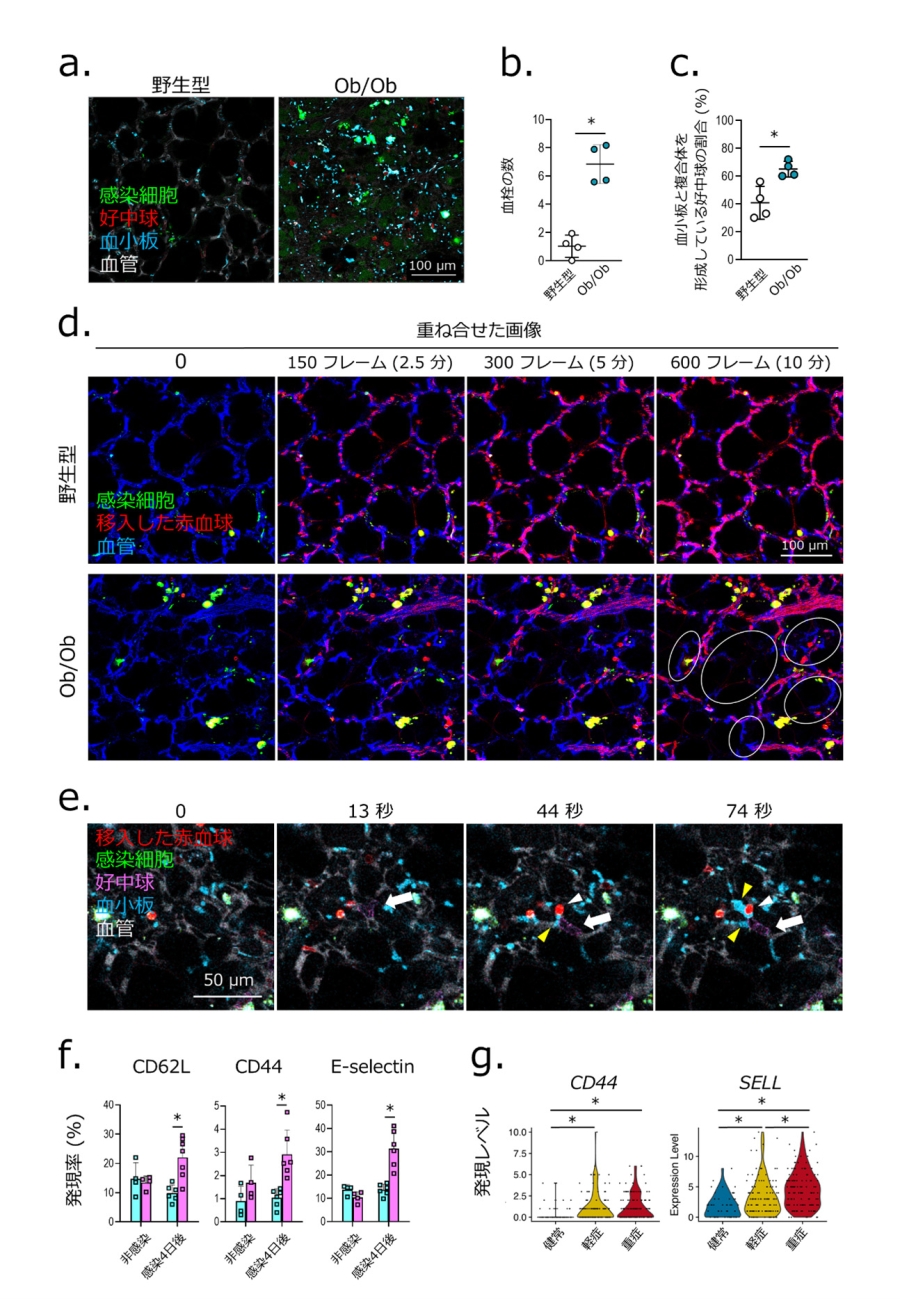
図2. MA-SARS-CoV-2-Venusに感染したOb/Obマウスの肺の生体イメージング解析
(a) MA-SARS-CoV-2-Venus に感染したOb/Obマウスを生体イメージングシステムで解析した。緑色はウイルス感染細胞を示す。蛍光標識デキストランならびに蛍光標識抗体を静脈内投与し、それぞれ肺血管(白)、好中球(赤)、血小板(青)を可視化した。関連動画:動画1 https://bit.ly/Neutrophil_1。
(b) MA-SARS-CoV-2-Venus感染肺における血栓の数。
(c) MA-SARS-COV-2-Venus感染マウスの肺における血小板と複合体を形成した好中球の割合。
(a-c) MA-SARS-CoV-2-Venusに感染したOb/Obマウスの肺では、多数の感染細胞が観察され、血栓形成の増加、および好中球と血小板の複合体形成率の上昇が認められた。
(d, e) MA-SARS-CoV-2-Venusに感染したマウスの肺血流動態を解析した。
(d) 肺血管(青)を可視化するため蛍光標識デキストランを、血流を評価するため蛍光標識赤血球(赤)を静脈内投与した。白丸は観察期間中に標識赤血球が通過しなかった血管領域を示す。MA-SARS-CoV-2-Venusに感染したOb/Obマウスでは肺の血流障害が認められた。関連動画:動画2 https://bit.ly/Neutrophil_2。
(e) 肺血管(白)、好中球(マゼンタ)、血小板(シアン)をそれぞれ可視化するため、蛍光標識デキストランならびに蛍光標識抗体を静脈内投与した。また、血流動態解析のため蛍光標識赤血球(赤)を静脈内投与した。白矢印は血管壁に接着した好中球を、黄矢頭は血小板凝集を、白矢頭は停滞した赤血球を示す。MA-SARS-CoV-2-Venusに感染したOb/Obマウスでは、好中球の血管壁への接着を起点とした血小板の凝集と血流の障害が認められた。関連動画:動画3 https://bit.ly/Neutrophil_3。
(f) MA-SARS-CoV-2-Venusに感染したマウスの肺血管好中球における接着分子の発現をフローサイトメトリー法で解析した。MA-SARS-CoV-2感染Ob/Obマウスの肺血管内好中球では、CD62L、CD44、ならびにE-selectinの発現上昇が認められた。
(g) COVID-19患者の公開されたscRNA-seqデータセット[Wilk et al., Nature Medicine, 2020.]を用いてヒト末梢血好中球における接着関連遺伝子の発現レベルについて再解析を実施した。健常者群と比較してCOVID-19重症群でCD44遺伝子およびSELL遺伝子の発現レベルの上昇が認められた。
本研究ではマウスモデルの生体イメージング解析により、好中球の血管壁への異常接着とそれに続く血小板凝集による微小血栓の形成が、肺血流を阻害し、COVID-19肺炎を重症化させることを明らかにしました。この発見は、従来の病理組織学的解析や組織化学的解析では捉えることができなかったSARS-CoV-2感染症の新たな病態メカニズムを示すものです。本研究で解明されたCOVID-19重症化メカニズムの一因は、重症COVID-19患者や後遺症患者に対する新たな治療法の開発につながると考えられます。
本研究は1月13日(日本時間)英国科学誌「Nature Communications」(オンライン版)に公表されました。
発表者
東京大学国際高等研究所 新世代感染症センター
河岡 義裕 特任教授/機構長
兼:国立国際医療研究センター研究所 国際ウイルス感染症研究センター長
東京大学医科学研究所 ウイルス感染部門 特任教授
研究助成
本研究は、東京大学国際高等研究所 新世代感染症センター、国立国際医療研究センター、東京大学医科学研究所、台湾中央研究院、千葉大学、国立感染症研究所、群馬大学、米国ウィスコンシン大学が共同で実施し、日本医療研究開発機構(AMED)、新興・再興感染症研究基盤創生事業(中国拠点を基軸とした新興・再興および輸入感染症制御に向けた基盤研究、新型コロナウイルス(2019-nCoV)の制圧に向けての基盤研究、ならびに動物モデルと患者検体を用いた新型コロナウイルス感染症(COVID-19)の病態メカニズムの解明IならびにII)、AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業(ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス(東京大学国際高等研究所新世代感染症センター))、ならびに、国立研究開発法人科学技術振興機構 ムーンショット型研究開発事業(ウイルス-人体相互作用ネットワークの理解と制御)の一環として行われました。
用語解説
注1)2光子励起顕微鏡
近赤外レーザーパルス光を用いた蛍光顕微鏡。長波長の光を使用することから、共焦点レーザー顕微鏡と比べて組織の深部を低侵襲的に観察することができる。
注2)生体イメージング法
動物を生かしたまま体内を観察し、細胞や血液などの動態を画像として捉え解析する方法。
注3)scRNA-seq
1細胞ごとに遺伝子発現量を網羅的に計測する技術。
論文情報
Hiroshi Ueki*¶, I-Hsuan Wang*, Maki Kiso, Kenta Horie, Shun Iida, Sohtaro Mine, Michiko Ujie, Hung-Wei Hsu, Chen-Hui Henry Wu, Masaki Imai, Tadaki Suzuki, Wataru Kamitani, Eiryo Kawakami, and Yoshihiro Kawaoka¶, “Neutrophil adhesion to vessel walls impairs pulmonary circulation in COVID-19 pathology,” Nature Communications: 2025年1月13日, doi:10.1038/s41467-024-55272-0.
論文へのリンク (掲載誌)
お問い合わせ先
〈研究に関する問合せ〉
東京大学国際高等研究所 新世代感染症センター
河岡 義裕(かわおか よしひろ) 特任教授/機構長
兼:
国立国際医療研究センター研究所 国際ウイルス感染症研究センター長
東京大学医科学研究所 ウイルス感染部門 特任教授