2025-01-20 東京大学
発表のポイント
- Pre-mRNAスプライシングの活性を担うU6 snRNAの3’末端をウリジル化する酵素(TUT1)がU6 snRNAを認識する様子をクライオ電子顕微鏡単粒子構造解析によって捉えることに成功しました。
- 複数ドメインから構成されるTUT1がU6 snRNA分子全体を抱きかかえるように、U6 snRNAの特徴的な配列と構造を認識していることが判明しました。
- U6 snRNAの成熟化プロセスの異常が引き起こす疾患の理解に貢献することが期待されます。
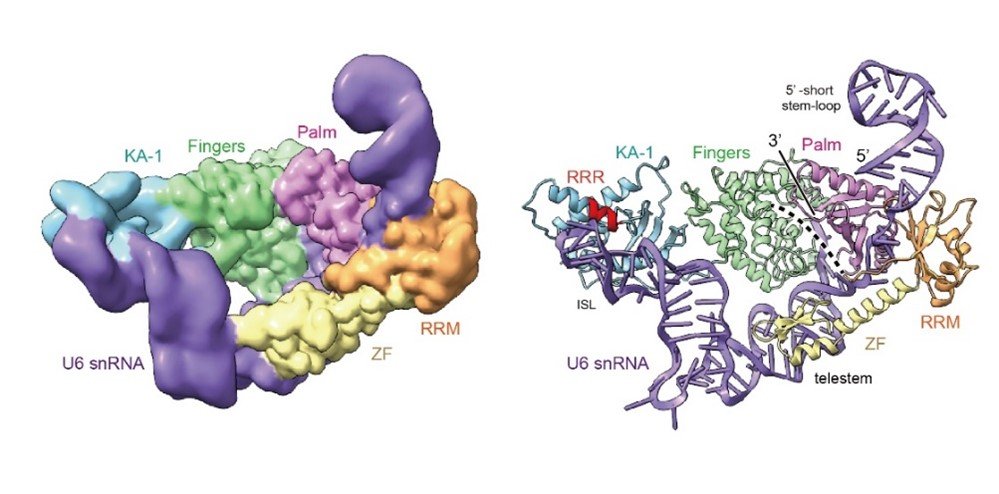
ヒト由来ウリジル化酵素TUT1はU6 snRNA全体を両腕で抱きかかえて認識
発表概要
東京大学大学院新領域創成科学研究科メディカル情報生命専攻の山下征輔助教と富田耕造教授は、前駆体mRNA(pre-mRNA)のスプライシング(注1)で中心的な役割を果たすU6 snRNA(注2)の3’末端の連続したウリジン(オリゴウリジン、注3)配列を合成するウリジン転移酵素(TUT1:Terminal uridylyltransferase 1、注4)が、U6 snRNA分子全体を両腕で抱きかかえるようにU6 snRNAの特徴的な構造と配列を認識し、ウリジン配列を合成する分子機構の全貌を明らかにしました。
ヒトを含む真核生物では、pre-mRNAはスプライシングによりイントロンが取り除かれ、エクソンが連結されて成熟したmRNAになります。pre-mRNAのスプライシングは、5種類のsnRNA(small nuclear RNA:U1、U2、U4、U5、U6)と多数のタンパク質からなるスプライソソーム(注5)によって行われます。U6 snRNAはスプライシング反応の触媒活性を担う機能性RNAであり、その成熟化プロセスに異常があるとpre-mRNAスプライシングに障害を引き起こす可能性があります。
本研究成果により、U6 snRNAの成熟化プロセス異常に起因する病態の理解に貢献することが期待されます。本研究成果は、1月20日に『Nucleic Acids Research』誌にオンライン掲載されました。
発表内容
<研究の背景>
ヒトを含む真核生物において、pre-mRNAスプライシングはリボ核タンパク質(RNP:ribonucleoprotein)複合体であるスプライソソームによって行われます。スプライソソームは、5つのRNP複合体(U1、U2、U4、U5、U6 snRNP:small nuclear RNP)と多数のタンパク質から構成されます。U6 snRNPはU6 snRNA、p110、およびLsm2-8タンパク質を含み、U6 snRNAはスプライソソーム内でスプライシング反応を触媒する役割を担っています。
U6 snRNAは、5′-ショート・ステム(5′-short stem)、内在性ステム-ループ(internal stem-loop:ISL)、テレステム(telestem)から構成される特徴的な2次構造を有し、5′-short stemとtelestemの間にはAUAモチーフ配列があります(図1左)。U6 snRNAの3’末端には、ウリジン転移酵素であるTUT1タンパク質によって、ウリジン三リン酸(UTP:uridine-triphosphate)を基質として複数のウリジンが付加されます。成熟したU6 snRNAの3’末端の連続したウリジン配列はLsm2-8タンパク質複合体の結合部位となります。Lsm2-8タンパク質がU6 snRNAに結合することで、その後のpre-mRNAの一連のスプライシング反応が促進されます。一方、U6 snRNAにウリジンを付加するTUT1タンパク質は複数のドメイン(ZF、RRM、Palm、Fingers、KA-1)から構成される多ドメインタンパク質です(図1右)。多ドメインTUT1タンパク質が特徴的な構造を有するU6 snRNAを認識する分子機構の全貌は、これまで明らかにされていませんでした。
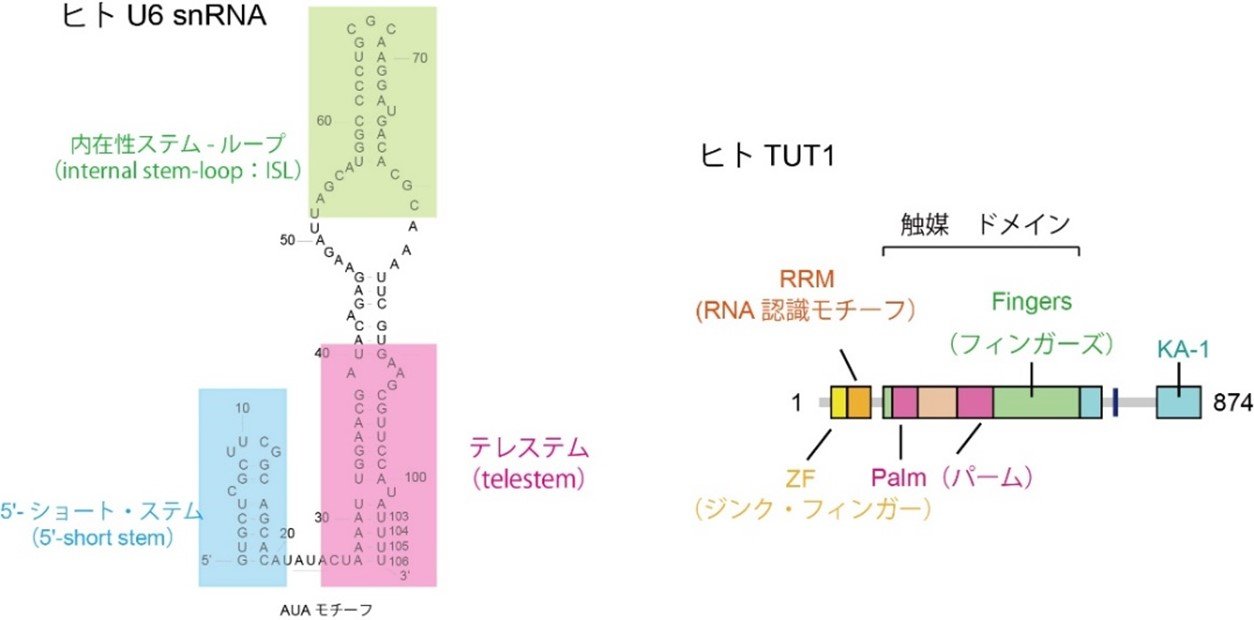
図1:U6 snRNAの2次構造およびTUT1のドメイン構成
(左)ヒトU6 snRNAの2次元構造。5′-ショート・ステム(5′-short stem:水色)、AUAモチーフ、テレステム(telestem:ピンク)、内在性ステムループ(internal stem-loop: ISL:緑)からなる。
(右)ヒトTUT1タンパク質のドメイン構成。TUT1タンパク質は874アミノ酸からなり、複数のドメインで構成される。ジンクフィンガー(Zinc Finger: ZF、黄色)、RNA認識モチーフ(RNA recognition motif: RRM、オレンジ)、パーム(Palm、ピンク)、フィンガーズ (Fingers、緑)、 KA-1(水色)からなる。PalmとFingersで反応触媒部位を構成し、ZF、RRM、KA-1はRNAに結合するドメイン。
<研究の内容>
本研究では、ヒト由来の複数のドメインから構成されるTUT1タンパク質がU6 snRNAの特徴的な構造と配列を認識する分子基盤を明らかにするため、全長TUT1タンパク質と全長U6 snRNAの複合体の三次元構造をクライオ電子顕微鏡単粒子構造解析(注6)によって世界で初めて決定することに成功しました(図2)。
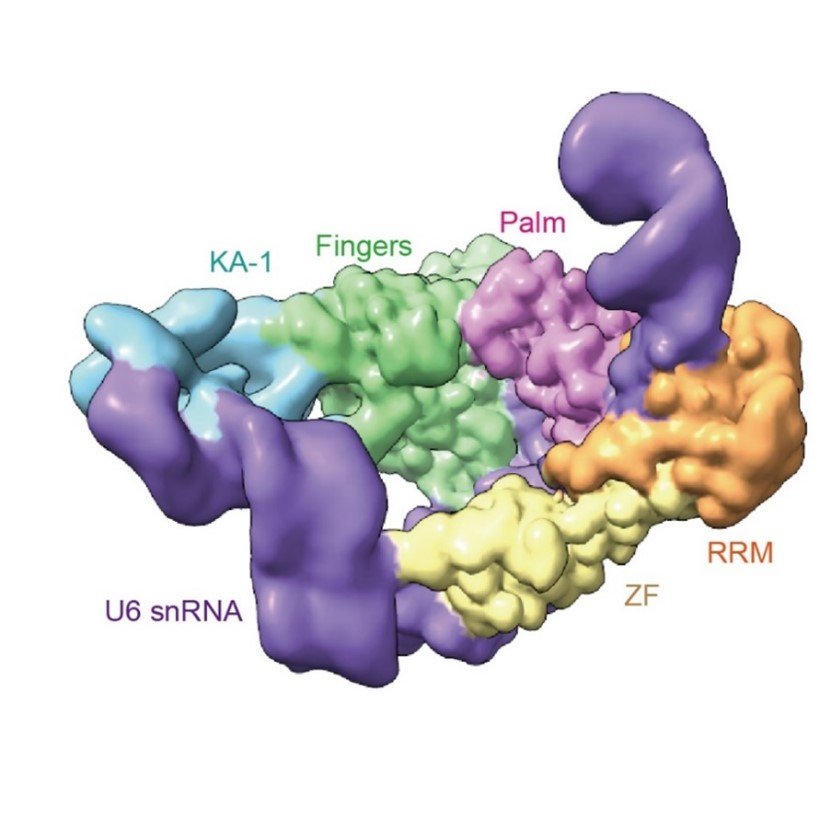
図2:クライオ電子顕微鏡単粒子構造解析によるU6 snRNAとTUT1の複合体構造(動画)
https://drive.google.com/file/d/1QOA1MObnABqnoDtg2kGsX9aCLU2YdAm3/view?usp=sharing
U6 snRNA(紫)、TUT1タンパク質の各ドメイン:ZF(黄色)、 RRM(オレンジ)、 Palm(ピンク)、Fingers(緑)、KA-1(水色)。
その結果、以下の i)から vi)のことがわかりました。
i)U6 snRNAの5′-ショート・ステムと3′-テレステムの間の一本鎖部分のAUAモチーフは、複数のドメインから構成されるTUT1タンパク質のうち、アミノ末端側(注7)のZF-RRMによって特異的に認識され、また、ZF-RRMと触媒ドメインを構成するパーム(Palm)ドメインによって抱えこまれています。
ii)U6 snRNAの内在性ステムループ(ISL)は、TUT1タンパク質のカルボキシ末端側(注7)のKA-1ドメインに支えられています。
iii)その結果、U6 snRNA分子はテレステム(telestem)と内在性ステムループ(ISL)との間で曲がった構造をとり、U6 snRNAのテレステムがPalmとFingersからなる活性部位に引き寄せられ、3’末端部分が活性触媒部位に入り込みます(図3)。
vi)このように、複数ドメインから構成されるTUT1タンパク質がそのドメインすべてを使ってU6 snRNA構造全体を両腕で抱きかかえるように認識、結合すること分かりました(図4)。
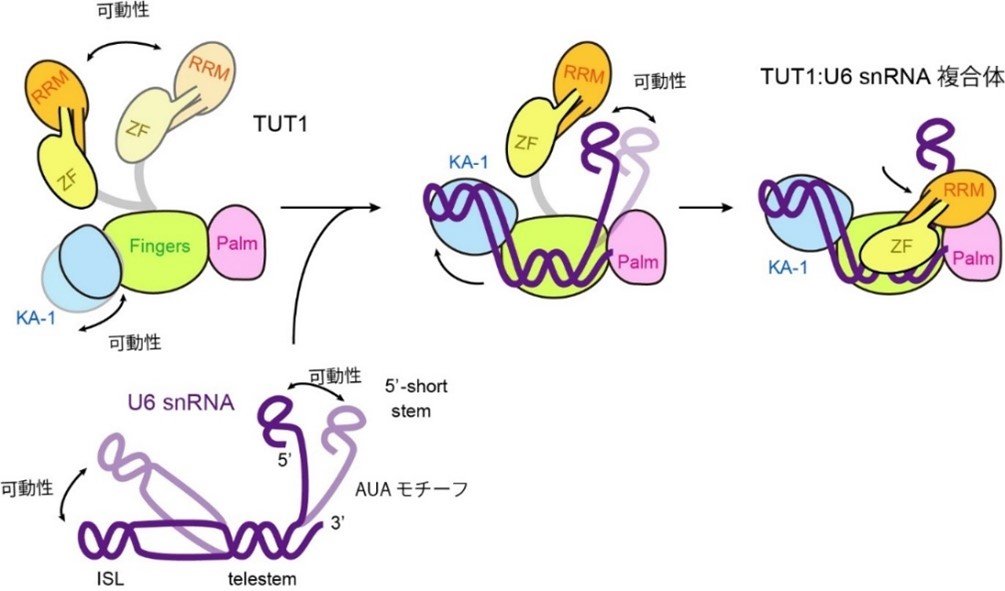
図3:U6 snRNAとTUT1の複合体構造の模式図
TUT1タンパク質のZF-RRMおよびKA-1は触媒コアドメイン(PalmとFingersからなる)に対して可動性がある。KA-1はU6 snRNAのISL、ZF-RRMとPalmはU6 snRNAのAUAモチーフをそれぞれ抱え込み、telestemの3’末端を活性触媒部位に固定化させる。この過程で、U6 snRNAはISLとtelestemの間で曲がった構造をとる。
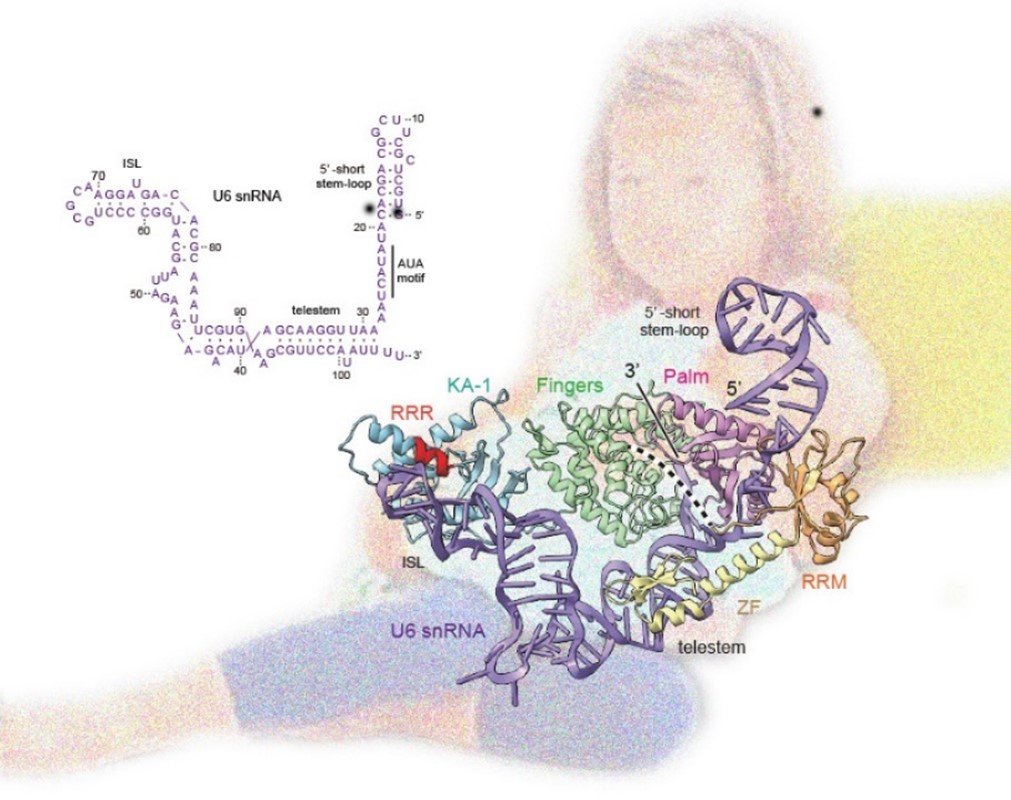
図4:TUT1はU6 snRNA全体を両腕で抱きかかえるようにして認識
TUT1は複数のドメインを全て利用してU6 snRNA全体(紫)を両腕で抱きかかえるようにして認識している。U6 snRNAはtelestemとISLの間で折れ曲がった構造をとっている(左上)。
<今後の展望>
U6 snRNAはpre-mRNAスプライシングにおいて重要な役割を果たしており、その成熟過程に異常があるとpre-mRNAスプライシングに障害をもたらす可能性があります。U6 snRNAの成熟化プロセスの異常が常染色体潜性遺伝(劣性遺伝)性皮膚疾患である多形皮膚委縮を伴う好中球減少症との関連が報告されています。本研究の成果は、U6 snRNAの成熟化異常による疾患の理解に寄与すると考えられます。
<関連するプレスリリース>
Pre-mRNAスプライシングの鍵となるU6 snRNAの成熟メカニズムの解明―U6 snRNA成熟異常による疾患理解へ貢献―(2023年8月10日)
https://www.k.u-tokyo.ac.jp/information/category/press/10416.html
発表者・研究者等情報
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
山下 征輔 助教
富田 耕造 教授
論文情報
雑誌名:Nucleic Acids Research
題 名:Cryo-EM structure of human TUT1:U6 snRNA complex
著者名:Seisuke Yamashita* and Kozo Tomita*
DOI: 10.1093/nar/gkae1314
URL: https://academic.oup.com/nar/article-lookup/doi/10.1093/nar/gkae1314
研究助成
本研究は、日本学術振興会科学研究費助成事業 最先端次世代研究開発プログラム(NEXT program)(課題番号:LS135)、基盤研究A(課題番号:23H00368、18H03980、26251009)、若手研究(課題番号:19K16053)、文部科学省科学研究費助成事業 新学術領域研究(課題番号:26113002)国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:JP23ama121002)などの支援により実施されました。
用語解説
(注1)pre-mRNAスプライシング
ヒトを含む真核生物における、タンパク質をコードするDNAから転写された前駆体mRNA(pre-mRNA)の多くは、介在領域(intron:イントロン)によってタンパク質をコードする領域(exon:エクソン)が分断されています。Pre-mRNAから不要なイントロンを取り除き、エクソン同士を連結することをpre-mRNAのスプライシングと呼びます。Pre-mRNAスプライシングは、遺伝子情報の多様性や機能の調節に寄与します。
(注2)U6 snRNA
Pre-mRNAスプライシングを触媒するスプライソソーム(注5)を構成するタンパク質をコードしない機能性RNA分子のひとつ。スプライシング反応の触媒活性を担うことが知られています。
(注3)ウリジン(オリゴウリジン)
RNAは主にアデニン(A)、グアニン(G)、ウリジン(U)、シトシン(C)の4種類のヌクレオチドを構成成分として持ちます。ウリジン(U)が複数連なった配列をもつRNAをオリゴウリジンと呼びます。
(注4)ウリジン転移酵素
RNAの末端に核酸性の鋳型を用いずにウリジンを転移、付加し、オリゴウリジン配列を合成する酵素のことを呼びます。
(注5)スプライソソーム
スプライソソームは、真核生物の細胞核内に存在するタンパク質とRNAからなるリボ核タンパク質複合体(RNP:Ribonucleoprotein)で、pre-mRNAのスプライシングに関与します。主要なスプライソソーム中のRNA成分は、snRNA(small nuclear RNA)と呼ばれ、U1、U2、U4、U5、U6の5種類存在し、pre-mRNA内のスプライシングによって切断される部分を含む特定の配列やタンパク質と協奏的に相互作用します。スプライシング反応の触媒活性を担うのは、スプライソソーム中のタンパク質ではなくU6 snRNAであることが知られています。
(注6)クライオ電子顕微鏡単粒子構造解析
試料を極低温で急速凍結し、電子顕微鏡で撮影した多数の単粒子の画像から3次元構造を再構築する技術。この方法により、タンパク質やタンパク質-RNA複合体などの分子構造を原子レベルで観察できます。
(注7)アミノ末端側、カルボキシ末端側
タンパク質の末端には、タンパク質が合成されはじめる側の末端と合成が終了する側の末端があり、それぞれアミノ末端、カルボキシ末端と呼びます。
お問い合わせ
新領域創成科学研究科 広報室

