2025-02-27 マックス・プランク研究所
マックス・プランク生化学研究所の研究チームは、HIV-1ウイルスのライフサイクルにおける重要なステップを解明しました。ハイデルベルク大学やイェール大学のチームと協力し、ウイルス成分の一つである「スペーサーペプチド2(SP2)」が、未熟なHIV-1粒子を感染性のある粒子に変換する際に重要な役割を果たすことを発見しました。この研究成果は、2025年2月27日に『Nature』誌に掲載されました。
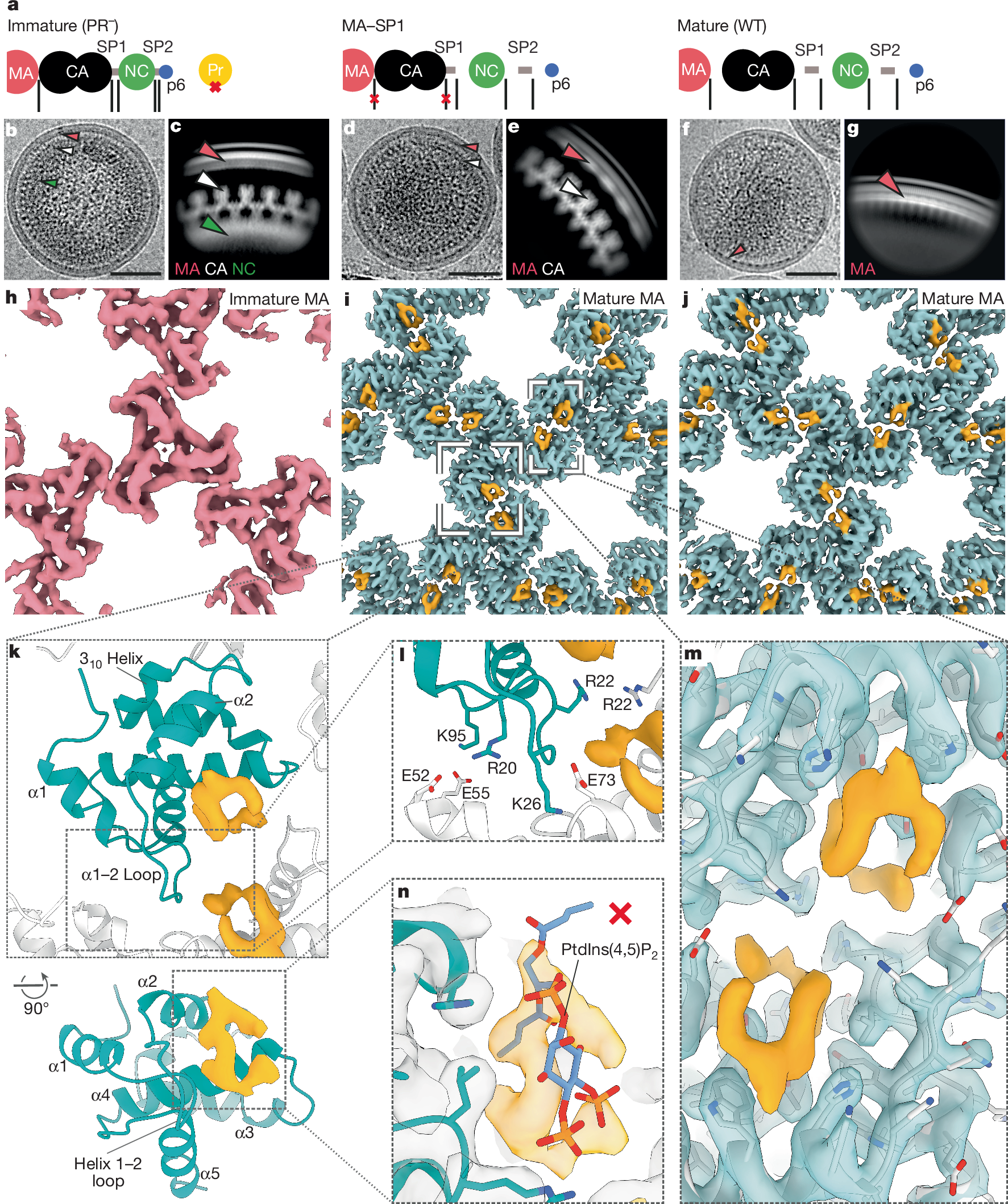
HIVが感染性を持つためには、ウイルス粒子が成熟過程を経る必要があります。この過程では、マトリックス層の再配置が不可欠とされていますが、その詳細なメカニズムはこれまで明らかにされていませんでした。今回の研究により、SP2がマトリックス層の再配置を調整し、ウイルスの成熟と感染性獲得に寄与することが示されました。
この発見は、HIVのライフサイクルに関する理解を深めるだけでなく、新たな治療戦略の開発にもつながる可能性があります。具体的には、SP2の機能を標的とした薬剤の開発が期待されます。
<関連情報>
- https://www.mpg.de/24277555/0227-bioc-scientists-discover-the-function-of-a-mysterious-hiv-component-153945-x
- https://www.nature.com/articles/s41586-025-08624-9
保存されたHIV-1スペーサーペプチド2がマトリックス格子の成熟を引き起こす The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation
James C. V. Stacey,Dominik Hrebík,Elizabeth Nand,Snehith Dyavari Shetty,Kun Qu,Marius Boicu,Maria Anders-Össwein,Pradeep D. Uchil,Robert A. Dick,Walther Mothes,Hans-Georg Kräusslich,Barbara Müller & John A. G. Briggs
Nature Published:26 February 2025
DOI:https://doi.org/10.1038/s41586-025-08624-9
Abstract
The virus particles of human immunodeficiency virus type 1 (HIV-1) are released in an immature, non-infectious form. Proteolytic cleavage of the main structural polyprotein Gag into functional domains induces rearrangement into mature, infectious virions. In immature virus particles, the Gag membrane-binding domain, MA, forms a hexameric protein lattice that undergoes structural transition, following cleavage, into a distinct, mature MA lattice. The mechanism of MA lattice maturation is unknown. Here we show that released spacer peptide 2 (SP2), a conserved peptide of unknown function situated about 300 residues downstream of MA, binds MA to induce structural maturation. By high-resolution in-virus structure determination of MA, we show that MA does not bind lipid into a side pocket as previously thought, but instead binds SP2 as an integral part of the protein–protein interfaces that stabilize the mature lattice. Analysis of Gag cleavage site mutants showed that SP2 release is required for MA maturation, and we demonstrate that SP2 is sufficient to induce maturation of purified MA on lipid monolayers in vitro. SP2-triggered MA maturation correlated with faster fusion of virus with target cells. Our results reveal a new, unexpected interaction between two HIV-1 components, provide a high-resolution structure of mature MA, establish the trigger of MA structural maturation and assign function to the SP2 peptide.

02846-0/asset/c35e170b-5fad-45a7-a85b-bc7a6c9375fb/main.assets/gr1.jpg)
