2019-02-19 京都大学
ポイント
- ヒトiPS細胞から胎生期胆管上皮細胞への分化誘導法と単離法を開発した。
- 分化誘導した胆管上皮細胞から機能的な三次元の胆管様組織の再構築に成功した。
- 本研究で開発したヒトiPS細胞から分化誘導される胆管上皮細胞は、今後先天性肝胆道系疾患に対する疾患モデル開発に貢献することが期待される。
1. 要旨
ヒトiPS細胞から胆管上皮細胞への分化誘導の報告は少なく、分化誘導された細胞が胎生期のどの時期に相当するかを検討した報告はこれまで存在しませんでした。しかし、様々な肝胆道系疾患で生じる胎生期の異常のメカニズムを明らかにするためには、当該発生時期の胆管細胞を同定して研究する必要があります。
松井 敏 大学院生(京都大学CiRA増殖分化機構研究部門、現・三菱京都病院 腎臓内科医長)、長船 健二 教授(CiRA同部門)らの研究グループは、胆管上皮細胞のマーカー遺伝子であるAQP1に対するレポーターヒトiPS細胞株(AQP1-GFPレポーターヒトiPS細胞株)を樹立することによって、AQP1陽性胆管上皮細胞の分化誘導と単離に成功しました。また、分化誘導されたAQP1陽性胆管上皮細胞は胎生15-20週のリモデリング期胆管板細胞に相当することが判明しました。
本研究で開発された手法は、ヒトiPS細胞を用いた胆管発生機構やその異常によって生じる先天性肝胆道系疾患の病態解明に寄与することが期待されます。
この研究成果は、2019年1月31日(英国時間)に英科学誌「Stem Cell Research」でオンライン公開されました。
2. 研究の背景
胆管上皮細胞の発生学的異常(ductal plate malformation)は、常染色体優性多発嚢胞腎(ADPKD)や常染色体劣性多発嚢胞腎(ARPKD)注1における肝嚢胞、肝線維症をはじめとする先天性肝胆道系疾患の要因となります。これらの疾患のメカニズム解明のためには、胎生期の胆管上皮細胞を用いた研究が重要と考えられますが、ヒトと齧歯類で胆管上皮細胞の遺伝子発現が異なることや、胎生期のヒトの検体を用いる研究が倫理的、技術的に困難であるため、これらの疾患の病態解明と根治的治療法の開発研究は十分に進んでおりません。
この課題の克服に向けて、ヒトiPS細胞から分化誘導される胎生期胆管上皮細胞を研究に活用することは有力な研究手法と考えられます。ところが、胎生期の胆管上皮細胞の指標となるマーカー遺伝子がほとんど知られていないため、ヒトiPS細胞から分化誘導された胆管上皮細胞が胎生期のどの段階に相当する細胞なのかを確認する方法がなく、胆管の発生過程を段階的に再現するヒトiPS細胞から胆管上皮細胞への分化誘導法は確立されておりませんでした。
そこで同グループは、AQP1およびCK7が肝芽細胞、肝細胞、胎生6週頃の胆管板注2では発現しておらず、それぞれ胎生15週頃、20週頃からリモデリング期胆管板注2に発現していることを示す発生学的知見から、AQP1およびCK7をマーカー遺伝子として用いることでヒトiPS細胞から胆管板、リモデリング期胆管板を段階的に分化誘導できるのではないかと仮説を立てました。
3. 研究結果
1) AQP1-GFPレポーターヒトiPS細胞株の樹立
まず、AQP1陽性細胞の分化誘導法と単離法の開発のために、AQP1-GFPレポーターヒトiPS細胞株注323C27を樹立しました。 具体的には、ヒトAQP1の配列を含むBAC(bacterial artificial chromosome)注4を用いてAQP1-GFPベクターを作製し、 ヒトiPS細胞株585A1に遺伝子導入を行いました。このレポーター細胞株を用いることでAQP1陽性細胞をフローサイトメーター注5で単離することが可能となりました。
2) AQP1陽性胆管上皮細胞の分化誘導に成功
次に、ヒトiPS細胞から肝細胞を誘導する既報の方法を改良することによって、23C27株から肝芽細胞(培養11日目)を作製しました。次に、分化誘導された肝芽細胞(培養11日目)へ胆管発生への関与が報告されている因子であるTGFB2とEGFを添加して培養を続けると、培養14日目にはSOX9、CK19が共に陽性の胎生期の胆管細胞が高効率に誘導されることが確認できました(図1左)。この細胞にはAQP1、CK7のタンパク質発現は認められませんでしたが、さらに培養を続けると、培養18-20日目にAQP1、CK7を発現する細胞が得られました(図1右)。
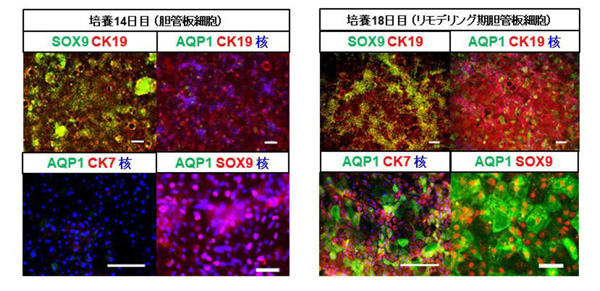
図1 ヒトiPS細胞から分化誘導された胎生期の胆管上皮細胞
培養14日目の細胞(左)は、胎生6-12週頃の胆管板細胞に相当し、培養18日目の細胞(右)は、胎生15-20週頃のリモデリング期胆管板細胞に相当する。 SOX9、CK19、AQP1、CK7は、胎生期胆管上皮細胞のマーカー遺伝子。スケールバーは、100 μm(上図)、50 μm(下図)。
3) AQP1陽性胆管上皮細胞の単離解析
定量PCR法注6を用いて培養14日目と18日目の細胞集団の遺伝子発現を比較解析したところ、前者に比べ後者ではAQP1、CK7の発現が有意に上昇していました。さらに、23C27株から分化誘導した培養18日目の細胞集団からAQP1陽性細胞を単離し、定性PCR法を用いて遺伝子発現を評価したところ、AQP1陽性細胞においてAE2、GGTなどの成熟胆管マーカー遺伝子の発現は確認できませんでしたが、CK7、SOX9、CFTR、CK19、OPN、JAG1、TGFBR2、EGFR、HNF1B、DLK1、HHEX、TGR5、SLC10A2等の胆管上皮細胞のマーカー遺伝子の発現が認められました。これらの結果から、培養14日目の細胞集団(図1左)は胎生6-12週頃の胆管板細胞に相当し、培養18日目に分化誘導されるAQP1陽性細胞(図1右)は胎生15-20週頃のリモデリング期胆管板細胞に相当すると考えられました。
4) 機能的な胆管様組織の再構築
培養14日目と18日目の細胞集団および培養18日目に単離されたAQP1陽性細胞をゲルの中で三次元培養することで胆管様構造を再構築することに成功し、さらに、胆管の機能の一つであるRhodamine 123 輸送能があることも確認できました。(図2)
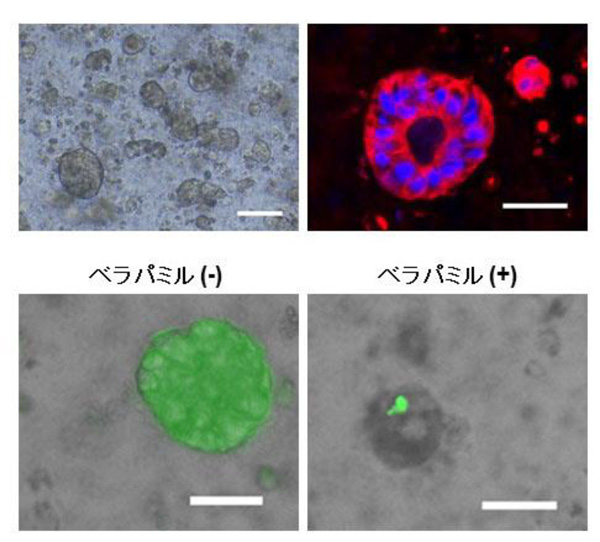
(図2)ヒトiPS細胞から作製された三次元の胆管様組織
培養14日目のヒトiPS細胞由来の胆管板様細胞をゲルの中で三次元培養することにより形成された胆管様構造の明視野像(左上)と胆管マーカーCK19(赤)に対する免疫染色像(右上、青は細胞核)。 形成された胆管様組織は培養液中に添加されたRhodamine(緑)を取り込むが(左下)、胆管内でのRhodamineの輸送を阻害する薬剤であるベラパミルを投与することによって、その取り込みが阻害される(右下)。
スケールバーは、100 μm(左上)、50 μm(右上)、20 μm(下)。
4. まとめ
本研究では、ヒトiPS細胞を用いて胎生期胆管上皮細胞の分化誘導法と単離法を開発しました。これらの手法は、今後、ヒトiPS細胞を用いた胆管発生機構やその異常によって生じる先天性肝胆道系疾患の病態の解明に貢献することが期待されます。
5. 論文名と著者
- 論文名
Differentiation and Isolation of iPSC-derived Remodeling Ductal Plate-like Cells by Use of an AQP1-GFP Reporter Human iPSC Line - ジャーナル名
Stem Cell Research - 著者
Satoshi Matsui*, Miyuki Ochiai, Katsutaro Yasuda, Shin-ichi Mae, Maki Kotaka, Taro Toyoda, Takuya Yamamoto, Kenji Osafune**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム
「iPS細胞研究中核拠点」 - AMED難治性疾患実用化研究事業
- 大塚製薬株式会社
7. 用語説明
注1)常染色体優性多発嚢胞腎(ADPKD)、常染色体劣性多発嚢胞腎(ARPKD)
両側の腎臓や肝臓に多数の嚢胞(内部に水を貯めた袋)が進行性に発生・増大して、徐々に腎および肝機能障害が進行する遺伝性疾患。根治的治療法は未開発。
注2)胆管の発生過程
胆管上皮細胞の発生は、内胚葉から原始腸管を経由して発生した門脈周囲の肝芽細胞が、胎生6週頃に胆管板(Ductal Plate)と呼ばれる一層の上皮として分化することから始まる。胎生12週頃には原始的な管腔構造が構築され、リモデリング期胆管板(Remodeling Ductal Plate)と呼ばれる。
注3)AQP1-GFPレポーターヒトiPS細胞株
ヒトiPS細胞株のAQP1遺伝子座にGFPタンパク質を導入し、AQP1が発現すると緑色に発光するように遺伝子操作した細胞株。
注4)BAC(bacterial artificial chromosome)
約300kbまでの長い遺伝子をクローニングできる、大腸菌が宿主のベクター(運び屋)である。大腸菌内での相同組換えにより、容易に遺伝子を任意に導入できる。
注5)フローサイトメーター
流動細胞計測計のこと。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を構成的に解析することができる。
注6)定量PCR法
PCR法によって増やしたDNAの量を蛍光色素をつかって経時的に測定し、DNAを定量する方法。