非ステロイド性抗炎症薬ジクロフェナクが心筋誘導を促進
2019-02-21 筑波大学, 日本医療研究開発機構
研究成果のポイント
- 新生児期および成体期線維芽細胞から心筋細胞への直接誘導を促進する化合物として、非ステロイド性抗炎症薬(注1)ジクロフェナクが効果的であることを発見しました。
- 老化した線維芽細胞で生じる炎症と線維化が心筋誘導を阻害することと、ジクロフェナクによる抗炎症・抗線維化作用によって心筋誘導が促進することを明らかにしました。
- ジクロフェナクによる安全・安価・効率的な心筋誘導は、小児や成人の心疾患に対する新しい心臓再生法への応用が期待できます。
概要
国立大学法人筑波大学 医学医療系 家田真樹教授、ワシントン大学 村岡直人研究員らの研究グループは、臨床で汎用されている非ステロイド性抗炎症薬ジクロフェナク(商品名:ボルタレン)が、新生児期及び成体期のマウス線維芽細胞から心筋細胞への直接誘導を促進する化合物として作用することを発見しました。
これまでに家田教授らは、新しい心臓再生法として心臓に存在する心筋以外の心臓線維芽細胞に心筋誘導遺伝子を導入することで、マウス生体内において心筋細胞を直接作製できることなどを報告してきました。しかしこれまでの方法では、胎児期線維芽細胞から心筋誘導を効率よく作成することはできても、臨床で治療対象となる新生児や成体期の線維芽細胞から心筋細胞を効率よく誘導する方法は確立されていませんでした。また加齢や老化が心筋誘導を阻害するメカニズムは不明でした。
本研究では、化合物ライブラリーを用いて、マウス新生児期および成体期線維芽細胞で心筋誘導を促進する化合物を網羅的に探索しました。その結果、日常臨床で汎用されているジクロフェナクがこれらの細胞で心筋誘導を顕著に改善することを発見しました。さらに加齢老化に伴って線維芽細胞ではシクロオキシゲナーゼ-2(COX-2)、プロスタグランジンE2(PGE2)/プロスタグランジンE受容体4(EP4)、インターロイキン-1β(IL-1β)/インターロイキン1受容体タイプ1(IL-1R1)の炎症と線維化が活性化しており、ジクロフェナクはこの経路を抑制することで心筋誘導を改善することを見出しました。
本研究成果により、ジクロフェナクを用いた安全・安価・効率的な心筋誘導法が確立されました。小児や成人の心疾患に対する再生医療実現に将来的に貢献することが期待されます。
※本研究の成果は、2019年2月20日(日本時間午後7時)付「Nature Communications」で公開される予定です。
研究の背景
心筋細胞は再生能力が限られていることから、心筋梗塞等で障害を受けると心臓は線維化し、ポンプ機能が低下します。心臓の機能が高度に低下した患者では、心臓移植以外に根本的治療はありません。しかし、我が国ではドナー不足の問題があるため、細胞移植を用いた心臓再生医療に注目が集まっています。iPS細胞を始めとした幹細胞は、その高い増殖能力と様々な細胞に分化できる多分化能から、心筋再生の細胞源として期待されています。ただしその使用には、分化誘導効率、腫瘍形成の可能性、移植細胞の生着などの課題が残されています。そこで、細胞移植を必要としない心臓再生法として、障害された心臓内に大量に存在する線維芽細胞を、幹細胞を介さずに直接その場で心筋細胞に転換する(心筋を直接作製する)、新しい心臓再生法が開発されました(図1)。
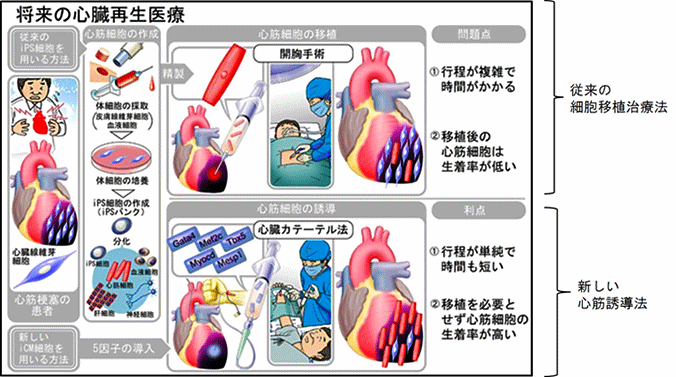
図1:心臓再生法の比較
家田教授らは2010年に、マウス心臓線維芽細胞に3つの心筋特異的転写因子(Gata4/Mef2c/Tbx5)を導入することでiPS細胞を介さずに心筋細胞を直接作製できることを世界で初めて示しました。さらにその後、同じ3遺伝子を用いてマウス生体内の心筋梗塞線維化巣での心筋再生に成功し、ヒト心臓線維芽細胞から心筋細胞の直接作製も報告しています(参考文献1、2、3)。また、心筋特異的マイクロRNAや液性因子などの心筋誘導促進因子の同定や、細胞の遺伝子を損傷しないセンダイウイルスベクターによる安全な心筋誘導法の確立など、着実に心臓再生の臨床応用に向けて研究を進めてきました(参考文献4、5、6、7)。
しかしながら、これまでの心筋細胞の直接誘導法は胎児期の線維芽細胞では高効率であるものの、臨床で必要な小児期及び成体期の線維芽細胞では効率が低いという課題がありました。また、加齢や老化に伴って心筋誘導効率が低下するメカニズムも不明でした。
研究内容と成果
1. 線維芽細胞から心筋誘導を促進する化合物ジクロフェナクを同定
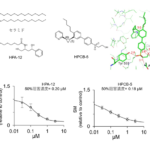
線維芽細胞が心筋誘導遺伝子(Gata4/Hand2/Mef2c/Tbx5)により心筋細胞に転換すると赤色の蛍光タンパクを発現するトランスジェニックマウス(注2)の新生児期線維芽細胞を用いて、心筋誘導を促進する化合物をスクリーニングするシステムを(注3)構築しました。本スクリーニングシステムを用いて、8400種の化合物ライブラリーをスクリーニングしたところ、4種の化合物で心筋誘導が促進されることを見出しました。さらに、心筋特異的タンパク質の発現をフローサイトメーター等で評価し、最も心筋誘導を促進する化合物として、日常臨床で汎用されている非ステロイド性抗炎症薬ジクロフェナク(商品名:ボルタレン)を同定しました。
2. ジクロフェナクによる新生児・成体期線維芽細胞からの効率的な心筋誘導法の確立
ジクロフェナクを添加したことにより、心筋特異的遺伝子及びタンパク質発現の上昇が認められ(図2)、心筋の機能的特徴である自律的拍動をする心筋細胞数の作製も約3倍増加しました。ジクロフェナクの添加濃度と添加期間に関して検討を行ったところ、ジクロフェナクは誘導初期わずか4日間の添加で十分であり、低濃度(1μM)でも心筋誘導促進効果を認めました。また、新生児期及び成体期線維芽細胞では心筋の誘導を促進するのに対し、胎児期線維芽細胞では効果がないことにより、ジクロフェナクの心筋誘導効果は時期特異的であることが明らかとなりました。またこの心筋誘導効果は、ジクロフェナク以外の他の非ステロイド性抗炎症薬でも同様に認められました。以上により、非ステロイド性抗炎症薬ジクロフェナクによる線維芽細胞で安全・簡便・効率的な心筋誘導法を確立しました。
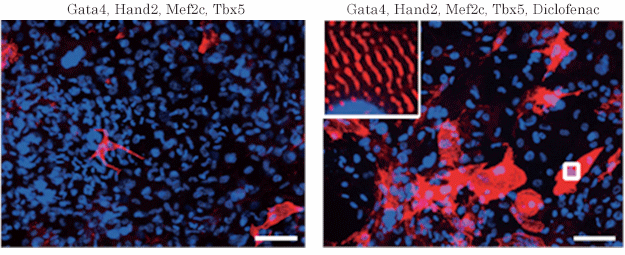
図2:線維芽細胞から誘導された心筋細胞
(左)心筋誘導遺伝子のみ導入、(右)心筋誘導遺伝子導入及びジクロフェナク添加
ジクロフェナクを加えることで、心筋細胞(心筋の構造タンパク質αアクチニンを赤色、細胞核を青色で染色)の誘導が促進し、細胞内部には心筋に特徴的な横紋筋構造(強拡大像)も明瞭に観察される。スケールバーは100μm
3. ジクロフェナクは加齢老化に伴い上昇するシクロオキシゲナーゼ-2/プロスタグランジンE2/インターロイキン1βの炎症と線維化を遮断して心筋誘導を促進する
ジクロフェナクはシクロオキシゲナーゼ(COX)-1及び-2阻害により、炎症性物質であるプロスタノイド(注4)産生を抑制して抗炎症作用を発揮することが知られています。次にジクロフェナクが新生児・成体期線維芽細胞で時期特異的に心筋誘導を促進する分子メカニズムを解析しました。まず線維芽細胞の遺伝子発現を解析したところ、加齢とともにCOX-2やプロスタグランジンE2(PGE2)の受容体(プロスタノイド受容体(注5))であるEP4など炎症や線維化関連遺伝子の発現が上昇することを見出しました。さらにジクロフェナクは、加齢老化とともに上昇する線維芽細胞内のCOX-2、PGE2、EP4、その下流のインターロイキン1β(IL-1β)やインターロイキン1受容体タイプ1(IL-1R1)(注6)の炎症や線維化関連遺伝子の発現を阻害することで、心筋誘導を促進することを明らかにしました。
以上により、加齢老化とともに増強される炎症及び線維化が心筋誘導を阻害していること、さらに非ステロイド性抗炎症薬ジクロフェナクにより本経路を抑制することで心筋誘導が改善することを見出しました(図3)。
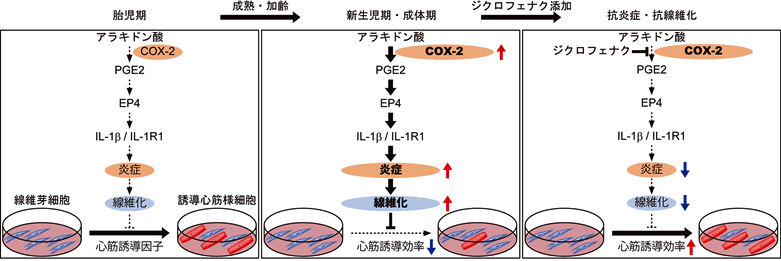
図3:ジクロフェナクによる新生児期・成体期線維芽細胞からの心筋誘導促進
(左)胎児期線維芽細胞、(中)新生児期・成体期線維芽細胞、(右)ジクロフェナク添加後
胎児期から新生児期・成体期へと加齢老化が進むにつれて、線維芽細胞でのCOX-2の発現が上昇し、最終的に炎症および線維化が進行することで、心筋誘導が抑制される。一方、ジクロフェナク添加後はCOX-2の阻害により、炎症と線維化が抑制され、心筋誘導が改善する。
4. 既知の心筋誘導促進化合物との比較
ジクロフェナクによる心筋誘導促進効果を既知の心筋誘導促進化合物(WNT阻害剤、TGF-β阻害剤)と比較・検討を新生児期線維芽細胞で実験しました。その結果、ジクロフェナクは、他の化合物より早期にかつ強力に心筋誘導を促進しました。さらに、他の化合物との併用で、相乗効果を認めました。網羅的に遺伝子発現を比較したところ、ジクロフェナク添加で炎症や線維芽細胞関連遺伝子の発現が特異的に抑制されることを見出しました。
以上より、今回解明したジクロフェナクによる抗炎症及び抗線維化作用による心筋誘導促進は、既知の心筋誘導化合物とは異なる新規の機序であることが明らかとなりました。
今後の展開
重症な小児及び成人心疾患に対して、心筋再生療法の確立が急務となっています。本研究成果により、新生児期・成体期の線維芽細胞から安全・簡便・効率的な心筋細胞の直接作製法を確立したことで、心臓再生医療の実現、さらには疾患モデル作成や薬剤開発の促進が期待されます。また、ジクロフェナクの抗炎症及び抗線維化作用により心筋誘導を促進するという仕組みは、他の細胞種作製でも共通する可能性があることから、今後、再生医療全体に貢献することが期待されます。
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「ダイレクトリプログラミングによる心臓再生と分子基盤解明」、公益財団法人先進医薬研究振興財団、公益財団法人武田科学振興財団、公益財団法人第一三共生命科学研究振興財団、JSPS科研費(17K19678、15K15313、15J07407)、慶應義塾大学医学部研究奨励費、日本応用酵素協会、日本循環器学会の支援によって行われました。
用語解説
- 注1)非ステロイド性抗炎症薬
- ステロイド構造以外の抗炎症作用、鎮痛作用、解熱作用を有する薬の総称。プロスタノイドを生成するシクロオキシゲナーゼ(COX)を阻害することが共通の作用機序としてあげられる。
- 注2)トランスジェニックマウス
- αMHC-CreマウスとRosa26-tdTomatoマウスを交配して作製されたαMHC-Cre/R26-tdTomatoトランスジェニックマウス。Cre/Loxpシステムを利用することで、αMHCを発現した細胞はその後tdTomatoを発現し続けることから、αMHC陽性の心筋細胞を標識可能となる。
- 注3)化合物をスクリーニングするシステム
- 細胞または細胞集団に対して蛍光プローブや画像処理手法を用い、系統的に定量データを得てスクリーニングを行った。
- 注4)プロスタノイド
- プロスタノイドは、プロスタグランジン(PG)とトロンボキサン(TX)からなる生理活性脂質であり、細胞膜構成成分であるリン脂質からホスホリパーゼA2とシクロオキシゲナーゼの作用でアラキドン酸、PGH2を経て特異的合成酵素によって5種のプロスタノイドPGD2、PGE2、PGF2、PGI2、TXA2が生合成される。
- 注5)プロスタノイド受容体
- 各種プロスタノイドPGD2、PGE2、PGF2、PGI2、TXA2にはそれぞれ特異的な受容体DP、EP、FP、IP、TPが存在し、そのうちDPには2種のサブタイプDP1、DP2(CRTH2)が、EPには4種のサブタイプEP1、EP2、EP3、EP4が存在する。プロスタノイド受容体は,7回膜貫通期のGタンパク質共役受容体で、結合するGタンパク質によって細胞に及ぼす作用が異なる。EP4は、刺激性Gたんぱく質(Gs)に共役しており、アデニル酸シクラーゼの活性化を介して、サイクリックAMP(cAMP)の生成、さらにはcAMP依存性プロテインキナーゼ(プロテインキナーゼA: PKA)を活性化し、細胞内応答を引き起こす。
- 注6)インターロイキン-1受容体
- インターロイキン-1受容体(IL-1R)はインターロイキン-1(IL-1)をリガンドとする受容体で、IL-1R1(IL-1 受容体タイプⅠ)とIL-1R2(IL-1 受容体タイプⅡ)の二種類がある。このうちIL-1R1に結合した場合にのみシグナルを伝達し、炎症反応に関与するNF-κBなどの活性化を引き起こす。
参考文献
- Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct Reprogramming of Fibroblasts into Functional Cardiomyocytes by Defined Factors. Cell.; 142(3): 375–386, 2010 Aug 6
- Inagawa K, Miyamoto K, Yamakawa H, Muraoka N, Sadahiro T, Umei T, Wada R, Katsumata Y, Kaneda R, Nakade K, Kurihara C, Obata Y, Miyake K, Fukuda K, Ieda M. Induction of Cardiomyocyte-like Cells in Infarct Hearts by Gene Transfer of Gata4, Mef2c, and Tbx5. Circ Res.;111(9):1147-56, 2012 Oct 12
- Wada R, Muraoka N, Inagawa K, Yamakawa H, Miyamoto K, Sadahiro T, Umei T, Kaneda R, Suzuki T, Kamiya K, Tohyama S, Yuasa S, Kokaji K, Aeba R, Yozu R, Yamagishi H, Kitamura T, Fukuda K, Ieda M. Induction of Human Cardiomyocyte-like Cells from Fibroblasts by Defined Factors. Pro Natl Acad Sci USA.;110(31):12667-72, 2013 Jul 30
- Muraoka N, Yamakawa H, Miyamoto K, Sadahiro T, Umei T, Isomi M, Nakashima H, Akiyama M, Wada R, Inagawa K, Nishiyama T, Kaneda R, Fukuda T, Takeda S, Tohyama S, Hashimoto H, Kawamura Y, Goshima N, Aeba R, Yamagishi H, Fukuda K, Ieda M. MiR-133 promotes cardiac reprogramming by directly repressing Snai1 and silencing fibroblast signatures. EMBO J.;33(14):1565-81, 2014 Jul 17
- Yamakawa H, Muraoka N, Miyamoto K, Sadahiro T, Isomi M, Haginiwa S, Kojima H, Umei T, Akiyama M, Kuishi Y, Kurokawa J, Furukawa T, Fukuda K, Ieda M. Fibroblast Growth Factors and Vascular Endothelial Growth Factor Promote Cardiac Reprogramming under Defined Conditions. Stem Cell Reports.;5(6):1128-42, 2015 Dec
- Miyamoto K, Akiyama M, Tamura F, Isomi M, Yamakawa H, Sadahiro T, Muraoka N, Kojima H, Haginiwa S, Kurotsu S, Tani H, Wang L, Qian L, Inoue M, Ide Y, Kurokawa J, Yamamoto T, Seki T, Aeba R, Yamagishi H, Fukuda K, Ieda M. Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction. Cell Stem Cell.; 22(1):91-103.e5; 2018 Jan 4.
- Taketaro Sadahiro, Mari Isomi, Naoto Muraoka, Hidenori Kojima, Sho Haginiwa, Shota Kurotsu, Fumiya Tamura, Hidenori Tani, Shugo Tohyama, Jun Fujita, Hiroyuki Miyoshi, Yoshifumi Kawamura, Naoki Goshima, Yuka W. Iwasaki, Kensaku Murano, Kuniaki Saito, Mayumi Oda, Peter Andersen, Chulan Kwon, Hideki Uosaki, Hirofumi Nishizono, Keiichi Fukuda, Masaki Ieda. Tbx6 Induces Nascent Mesoderm from Pluripotent Stem Cells and Temporally Controls Cardiac versus Somite Lineage Diversification. Cell Stem Cell.; 23(3):382-395.e5; 2018 Sep 6
掲載論文
- 題名
- Role of Cyclooxygenase-2-mediated Prostaglandin E2-Prostaglandin E Receptor 4 Signaling in Cardiac Reprogramming
(心筋誘導におけるCyclooxygenase-2とProstaglandin E2/Prostaglandin E Receptor 4シグナルの役割) - 著者名
- Naoto Muraoka, Kaori Nara, Fumiya Tamura, Hidenori Kojima, Hiroyuki Yamakawa, Taketaro Sadahiro, Kazutaka Miyamoto, Mari Isomi, Sho Haginiwa, Hidenori Tani, Shota Kurotsu, Rina Osakabe, Satoru Torii, Shigeomi Shimizu, Hideyuki Okano, Yukihiko Sugimoto, Keiichi Fukuda, and Masaki Ieda
- 掲載誌
- Nature communications
- DOI
- 10.1038/s41467-019-08626-y
お問い合わせ先
本研究内容に関して
家田 真樹(いえだ まさき)
筑波大学 医学医療系(循環器内科) 教授
AMED事業に関して
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課