白血病幹細胞を標的として
2019-04-05 京都大学
横田明日美 医学研究科研究員(現・シンシナティ小児病院医療センター研究員)、平位秀世 医学部附属病院助教と前川平 同教授(現・京都府保健環境研究所所長)らの研究グループは、従来から一部の白血病治療に用いられてきたインターフェロンの作用の分子メカニズムの一端を解明しました。
インターフェロンはウイルス感染時などに細胞から放出される液性のタンパク質で、抗ウイルス作用のほか、様々な生理活性を持つことが知られています。これまでにインターフェロンは慢性骨髄性白血病などの白血病治療に用いられて一定の効果を示しているにもかかわらず、その分子メカニズムについては十分に解明されていませんでした。
今回、本研究グループは、慢性骨髄性白血病の実験動物モデル及び患者から提供を受けた白血病細胞を用いて検討し、インターフェロンが白血病の原因遺伝子と協調して働き、白血病幹細胞の枯渇を誘導することがわかりました。白血病幹細胞は、白血病の治療抵抗性や再発の原因となると考えられており、本研究成果は一部の白血病においてインターフェロンを工夫して投与することによって治療成績がさらに改善する可能性を示唆するものです。
本研究成果は、2019年2月12日に国際学術誌「Blood Advances」のオンライン版に掲載されました。

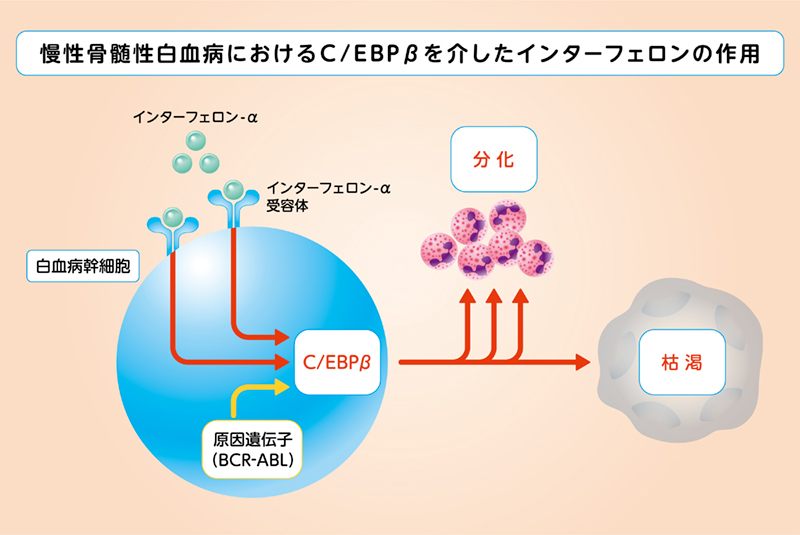
図:本研究の概要図
詳しい研究内容について
インターフェロンの抗白血病作用の分子メカニズムを解明
―白血病幹細胞を標的として―
概要
京都大学医学研究科 横田明日美 研究員 研究当時、現 シンシナティ小児病院医療センター研究員)、京都 大学医学部附属病院 平位秀世 助教と前川平 同教授 研究当時、現 京都府保健環境研究所所長)らの研究 グループは、従来から一部の白血病治療に用いられてきたインターフェロンの作用の分子メカニズムの一端を 解明しました。 イ
ンターフェロンはウイルス感染時などに細胞から放出される液性のタンパク質で、抗ウイルス作用のほか、 様々な生理活性を持つことが知られています。これまでにインターフェロンは慢性骨髄性白血病などの白血病 治療に用いられて一定の効果を示しているにもかかわらず、その分子メカニズムについては十分に解明されて いませんでした。今回、本研究グループは、慢性骨髄性白血病の実験動物モデル及び患者様から提供を受けた 白血病細胞を用いて検討し、インターフェロンが白血病の原因遺伝子と協調して働き、白血病幹細胞の枯渇を 誘導することがわかりました。白血病幹細胞は、白血病の治療抵抗性や再発の原因となると考えられており、 本研究成果は一部の白血病においてインターフェロンを工夫して投与することによって治療成績がさらに改 善する可能性を示唆するものです。
本研究成果は、2019 年 2 月 12 日に国際学術誌「Blood Advances」のオンライン版に掲載されました。
1.背景
慢性骨髄性白血病は、相互転座と呼ばれる染色体の異常によって生じた BCR-ABL という異常蛋白質が原因 です。BCR-ABL は、全ての血液細胞の源となる造血幹細胞の中で様々な分子を活性化して、白血病の発症と 進展をもたらします。無治療のまま放置すれば次第に悪化して、治療が困難になります。現在は、BCR-ABL の 作用を抑制する薬剤(チロシンキナーゼ阻害剤)が開発されており、その予後は大幅に改善しています。しかし、 薬剤が効きにくい場合や、よく反応している場合でも薬剤を中止すると再発する場合があるなど、根治を目指 すにはさらに優れた治療法の開発が必要です。そのためには、これら薬剤耐性や再発の原因となる白血病幹細 胞を根絶することが課題と考えられています。
これまでに平位 助教らの研究グループは、感染症などに反応して白血球が増える際には C/EBPβという蛋 白質が造血幹細胞の中で重要な働きをしていることを明らかにしていました(Nat Immunol, 2006, J Immunol, 2012)。C/EBPβは、造血幹細胞の分化と増殖を促進します。さらに、慢性骨髄性白血病では、BCR-ABL が STAT5 という蛋白の作用を介して C/EBPβを活性化し、白血球増加をもたらしていること、C/EBPβが上昇 すると白血病幹細胞が分化して枯渇する方向に作用することを見出していました(Leukemia, 2013)。これらの 結果から、薬剤によって C/EBPβをさらに活性化することができれば、白血病幹細胞の枯渇を強力に誘導す ることができ、最終的には根絶できるのではないかと考えました。
2.研究手法・成果
慢性骨髄性白血病モデル細胞を用いて、さまざまな化学物質、生理活性物質を検討したところ、これまでに 慢性骨髄性白血病の治療に用いられてきたインターフェロン α が効率よく C/EBPβを活性化することが明ら かとなりました。インターフェロン α の刺激は慢性骨髄性白血病細胞内で STAT1 という蛋白質と STAT5 と いう蛋白質を活性化し、これらが直接 C/EBPβの発現を亢進させます。もともと BCR-ABL よって STAT5 が 活性化されている慢性骨髄性白血病内では、インターフェロン α の C/EBPβ活性化作用が増強されます。実 験動物を用いた慢性骨髄性白血病モデルにおいて、インターフェロン α は慢性骨髄性白血病の白血病幹細胞 の分化を誘導して枯渇に導くという観察結果が得られ、その作用は C/EBPβに依存しているということが判 明しました。興味深いことに正常の造血幹細胞に比して、白血病幹細胞はインターフェロン α に対して高い 感受性を持つことも示されました。慢性骨髄性白血病の患者様の白血病細胞を用いても、細胞や実験動物で観 察されたのと同様に、インターフェロン α が C/EBPβの発現を亢進させることと、白血病幹細胞の枯渇を誘 導するという作用が確認できました。
以上の結果から、インターフェロン α による慢性骨髄性白血病の効果の少なくともその一部は、C/EBPβ の活性化を介した白血病幹細胞の枯渇誘導によると考えられました。
3.波及効果、今後の予定
慢性骨髄性白血病の治療におけるインターフェロン α の位置付けは、チロシンキナーゼ阻害剤の登場によ って、大きく低下していますが、最近になってその意義を見直す傾向も出てきています。今回の研究で示され たように白血病幹細胞に対する作用メカニズムが明らかになれば、投与量や投与スケジュールの見直しによっ て、現在の治療成績を改善できる可能性があります。さらに本研究では、慢性骨髄性白血病以外の白血病につ いても同様のメカニズムが存在する可能性が示されており、インターフェロン以外に C/EBPβを活性化する 物質の探索も含めて今後の開発が期待されます。
4.研究プロジェクトについて
本研究成果は、京都府立医科大学ゲノム医科学の田代 啓教授、中野 正和准教授、佐賀大学医学部・血液・ 呼吸器腫瘍内科の木村 晋也教授、ハーバード大学 ・シンポーール癌科学研究所の Daniel G Tenen 教授らとの 共同研究によるものです。
本研究は、日本学術振興会、日本医療研究開発機構、金沢大学がん進展研究所共同研究、京都大学リサーチ・ ディベロップメントプログラム(いしずえ)などの支援を受けています。
<研究者のコメント>
今回の研究では、これまでの研究グループの正常造血細胞および白血病細胞の制御メカニズムに関する研究 成果をもとに、実際に白血病治療に用いられてきたインターフェロン α の作用メカニズムを明らにすること ができました。この成果は、白血病幹細胞の枯渇誘導という白血病治療の新たな治療戦略を提唱するものです。 今後さらに造血制御機構の理解を深めることによって様々な病態の理解や治療開発に貢献したいと考えてい ます。(京都大学医学部附属病院 平位秀世 助教)
<論文タイトルと著者>
タイトル :C/EBPβ is a critical mediator of IFNα-induced exhaustion of chronic myeloid leukemia stem cells. (C/EBPβ は IFNα による慢性骨髄性白血病幹細胞の枯渇誘導を介在する主要因子である)
著 者 :Asumi Yokota (横田 明日美) 1,2, Hideyo Hirai (平位 秀世) 1 , Ryuichi Sato (佐藤 隆一) 3 , Hiroko Adachi (足立 博子) 3 , Fumiko Sato (佐藤 史子) 3 , Yoshihiro Hayashi (林 嘉宏) 2,4, Atsushi Sato (佐藤 淳至) 1 , Naoka Kamio (神尾 尚馨) 1 , Yasuo Miura (三浦 康生) 1 , Masakazu Nakano (中野 正 和) 3 , Daniel G Tenen6,7, Shinya Kimura (木村 晋也) 7 , Kei Tashiro (田代 啓) 3 , Taira Maekawa (前 川 平) 1
所属機関 :1 Department of Transfusion Medicine and Cell Therapy, Kyoto University Hospital, 2 Division of Experimental Hematology and Cancer Biology, Cincinnati Children’s Hospital Medical Cente, 3 Department of Genomic Medical Sciences, Kyoto Prefectural University of Medicine, Kyoto, 4 Laboratory of Oncology, School of Life Sciences, Tokyo University of Pharmacy and Life Sciences, 5 Cancer Science Institute, National University of Singapore, 6 Harvard Stem Cell Institute, Harvard Medical School, 7 Division of Hematology, Respiratory Medicine and Oncology, Department of Internal Medicine, Faculty of Medicine, Saga University
掲 載 誌 :Blood Advances 3(3): 476-488, 2019
DOI :10.1182/bloodadvances.2018020503