2019-04-19 東京大学生産技術研究所
○発表者:
池内 与志穂(東京大学 生産技術研究所 准教授)
○発表のポイント:
◆大脳は機能ごとにたくさんの領域に分かれています。遠い領域間は、神経細胞の「軸索」が集まった束状の組織でつながっており、これを介して情報をやりとりしています。
◆今回、ヒトiPS細胞から2つの大脳神経組織を作製し、それらを軸索が束状にあつまった組織でつなぐことに成功しました。
◆本研究成果は大脳内の神経回路や、関連する疾患の研究に役立てることができます。
○概要:
脳の理解のために、体の外でその成り立ちや機能を調べることを可能にするモデル実験系が必要とされています。今回、ヒトiPS細胞から2つの大脳神経組織を作製し、それらを軸索が束状にあつまった組織でつなぐことに成功しました。今回作製した組織は、私たちの大脳内の領域がつながりあっている様子に似ています。つながっている部分は軸索と呼ばれる神経の突起でてきており、電気刺激を伝えることができることを確認しました。軸索組織の疾患を引き起こす原因遺伝子を抑制したところ、軸索組織を作る効率が低下したことから、疾患のモデルとしても有用であると考えられ、今後は脳の理解と疾患の克服に向けた研究に使用されることが期待されます。
○発表内容:
<研究背景>
大脳皮質は、運動制御、言語処理、視覚情報処理などといった機能ごとに、異なる領域に分かれています。このような距離的に離れた領域間は、大脳の白質と呼ばれる部分で軸索(注1)が束状になった組織によってつながっており、それぞれの領域で処理された情報はこの束状組織を介して統合されています。しかし、この束状の軸索組織の配線は非常に複雑で、脳内の回路が作られるしくみや脳が働くしくみを解析するためには、単純化したモデル実験系が求められています。
そこで、本研究では試験管内において、離れた2つの大脳の領域を軸索の束でつないだ構造を模倣した、人工的な大脳組織を作製しました(図1)。
<研究内容>
本研究グループは以前、マイクロデバイス(微小装置)内で運動神経組織を培養することで、軸索の束状組織を効率的に作製する手法を報告しました。今回、この研究を発展させて2つの人工大脳組織をつなげた組織を作製しました。そのためにまず、約1万個のヒトiPS細胞からなる球状の組織を大脳神経に分化させ、マイクロデバイスの両側に1つずつ配置して培養しました。この組織には大脳神経のみがもつタンパク質が存在していることや、発生中の脳組織の様な特徴的な構造をとることから、この組織が生体内の大脳神経と似た組織であることを確認しました。デバイス内で培養すると、それぞれから多数の軸索が伸び、デバイスに移してから25日後には、細い通路内の軸索束状組織によって2つの人工大脳組織がつながった組織を作製することに成功しました(図2)。
2つの人工大脳組織をつないだ部分の組織を免疫染色法によって解析したところ、軸索にのみ含まれるタンパク質が観測され、一方で細胞体や樹状突起は観測されませんでした。また、電子顕微鏡観察の結果、この部分の組織内では軸索が規則正しく集まって集合していることが判明しました。このことから、2つの人工大脳組織は互いに無数の軸索を伸ばしあって軸索の束状組織を作り、自発的につながったことが分かりました。
また、2つのチャンバーの片方のみに球状組織を入れた場合、軸索の束状組織の形成効率が、両側から軸索が伸びてきた場合に比べて低く、軸索が自発的に集まりにくいことがわかりました。片側に球状組織を入れ、もう片側にガラスビーズを入れた場合にも同様に束状が集まって組織を形成する効率は低いままでした。マイクロデバイスを用いず、軸索が自由にどの方向にでも伸びられる様な状況にした場合には、まったく軸索束組織は形成されませんでした。これらの結果は、2つの組織から伸びた軸索が相互作用し、軸索束の形成を促進していることを示唆しています。
カルシウムイメージング法を用いた電気生理学的な解析の結果、1つの球状組織を電気的に刺激した時に、もう1つの球状組織で信号が検出されたことから、2つの球状組織間で情報のやりとりが行われていることが示されました。詳しく組織の応答を調べたところ、直接刺激を受けた組織に比べ、軸索でつながったもう1つの組織が数十ミリ秒遅れて反応することが分かりました。これによって、今回作製した組織が、大脳の離れた領域間で情報を伝達する様子を模倣することがわかりました(図3)。
次に、生体内で軸索束の形成に不可欠であることが知られている、L1CAMと呼ばれる遺伝子に注目して解析を行いました。L1CAM遺伝子に突然変異が起こると、脳内の最大の軸索束であり、左右の大脳をつなぐ脳梁を欠損するなどの症状を引き起こすことが知られています。この遺伝子の機能を欠損させたところ、欠損させた細胞の軸索束の形成効率が大きく低下することがわかりました(図4)。このことから、今回作製した人工大脳組織は、生体内の脳組織と同様のしくみで軸索束が形成されており、正常な脳ができる過程でだけでなく、遺伝子の異常が原因で起こる関連疾患のモデルとしても使えることがわかりました。
<今後の展望>
これらの結果から、今回作製した人工大脳組織が生体内の現象を単純化したモデル実験系として有用であることが示されたため、脳内の神経回路の配線がどのように構築され、どのように機能しているかを調べるための研究に活用されることが期待されます。中枢神経系の様々な疾患を模倣したモデル実験系に発展させ、治療薬探索のプラットフォームとして使用することも期待されます。
○発表雑誌:
雑誌名:iScience(オンライン版:日本時間4月19日(金)掲載)
論文タイトル:A human iPS cell-derived tissue model of a cerebral tract connecting two cortical regions.
著者:Takaaki Kirihara, Zhongyue Luo, Siu Yu A. Chow, Ryuji Misawa, Jiro Kawada, Shinsuke Shibata, Farad Khoyratee, Carole Anne Vollette, Valentine Volz, Timothée Levi, Teruo Fujii, Yoshiho Ikeuchi.
DOI:10.1016/j.isci.2019.03.012
○問い合わせ先:
東京大学 生産技術研究所
准教授 池内 与志穂(いけうち よしほ)
〒153-8505 東京都目黒駒場4-6-1
Tel:03-5452-6330 Fax:03-5452-6331
URL:http://www.bmce.iis.u-tokyo.ac.jp/
○用語解説:
注1:軸索
神経細胞の一部で、電気信号(活動電位)を伝える役割を果たす。
○添付資料:
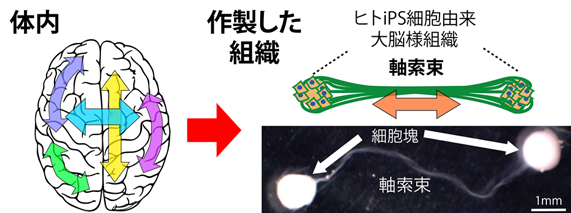
図1 大脳内の2つの領域がつながる構造をまねて作製した人工神経組織の模式図
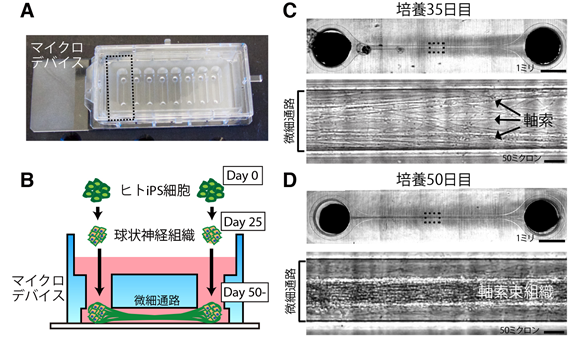
図2 大脳束状神経組織の作製方法
A:使用したマイクロデバイスの写真。破線部に2つの丸いチャンバーとそれをつなぐ細いチャネルがあり、一つの軸索束組織が作製できます。B:作製方法の概略。iPS細胞を大脳神経へ分化させ、25日目にマイクロデバイスへ移し培養します。C:35日目頃(デバイスに移してから10日目頃)になるとチャネルの中に多数の軸索が伸長します。D:50日目頃になるとチャネル内の軸索が束状の組織になります。
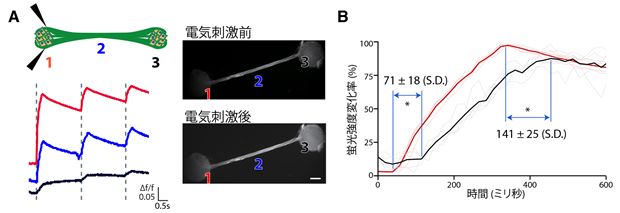
図3 作製した組織のカルシウムイメージング法を用いた電気生理学的な解析
A:片方の球状組織部分を電気刺激した時に、軸索束部分と、もう片側の球状組織部分が応答します。B:直接電気刺激された球状組織よりももう片方の球状組織の方が少し遅れて応答しました。
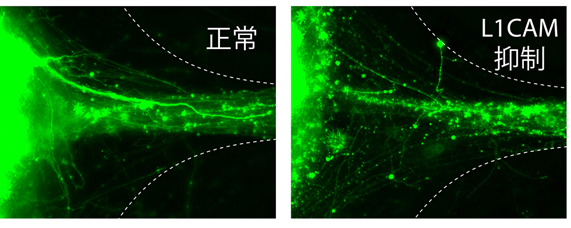
図4 L1CAM遺伝子抑制による軸索束形成効率の低下
マイクロデバイス内において、球状組織から伸びた軸索が微細通路に入るところで束状組織を形成する部分の拡大図。左:正常な軸索。右:L1CAM遺伝子を抑制した軸索。正常に比べて軸索が集まらず、バラバラに存在する。