2019-06-03 自然科学研究機構
名古屋市立大学薬学研究科生命分子構造学分野の加藤晃一教授と矢木宏和講師らの研究グループと自然科学研究機構は、細胞の概日リズムを担う時計タンパク質に着目して共同研究を行い、分子のかたちの中に組み込まれた巧妙な仕掛けによってタンパク質の間の離合集散が制御されて24時間周期を生み出していることを世界で初めて明らかにしました。本研究成果は6月3日午前8時(米国東海岸時間)、(日本時間6月3日午後9時)にEMBO、Rockefeller University、Cold Spring Harbor Laboratory により創刊された生命科学系オープンアクセス学術誌「Life Science Alliance」 に掲載されます。
本研究成果のポイント
シアノバクテリアの概日リズムは、3つの時計タンパク質KaiA、KaiB、KaiCで離合集散することを通じて生み出されています。本研究では、時計の心臓部にあたるKaiCタンパク質が時間の経過とともに釣り糸を垂らすように分子のかたちを変えて、KaiAタンパク質を捕まえていることを初めて見出しました。KaiCタンパク質のこうした変化は、生体のエネルギー通貨ともよばれるATP分子を消費することで制御されています。この結果は、Kaiタンパク質が24時間のリズムを生み出す仕掛けに迫るものです。
背景
地球は24時間の周期で自転しているために日照時間や潮の満ち干は変動します。こうした周期性は生体内にみられ、例えばヒトの体温、心拍数、肝機能などは24時間周期の自立変動を示します。この自立変動は概日リズムと呼ばれます。概日リズムは、タンパク質が振り子の役割を果たす生物時計によって生み出されており、ヒトに留まらず、バクテリア、植物、動物の間で幅広く存在しています。
シアノバクテリアでは、時計タンパク質としてKaiA、KaiB、KaiCが見出されており、試験管内でこれら3種のタンパク質とアデノシン三リン酸 (ATP) [注1] を混ぜあわせるだけで、KaiCを中核として24時間周期でタンパク質が離合集散するというユニークな性質を示します。この周期的な変化にもとづいて概日リズムが生み出されると考えられています。しかしながら、タンパク質分子の離合集散する仕組みは未だ解明されていません。こうした仕組みの本質は高等生物にも共通している可能性があり、関心が集まっています。
研究成果
本研究では、3つの時計タンパク質のうちでKaiAとKaiCの間の相互作用に着目し、KaiCによるATPの消費量との関係を調べました。超分子質量分析[注2]により、KaiCはもともと12個のATPを持っているが、時間が経つにつれてそのうちの5個を消費(分解)してADPに変えることが明らかになりました。そして、こうしたATPの分解が進んだKaiCに対してKaiAは高い親和性を持つことも明らかにしました。
これまでの先行研究により、KaiAはKaiC分子の尻尾にあたる部位(図1Bで黄と緑で示した部分)にくっつくことが報告されています。核磁気共鳴(NMR)法[注3]を用いてKaiCの構造をつぶさに調べたところ、ATPの分解に伴って、この部分があたかも釣り糸を垂らすように分子の外に現れて、KaiAを捕まえるようになることがわかりました。
KaiAがくっつくことでKaiC分子のかたちはさらに変化して、ADPを新たなATPと交換したり、自身をリン酸化するなどして時計の針が進んでいくものと考えられます(図1)。
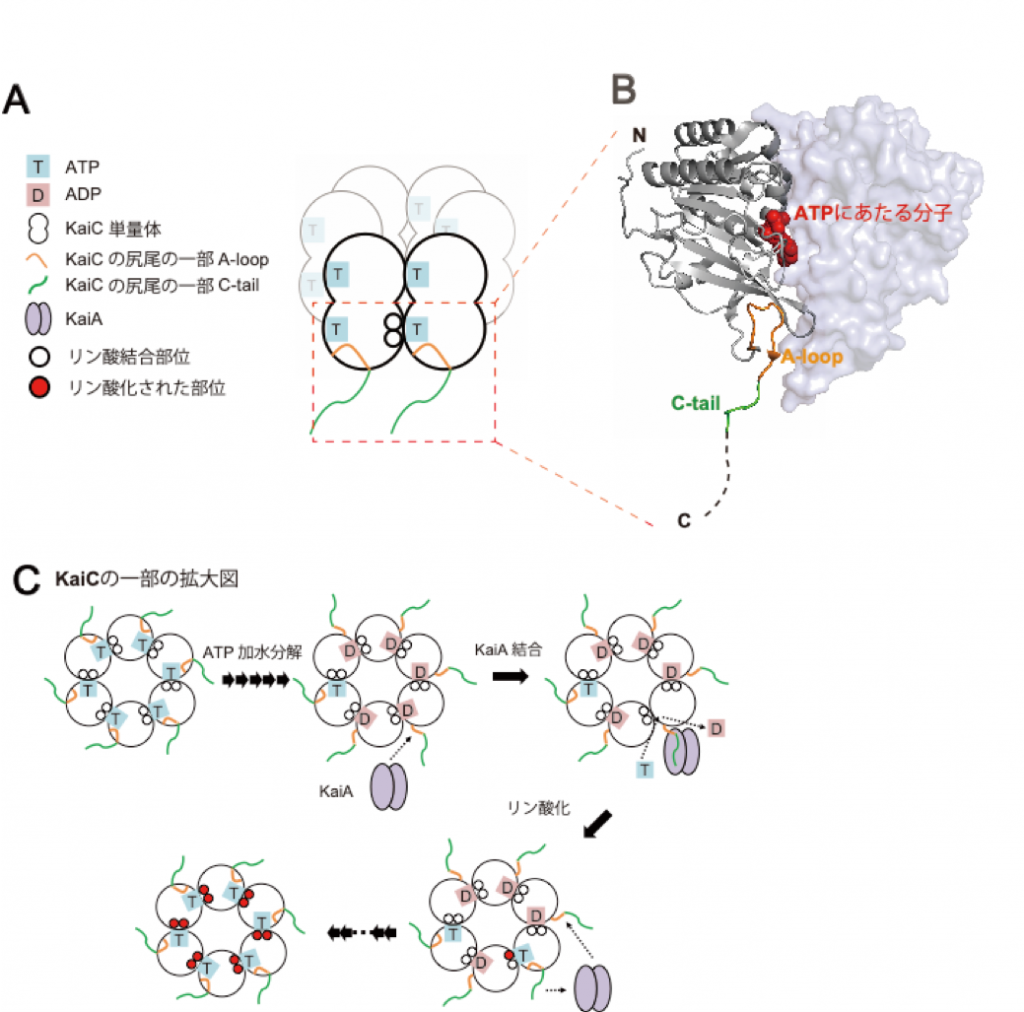
図1(A)KaiCは6分子が集まって複合体を形成しており、その中に12個のATP(図中で“T”と表記)を含んでいる。(B)KaiCの尻尾の一部(図中の黄と緑で示した部分)はATPが消費される前は分子の内部に隠されている。(C)ATP(T)が消費されてADP(D)に変わるとその部分が分子の外に出てきてKaiAを捕まえるようになる。これによってKaiCの状態はさらに変化して時計の針が進んでいくものと考えられる。
成果の意義および今後の展開
本研究では、先端機器を駆使して時計タンパク質の分子構造の細やかな変化を捉えることに成功し、これにより生物時計が動作する精密なからくりを初めて明らかにしたものです。この成果はタンパク質により概日リズムが生み出される仕組みを理解する上で非常に重要な知見になると考えています。今後、さらにヒトを含む高等動物の生物時計の分子メカニズムをより理解することで、生体リズムの不調に由来する時差ボケや睡眠障害の治療にも貢献できる可能性があります。
用語解説
・アデノシン三リン酸 (ATP) [注1]:ヌクレオチドの1種であり、細胞内でのエネルギーのやりとりに使われている。ATPの分解によりアデノシン二リン酸(ADP)とリン酸が生じる。
・超分子質量分析 [注2]:ゆるく結びついた分子の集合体まるごとの質量を測定することで、タンパク質複合体の構成やそこに含まれる分子の数と種類を明らかにすることができる。
・核磁気共鳴(NMR)法 [注3]:タンパク質などを磁場の中に入れてラジオ波を照射することで核スピンの共鳴現象を観測し、分子構造を原子レベルで解析することができる。
研究グループ
本研究は、名古屋市立大学の他、自然科学研究機構、大阪大学が参加した共同研究です。
研究サポート
本研究は、科学研究費補助金 特別研究員奨励費(JP18J21063)、基盤研究(JP15K18492, JP18K14671)および新学術領域研究「生命分子システムにおける動的秩序形成と高次機能発現」(JP25102001, JP25102008)、等の サポートを受けて実施されました。
掲載される論文の詳細
掲載誌:Life Science Alliance電子版
題目:ATP Hydrolysis by KaiC Promotes Its KaiA Binding in the Cyanobacterial Circadian Clock System
著者:柚木康弘(名古屋市立大学)、石井健太郎(自然科学研究機構)、矢木-内海真穂(自然科学研究機構)、村上玲子(名古屋市立大学)、内山 進(大阪大学)、矢木宏和(名古屋市立大学)、加藤晃一(名古屋市立大学、自然科学研究機構)
DOI: 10.26508/lsa.201900368
発表機関
名古屋市立大学
自然科学研究機構 生命創成探究センター
自然科学研究機構 分子科学研究所
お問い合わせ先
《研究全般に関するお問い合わせ先》
名古屋市立大学大学院薬学研究科
教授 加藤 晃一
名古屋市立大学大学院薬学研究科
講師 矢木 宏和
《報道に関するお問い合わせ先》
名古屋市立大学事務局企画広報課広報係