エピゲノム情報との統合で、生活習慣病の病態解明が可能に
2018-02-06 理化学研究所,大阪大学,日本医療研究開発機構
要旨
理化学研究所(理研)統合生命医科学研究センター統計解析研究チームの鎌谷洋一郎チームリーダー、金井仁弘研修生、大阪大学大学院医学系研究科遺伝統計学の岡田随象教授らの共同研究グループ※は、日本人集団16万人の遺伝情報を用いた大規模なゲノムワイド関連解析(GWAS)[1]を行い、臨床検査値[2]に影響するゲノム配列上の遺伝的変異を1,400カ所同定しました。
医療機関において広く行われている臨床検査の結果は、個人の遺伝的背景の影響を受けていることが知られています。遺伝的変異がどのようなメカニズムで、どのような病気の発症に関わっているか、臨床検査結果にどのように表れるかを知るためにも重要です。
今回、共同研究グループは、バイオバンク・ジャパン[3]によって集められた日本人集団16万人分の遺伝情報と、58項目の臨床検査値(血液検査および血圧・心電図などの生理機能検査)の情報を用いて、600万カ所の遺伝的変異を対象としたGWASを行いました。その結果、臨床検査値に影響する1,400カ所の遺伝的変異を同定し、そのうち約半数が本報告により初めて報告されます。さらに、32疾病におけるGWAS結果と合わせて、220種類の細胞組織から得られたエピゲノム情報[4]と統合する分野横断的なオミクス解析[5]を行いました。その結果、生活習慣病と密接に関係する血圧や脂質値などは、遺伝的背景が共通していることや、バセドウ病[6]における制御性T細胞[7]の関与など、病気や臨床検査値に影響を与える細胞組織を同定することに成功しました。
本研究は、大規模なヒトゲノム解析により臨床的に意味のある遺伝的変異を数多く同定しただけでなく、ゲノム情報とエピゲノム情報の統合により、細胞組織の同定を通じて病態解明が可能になることを示した、画期的な研究と考えられます。今後、より多くのゲノム情報や臨床情報、エピゲノム情報との統合を行うことで、幅広い分野の研究の発展や個別化医療の実現に貢献するものと期待できます。
本研究におけるGWASの解析結果は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)および、理化学研究所統合生命医科学研究センター統計解析研究チームが構築した日本人集団ゲノム関連解析情報データベース「Jenger」注1)を通じて一般公開されます。本成果が世界中に公開されることで、日本のヒトゲノム研究が世界に向けて発信されるものと期待されます。
本研究成果は、国際科学雑誌『Nature Genetics』に掲載されるのに先立ち、オンライン版(2月5日付け:日本時間2月6日)に掲載されます。
本研究は、日本医療研究開発機構(AMED)の「オーダーメイド医療の実現プログラム」の支援のもと行われました。
注1) Japanese ENcyclopedia of GEnetic associations by Riken (Jenger).
※共同研究グループ
- 理化学研究所
- 統合生命医科学研究センター
副センター長 久保 充明(くぼ みちあき) - 統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
リサーチアソシエイト 秋山 雅人(あきやま まさと)
特別研究員 的場 奈々(まとば なな)
研修生 金井 仁弘(かない まさひろ)(米国ハーバード大学 医学部 博士課程)
客員主管研究員 高橋 篤(たかはし あつし)(国立循環器病研究センター研究所 病態ゲノム医学部 部長) - 基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで) - 骨関節疾患研究チーム
チームリーダー 池川 志郎(いけがわ しろう)
- 大阪大学大学院医学系研究科 遺伝統計学
- 教授 岡田 随象(おかだ ゆきのり)
- 東京大学大学院 新領域創成科学研究科 クリニカルシークエンス分野
- 教授 松田 浩一(まつだ こういち)
- 東京大学医科学研究所 シークエンス技術開発分野
- 特任助教 平田 真(ひらた まこと)
- 藤田保健衛生大学 医学部 精神科
- 教授 岩田 仲生(いわた なかお)
准教授 池田 匡志(いけだ まさし)
背景
医療現場においては日常的に臨床検査が実施され、健康状態の把握や病気の診断に役立てられています。臨床検査結果には、検査時の身体の状況だけでなく、遺伝的背景の違いを反映した個人差があることが知られています。
臨床検査値に影響を与える遺伝的背景の解明は、病気へのかかりやすさや、病態の解明につながることから、ヒトゲノム情報を用いた研究が以前より行われていました。これまでに、臨床検査値に関わるゲノムワイド関連解析(GWAS)が報告されてきましたが、その多くは欧米人集団を対象としたものでした。日本人集団に対しては、鎌谷チームリーダーらが2010年に約1万6,000人を対象としたGWASを報告していますが注2)、より大規模な解析の実施が望まれていました。
また近年、GWASの結果を数多くの細胞組織から得られたエピゲノム情報と分野横断的に統合するオミクス解析を行うことで、単に遺伝的変異を同定するだけでなく、病気に影響を与える細胞組織を同定することが、技術的に可能になってきています注3)。鎌谷チームリーダーらは2017年に、肥満に関わる病気や細胞の同定に成功しており注4)、より多くの臨床情報を対象とした包括的な解析の実施が望まれていました。
注2) Kamatani, Y. et al. Genome-wide association study of hematological and biochemical traits in a Japanese population. Nat. Genet. 42, 201-205 (2010).
注3) Finucane, H. K. et al. Partitioning heritability by functional annotation using genome-wide association summary statistics. Nat. Genet. 47, 1228-1235 (2015).
注4) 2017年9月12日プレスリリース「肥満に影響する遺伝マーカーを解明」
研究手法と成果
共同研究グループは、バイオバンク・ジャパンによって集められた日本人集団16万人の遺伝情報と、58項目の臨床検査値(採血による血液・生化学検査および、血圧や心電図などの生理機能検査)の情報を用いた、大規模なGWASを実施しました(表1))。全ゲノム領域を網羅する600万カ所の遺伝的変異を包括的に検討することで、これらの臨床検査値に影響する1,400カ所の遺伝的変異を同定し、そのうち約半数が初めての報告となりました(図1)。これは、一つの論文として報告された感受性遺伝的変異[8]数において、過去最大規模の成果になります。

表1 解析対象の58臨床検査項目
GWASの対象とした58の検査項目の一覧。採血による血液学的検査(血球数:13項目)および生化学検査(血糖・脂質関連、血清蛋白質、腎機能、電解質、肝機能、その他の検査値:31項目)、生理機能検査(血圧および心電図:14項目)で構成される。
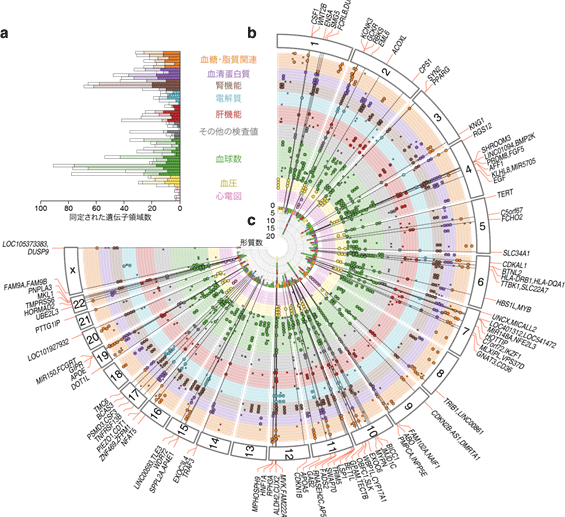
図1 臨床検査値に対するGWAS結果
58項目の臨床検査値に対するGWAS結果。左上のパネルaに、各項目において同定された遺伝的変異数を示した。パネルbに、ヒトゲノムの1-22番染色体およびX染色体における遺伝的変異の分布を対応する遺伝子名とともに示し、中央のパネルcに、各遺伝子領域における関連形質数を示した。
次に、別に実施された32疾病(生活習慣病、自己免疫疾患、悪性腫瘍、精神神経疾患、骨関節疾患)におけるGWAS結果を、今回の臨床検査値のGWAS結果とあわせた上で、病気または臨床検査値の各組み合わせにおける遺伝的背景の共有関係を検討しました。その結果、生活習慣病(2型糖尿病や心血管障害)と血圧や脂質マーカー(中性脂肪やコレステロール値)など、複数の病気や臨床検査値の間で遺伝的背景が共有されていることが明らかになりました(図2)。病気や臨床検査値の関わりの多くは、これまでに疫学調査[9]で指摘されたものでしたが、一部には未報告のものも含まれており、病気と臨床検査を巡る新たな研究テーマにつながると期待できます。
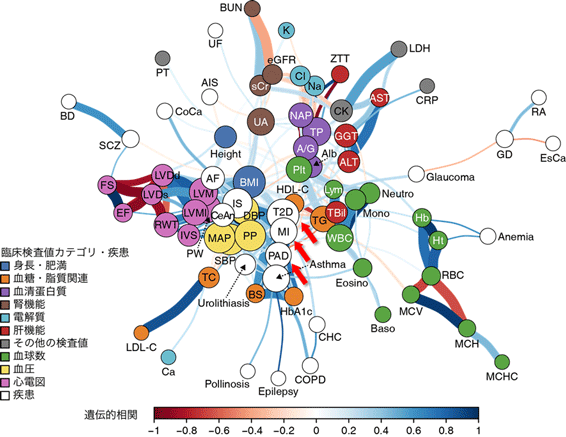
図2 GWAS結果に基づく臨床検査値と病気の遺伝的背景の共有関係
58項目の臨床検査値のGWAS結果と32疾病のGWAS結果を統合することで得られた、遺伝的背景の共有関係。正および負の相関関係がともに存在し、臨床検査値と病気の密接な関わりが明らかとなった。生活習慣病(2型糖尿病;T2Dや心筋梗塞;MI、末梢動脈疾患;PAD [赤矢印部])と血圧(黄色丸)や脂質マーカー(中性脂肪;TCやコレステロール値;TG, LDL-C, HDL-C、橙色丸)など、複数の病気や臨床検査値の間で遺伝的背景が共有されている。
さらに、ヒトの身体のさまざまな箇所から得られた細胞組織における遺伝子発現制御領域[10]に関わるエピゲノム情報を用いて、臨床検査値および病気のGWAS結果と分野横断的に統合するオミクス解析を実施しました。まず細胞組織を10のおおまかなカテゴリーに分類した上で、GWAS結果との関わりの強さを検討しました(図3a)。その結果、身長GWASにおける骨・結合組織、腎機能指標(eGFR)GWAS結果における腎臓組織、肝機能指標(GGT)GWAS結果における肝臓組織など、臨床検査値や病気の生理学的意義に合致した細胞組織における関わりが確認されました(図3b)。これは、ヒトゲノム情報とエピゲノム情報だけから、臨床検査値の生理学的意義や病態を捉えることが可能であると示した、画期的な成果と考えられます。
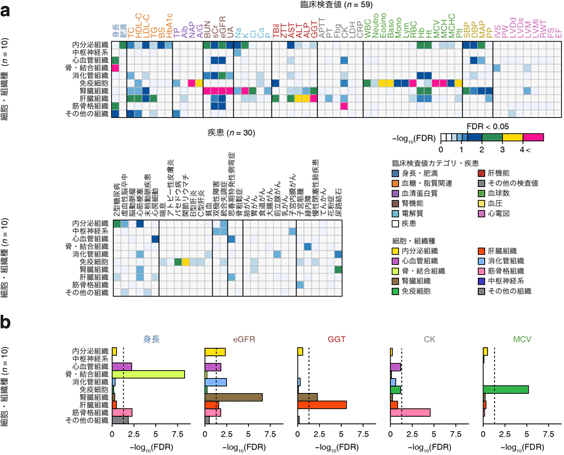
図3 臨床検査値および病気のGWAS結果における細胞組織特異的エピゲノム情報の関わり
a)臨床検査値および病気のGWAS結果と、10カテゴリーに分類した細胞組織に特異的なエピゲノム情報の関わりを示した。
b)身長、腎機能(eGFR)、肝機能(GGT)、筋骨格(CK)、赤血球(MCV)などの形質によって、関わりの強い細胞組織が異なり、特に生理学的意義の強い細胞組織で関連が認められている。
最後に、220種類の細胞組織に細分化した上で、再び臨床検査値および病気のGWAS結果との関わりを検討しました。臨床検査値や病気の間に認められた遺伝的背景の共有関係も統合することで、臨床検査値、病気、そして細胞組織が構成する包括的なネットワークを明らかにすることができました(図4)。例えば、甲状腺機能に異常が生じるバセドウ病の病態に、免疫系で重要な役割を果たす制御性T細胞(CD4+CD25+CD127-Treg)が関わっていることなど、これまでの医学研究では解明されていなかった点が、本研究により明らかになりました。これは、「どの細胞組織が鍵となって、臨床検査値の変動や病気の発症に関わっているか」という、医学研究における本質的な問いを、ヒトゲノム情報とエピゲノム情報に基づくオミクス解析で明らかにした成果と考えられます。
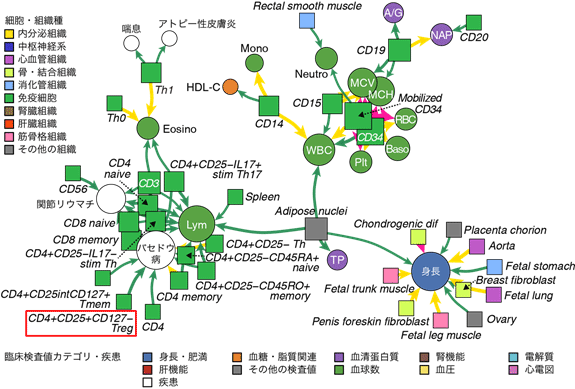
図4 臨床検査値、病気、細胞組織が構成するネットワーク
ゲノム情報(臨床検査値および病気のGWAS結果)と、細胞組織ごとのエピゲノム情報を分野横断的に統合するオミクス解析により、臨床検査値、病気、細胞組織が構成するネットワークが明らかとなった。例えば、バセドウ病に対する制御性T細胞(CD4+CD25+CD127-Treg [赤枠部])の関与など、臨床検査値や病気に影響を与える細胞組織が数多く同定された。
今後の期待
本成果は、大規模ゲノム情報解析により臨床検査値に影響する遺伝的背景を解明し、日本人集団におけるヒトゲノム研究の発展や個別化医療の実現に広く寄与するものです。さらに、ゲノム情報とエピゲノム情報を統合するオミクス解析により、臨床検査値や病気と細胞組織の関わりが明らかになることが示され、今後のヒトゲノム研究の新たな可能性を切り拓くものと期待できます。
本研究によるGWAS結果は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)および、理化学研究所統合生命医科学研究センター統計解析研究チームによる日本人集団ゲノム関連解析情報データベース「Jenger」を通じて一般公開されます。本研究の成果が世界中に公開されることで、日本のヒトゲノム研究が世界に向けて発信されることが期待されます。
論文情報
- タイトル
- Genetic analysis of quantitative traits in the Japanese population links cell types to complex human diseases
- 著者名
- Masahiro Kanai, Masato Akiyama, Atsushi Takahashi, Nana Matoba, Yukihide Momozawa, Masashi Ikeda, Nakao Iwata, Shiro Ikegawa, Makoto Hirata, Koichi Matsuda, Michiaki Kubo, Yukinori Okada, and Yoichiro Kamatani.
- 雑誌
- Nature Genetics
- DOI
- 10.1038/s41588-018-0047-6
補足説明
- [1] ゲノムワイド関連解析(GWAS)
- ヒトゲノムの全域に分布する遺伝的変異と、臨床検査値などの量的な形質や病気との因果関係を網羅的に検討する遺伝統計解析手法。これまでに、数百を超える形質や病気を対象に実施され、数多くの関連遺伝的変異が同定されている。GWASはGenome-Wide Association Studyの略。
- [2] 臨床検査値
- 健康状態や病気の状況を把握する目的で、健康診断や医療現場で実施される医学検査結果の数値。代表的なものとして、採血による血液検査や生化学検査、生理機能検査が挙げられる。
- [3] バイオバンク・ジャパン
- 日本人集団27万人を対象とした生体試料バイオバンクで、ゲノム解析が終了した人数は約20万人とアジア最大である。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へのデータ提供や分譲を行っている。
- [4] エピゲノム情報
- ゲノム配列に施された後天的な修飾状況。ゲノム配列そのものを変化させずに、細胞や組織に応じて異なるエピゲノム修飾が行われている。本研究では、米国のRoadmap Epigenomics Projectで得られたエピゲノム情報を使用した。
- [5] オミクス解析
- ゲノム情報やエピゲノム情報など、生体内や細胞内の情報を網羅的に解析し、生命現象を調べる解析手段。
- [6] バセドウ病
- 外来性の病原体(非自己)から身体を守る免疫系が、誤って自分自身の正常な組織(自己)を攻撃して発症する、自己免疫疾患の一つ。身体の新陳代謝を維持する甲状腺ホルモンを産生する甲状腺の機能異常をもたらす。動悸(どうき)や体重減少、疲労、甲状腺腫大や眼球突出などの症状を伴う。
- [7] 制御性T細胞
- 免疫系の維持に関わる免疫細胞の一つ。免疫応答機構の過剰な反応を抑制する機能を有し、免疫応答に負の制御を与えることが知られている。
- [8] 感受性遺伝的変異
- 病気や臨床検査値など、ヒトの形質の個人差に影響を与える事象(=感受性)を持つ遺伝的変異。
- [9] 疫学調査
- 社会集団を対象に、健康状況や病気と環境要因との関わりの解明を目的に実施される調査。
- [10] 遺伝子発現制御領域
- ヒトゲノム配列上に存在し、遺伝子の発現を制御する機能を持つ領域。プロモーターやエンハンサーなど複数種類の制御領域が存在し、ヒトゲノムの全域に渡って数多く存在する一方で、細胞組織ごとに制御領域の場所が異なることが知られている。
発表者・機関窓口
発表者
※研究内容については発表者にお問い合わせ下さい
理化学研究所 統合生命医科学研究センター 統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
研修生 金井 仁弘 (かない まさひろ)
大阪大学大学院医学系研究科 遺伝統計学
教授 岡田 随象(おかだ ゆきのり)
機関窓口
理化学研究所 広報室 報道担当
大阪大学大学院医学系研究科 広報室
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
基盤研究事業部 バイオバンク課