未知の糖鎖分解酵素の同定への一歩
2019-07-11 理化学研究所
理化学研究所(理研)開拓研究本部鈴木糖鎖代謝生化学研究室の平山弘人研究員、鈴木匡主任研究員、岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員らの共同研究グループ※は、出芽酵母[1]の細胞内で起こる新たなO-結合型糖鎖の代謝経路を発見しました。
本研究により、これまでほとんど分かっていなかったO-結合型糖鎖の代謝機構の一端を、出芽酵母をモデル系として明らかにしました。今回発見したO-結合型糖鎖の代謝機構は、他の生物種ではまだ見つかっていない全く新しい糖鎖代謝機構です。今後、存在が予想されるエンドO-マンノシダーゼ[2]を単離できれば、O-結合型糖鎖の代謝機構の詳細が明らかになるだけでなく、O-結合型糖鎖をタンパク質から切り出す実験ツールとして利用されると期待できます。
タンパク質への糖鎖修飾は、主にタンパク質のアミノ酸残基のアスパラギンに結合するN-結合型糖鎖修飾と、セリンまたはトレオニンに結合するO-結合型糖鎖修飾の2種類が知られています。
今回、共同研究グループは、出芽酵母をさまざまな炭素源栄養条件下で培養したところ、マンノースを炭素源とした条件下で培養した際にのみ、O-結合型糖鎖由来の糖鎖がタンパク質から大量に切り出され、遊離される経路が活性化されることを見いだしました。これにより、出芽酵母の細胞内には未知の酵素エンドO-マンノシダーゼが存在し、タンパク質を修飾しているO-結合型糖鎖を切り出している可能性が示されました。
本研究は、米国の科学雑誌『Journal of Biological Chemistry』の掲載に先立ち、オンライン版に近日掲載予定です。
※共同研究グループ
理化学研究所 開拓研究本部
鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(すずき ただし)
研究員 平山 弘人(ひらやま ひろと)
特別研究員 黄 澄澄(ほあん ちぇんちぇん)
テクニカルスタッフⅠ 清野 淳一(せいの じゅんいち)
研究パートタイマー 松田 次代(まつだ つぎよ)
研究パートタイマー 岡 律子(おか りつこ)
研究パートタイマー 土屋 八恵(つちや やえ)
岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
訪問研究員 七野 悠一(しちの ゆういち)
東京大学大学院 農学生命科学研究科 応用生命工学専攻
特任准教授 野田 陽一(のだ よういち)
藤田医科大学 共同利用研究設備サポートセンター
講師 中嶋 和紀(なかじま かずき)
※研究支援
本研究は、水谷糖質科学振興財団、日本学術振興会(JSPS)科学研究費補助金基盤研究B(以上、研究代表者:鈴木匡)、地神芳文記念研究助成、野田産研研究助成、笹川科学研究助成、JSPS科学研究費補助金若手研究B(以上、研究代表者:平山弘人)による支援を受けて行われました。
背景
出芽酵母やヒトを含む多くの真核生物[3]のタンパク質は、ブドウ糖(グルコース)のような単糖が複数個連なることで形成された糖鎖による修飾を受けています。このタンパク質への糖鎖による修飾は、結合するタンパク質内のアミノ酸残基の違いにより、主にアスパラギンの側鎖アミドの窒素原子を介して結合するN-結合型糖鎖(Nは窒素を示す)と、セリンまたはトレオニンの側鎖ヒドロキシ基の酸素原子を介して結合するO-結合型糖鎖(Oは酸素を示す)の2種類が存在することが知られています(図1)。また糖鎖修飾は、タンパク質自体の機能や安定性の向上に寄与するだけでなく、合成されたタンパク質の品質管理、細胞内輸送、シグナル伝達などさまざまな生命現象に関わっていることが知られています(図1)。
これまでの研究により、N-およびO-結合型糖鎖の細胞内での生合成経路の詳細や、生物学的機能について多くのことが明らかになっています。しかし、糖鎖の分解、代謝機構については、不明な点が多くありました。そこで、鈴木糖鎖代謝生化学研究室では、N-結合型糖鎖の細胞質における代謝に関わる因子の同定および機能についての解析を行い、それらの詳細について明らかにしてきました注1-4)。
今回、共同研究グループは、出芽酵母をモデルとした実験系を利用して、培養液に含まれる炭素源の変化による糖鎖の代謝への影響について、遺伝学的なアプローチと生化学的なアプローチを組み合わせた方法で解析を試みました。
注1)2010年2月18日プレスリリース「異常糖タンパク質の分解モデルに新しい機構を発見」
注2)2011年7月19日プレスリリース「2型糖尿病に関わるグルコース輸送体「GLUT4」上の糖鎖の機能を解明」
注3)2016年2月16日プレスリリース「糖鎖の新しい代謝機構を解明」
注4)2017年4月22日プレスリリース「NGLY1欠損症の治療標的候補の発見」
研究手法と成果
共同研究グループは、さまざまな炭素源(グルコース、ガラクトース、マンノース、グリセロール等)のうち1種類だけ含む培養液で出芽酵母を培養し、それぞれの条件下で細胞が生成する遊離糖鎖の代謝量に違いがあるか調べました。その結果、炭素源について、通常の培養に用いられるグルコースと比較してガラクトースやグリセロールで培養した場合は、代謝量に若干の変化が見られたものの、大きな違いはありませんでした。しかし、マンノースで培養したときのみに、複数の構造未知の遊離糖鎖が大量に生成されることを見いだしました。
そこで、これらの遊離糖鎖の構造を詳しく解析したところ、マンノースと呼ばれる単糖が二つから五つまで連なった構造をしており、かつ出芽酵母のタンパク質を修飾しているO-結合型糖鎖と構造が一致することが分かりました。
この“O-結合型糖鎖と構造が一致する遊離糖鎖が溜まる“という現象は、タンパク質に結合している糖鎖から切り出されてできるほかに、細胞内に存在するばらばらのマンノースを基質として、糖タンパク質のO-結合型の生合成と同じ機構でマンノース糖鎖として伸びるという二つのうちのいずれかによって起こります。そこで、さまざまな出芽酵母の変異体を用いて実験を行ったところ、(1)O-マンノースの量が減る変異体では遊離O型糖鎖の量も減ること、また(2)マンノース誘導体と一緒に培養してもその化合物を基質としてマンノース糖鎖が延長しないことから、前者の可能性がより高いことが分かりました。
以上のことから、当該遊離糖鎖は、タンパク質を修飾しているO-結合型糖鎖から、出芽酵母の細胞内に存在する未知の酵素によって、タンパク質と結合している根元から切り出されて生成されている可能性が強く示されました(図2)。このような酵素は、全ての生物においてこれまで全く知られていなかったため、共同研究グループは「エンドO-マンノシダーゼ」と名付けました。
今回発見された遊離O型糖鎖の生成は、マンノースを炭素源とした培養条件でのみ観察されていることから、エンドO-マンノシダーゼをコードする未知の遺伝子の発現は、通常用いる炭素源であるグルコースからマンノースへ変化するときに活性化するのではないかと考えられます。
そこで、細胞の炭素源変化に伴い、遺伝子の転写を調節する転写調節因子[4]群の中に遊離O型糖鎖の生成に影響を与える因子があるか解析しました。その結果、Cyc8と呼ばれる転写抑制因子[4]を欠損させた酵母を、マンノースを炭素源とした条件下で培養すると、野生型と比較して約10倍以上の遊離O型糖鎖を生成し、強い生育阻害を示すとともに、細胞壁の恒常性を撹乱する薬剤に対して感受性が示されました。また、正常株とCyc8欠損株を比較したところ、正常株では転写抑制因子Cyc8依存的にエンドO-マンノシダーゼの遺伝子発現量を介して調節されている一方(図3左)、Cyc8を欠損させた酵母ではエンドO-マンノシダーゼの発現が抑制されることなく恒常的に活性化することにより細胞壁を構成する糖タンパク質から多くのO-結合型糖鎖が切り出されて細胞壁が脆弱となり、細胞壁の恒常性の低下および生育阻害を起こしている可能性が示されました(図3右)。
これらの結果から、出芽酵母の細胞内において、エンドO-マンノシダーゼによるO-結合型糖鎖の代謝機構は、炭素源変化によって誘導されることおよびO-結合型糖鎖の代謝は遺伝子の転写レベルで厳密に制御されていることが明らかになりました。
今後の期待
本研究により、これまでほとんど分かっていなかったO-結合型糖鎖の代謝機構の一端を、出芽酵母をモデル系として明らかにしました。今回発見したO-結合型糖鎖の代謝機構(エンドO-マンノシダーゼ)は、他の生物種ではまだ見つかっていない全く新しい糖鎖代謝機構です。
また、これまで全く報告がないエンドO-マンノシダーゼ活性を持つ酵素が出芽酵母に存在し、タンパク質を修飾しているO-結合型糖鎖を切り出していることが強く示唆されました。ヒトにおいて、O-マンノース糖鎖の合成不全は、さまざまな遺伝性筋ジストロフィー疾患を引き起こすことが知られています。
今後の解析により、エンドO-マンノシダーゼをコードする遺伝子が単離されれば、O-マンノース結合型糖鎖の代謝機構の詳細が明らかになるだけでなく、本酵素をコードする遺伝子からエンドO-マンノシダーゼタンパク質を大量に生産することで、O-マンノース結合型糖鎖をタンパク質から切り出す実験ツールとして利用でき、ヒトの病気に関わるO-マンノースの糖鎖構造解析への応用が期待できます。
原論文情報
Hiroto Hirayama, Tsugiyo Matsuda, Yae Tsuchiya, Ritsuko Oka, Junichi Seino, Chengcheng Huang, Kazuki Nakajima, Yoichi Noda, Yuichi Shichino, Shintaro Iwasaki, and Tadashi Suzuki, “Free glycans derived from O-mannosylated glycoproteins suggest the presence of an O-glycoprotein degradation pathway in yeast”, The Journal of Biological Chemistry
発表者
理化学研究所
主任研究員研究室 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(すずき ただし)
研究員 平山 弘人(ひらやま ひろと)
主任研究員研究室 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 出芽酵母
- 出芽によって増える酵母。パン酵母やビール酵母などが知られている。パン酵母は、細胞生物学や遺伝学実験のモデル生物として広く使われている。
-
- エンドO-マンノシダーゼ
- O-マンノース糖鎖を結合しているタンパク質の根元から遊離する酵素。糖鎖の末端から2糖以上の糖を遊離する酵素をエンドグリコシダーゼと呼ぶことから、今回存在が予想される全く新規の酵素を、O-マンノース糖鎖を遊離するエンド酵素という意味でこのように命名した。
-
- 真核生物
- 動物、植物、菌類、原生生物など核膜で囲まれた細胞核を持しその中に遺伝情報を有した染色体を持つ生物。
-
- 転写調節因子、転写抑制因子
- 遺伝子の発現(転写)を調節する因子のことで、タンパク質あるいはそれをコードする遺伝子を指す。通常DNAに結合し、遺伝子の発現を活性化あるいは抑制する。遺伝子の発現を活性化するものを転写活性化因子、抑制するものを転写抑制因子と呼ぶ。
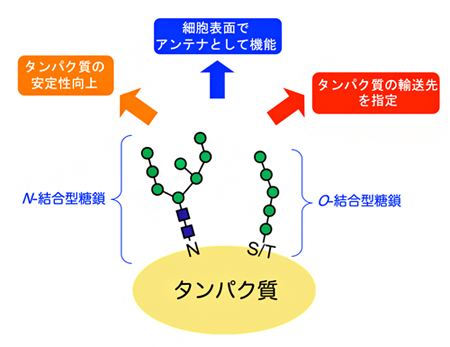
図1 タンパク質を修飾する糖鎖の種類と機能
真核生物におけるタンパク質への糖鎖修飾には、タンパク質のアスパラギン(N)の窒素原子を介して結合するN-結合型糖鎖(Nは窒素)と、セリン(S)トレオニン(T)の酸素原子を介して結合するO-結合型糖鎖(Oは酸素)がある。これらの糖鎖修飾はタンパク質自体の安定性向上などに関わるだけでなく、タンパク質が細胞内で輸送される際の荷札(タグ)として機能し、行き先を指定したり(タンパク質の輸送先を指定)、細胞表面でアンテナのように細胞外からのシグナルを受け取ったりする機能を持つ。
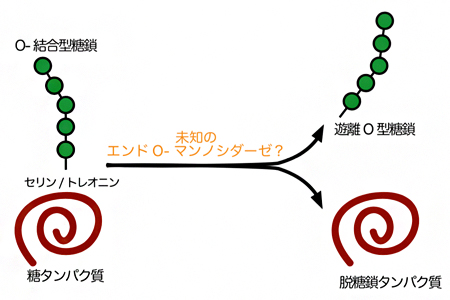
図2 未知のエンドO-マンノシダーゼによるタンパク質からのO-結合型糖鎖の脱離反応
マンノースを炭素源とした出芽酵素の培養条件下では、未知のエンドO-マンノシダーゼが糖タンパク質上のO-結合型糖鎖を切り出し、遊離O型糖鎖が生成される。
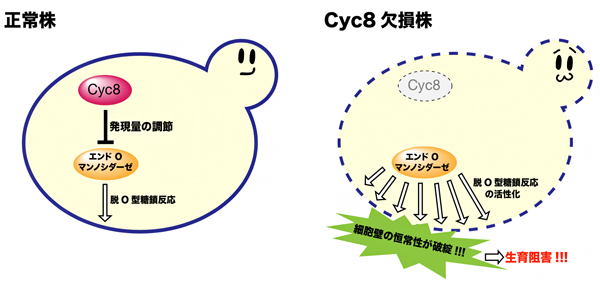
図3 転写抑制因子Cyc8によるエンドO-マンノシダーゼの活性制御
左: マンノースを炭素源とした培養条件下での遊離O型糖鎖の生成は、転写抑制因子Cyc8によりエンドO-マンノシダーゼの遺伝子発現量を介して調節されている。
右: Cyc8欠損株では、エンドO-マンノシダーゼの発現が抑制されることなく、恒常的に活性化するために、細胞壁を構成する糖タンパク質から多くのO-結合型糖鎖が切り出され細胞壁が脆弱になる。その結果、Cyc8欠損株はマンノース炭素源培養条件下では、細胞壁の恒常性が破綻し生育阻害を起こす。