2021-10-02 生命創成探究センター,基礎生物学研究所,東京大学
【発表のポイント】
◆細胞の「口」である、マクロピノサイトーシス(飲作用)におけるカップ状の細胞膜変形とその閉包の基本形を数理モデルにより記述し、シミュレーションにはじめて成功した。
◆カップ形成とその閉包は、反応拡散ダイナミクスによるパターン形成から説明できることが明らかになった。
◆マクロピノサイトーシスが果たす多様な機能(ウイルスの侵入、抗原の取り込み、がん細胞の増殖)とその疾患の理解や操作につながることが期待される。
【発表概要】
自然科学研究機構生命創成探究センター/基礎生物学研究所の斉藤稔特任准教授(研究開始時:東京大学生物普遍性機構)と東京大学大学院総合文化研究科の澤井哲教授の共同研究チームは、マクロピノサイトーシス過程における細胞膜変形の力学と、細胞膜上のシグナル分子の反応や拡散を数理的に記述することで、これまで全くの謎に包まれていたカップ変形と閉包のシミュレーションにはじめて成功しました。またその結果、この過程は飲作用だけでなく、粒子を無作為に取り込むという、従来の理解とは異なったファゴサイトーシス様式があることを示しました。
本研究成果は、2021年10月1日(日本時間10月2日)にiScience誌に掲載される予定です。
【研究の背景】
細胞は、細胞膜を変形・陥入させることで細胞外部の物質や溶液を取り込むことができます。このような細胞膜陥入による物質の取り込みをエンドサイトーシスと呼びます。エンドサイトーシスのうち、「食べる」に因んだプロセスはファゴサイトーシス(食作用)と呼ばれ(図1左)、免疫細胞が死んだ細胞やバクテリアなどを取り込み分解する過程などで重要となります。この「食べる」プロセスについては理論的な研究も進み、メカニズムも理解されてきました。例えばバクテリアなど比較的大きな細胞外粒子を免疫細胞がとりこむ場合は、粒子を抗体等で他者として標識し、これに結合した細胞膜が伸張することで、最終的に粒子全体を細胞が包み込みます。すなわち粒子そのものを明確な標識を持つ足場として、粒子全体に沿って膜をのばして包み込みながら「口」を作ります(図1左)。
一方、「飲む」プロセスはピノサイトーシス(飲作用)と呼ばれ、免疫細胞の抗原のとりこみや癌細胞を含む増殖細胞による栄養の取り込みなど、外来因子の無作為な取り込みに関わっています。このためウイルスの侵入ルートにも挙げられています。このうち近年理解が進んできたものがマイクロメートルスケールの大きいサイズのもの(マクロピノサイトーシス)です。ここでは、細胞膜が円環状に突出して、カップ状の構造を形成し、そのカップの「口」がすぼまって閉じることで、外部溶液を飲み込みます(図1右)。この場合、包むべき物体なしでカップ状の「口」を作り、液体を包み込まなくてはなりません。関連分子の同定が進む一方で、どのように膜伸長を制御したらこの細胞膜の大変形が可能になるのか、これまで全く理解されてきませんでした。
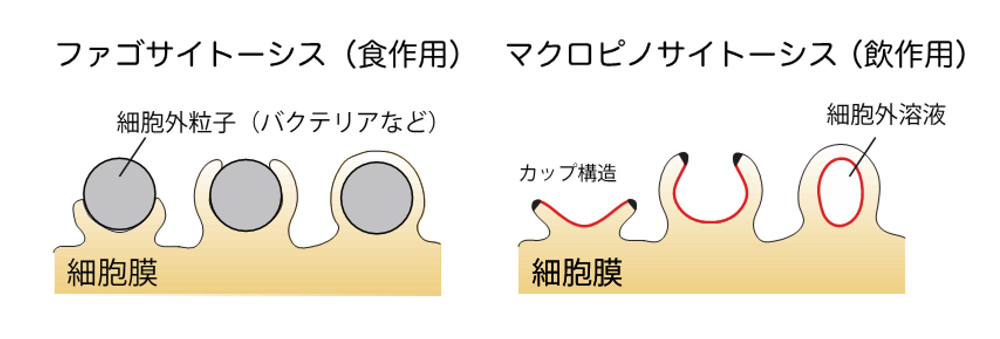
図1:ファゴサイトーシス(左)とマクロピノサイトーシス (右)
【研究の内容】
まず、マクロピノサイトーシスの過程で細胞膜上に局在するシグナル因子(PIP3, Rasなど)の働きに注目し、細胞膜上の反応拡散方程式(注1)としてモデル化しました。この反応拡散方程式は細胞膜上に一定サイズのパッチ状のパターンを誘起します。次に三次元のフェイズフィールド法(注2)という計算手法により変形する細胞膜を記述し、先の反応拡散方程式と組み合わせることで、カップ状の膜突起構造が自発的に形成され、カップが閉じて細胞外溶液が取り込まれる様子をシミュレーションすることを可能にしました(図2A)。驚くべきことに一見複雑なこの現象は、(1)シグナル分子が一定サイズのパッチ状局在パターンを作ること、(2)そのパッチの縁でのみ細胞膜が伸びること、の二つを仮定するだけで説明できることがわかりました。効率の良い取り込みには、アクチン重合による細胞膜を押す力と張力の比、およびパッチ状のサイズが十分大きいことが重要であり、弱い重合力や小さいパッチの場合にはカップが閉じることができないことを示しました(図2B)。さらに、このモデルは、複数のカップの共存やカップの分裂(図2C)など、既知のさまざまなマクロピノサイトーシスを記述できることがわかりました。
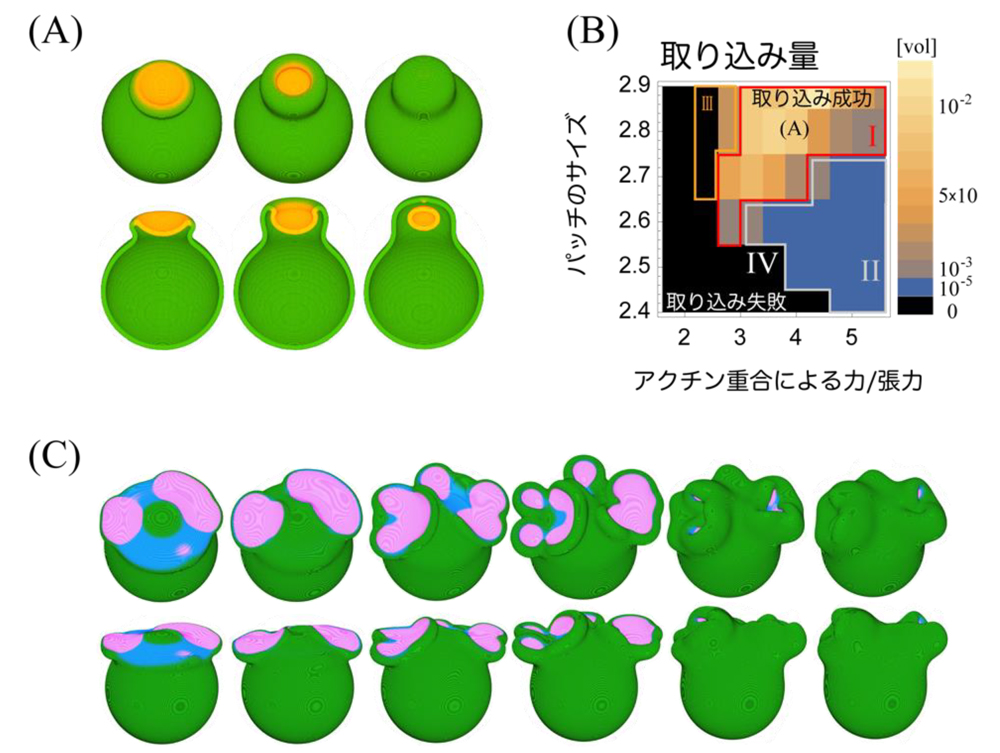 図2:数理モデルによるマクロピノサイトーシスのシミュレーション。(A)細胞膜がカップ状に突出し閉包することで外部溶液が取り込まれる3次元シミュレーション。(B)取り込み量のパラメータ依存性。(C)カップが分裂するシミュレーション。
図2:数理モデルによるマクロピノサイトーシスのシミュレーション。(A)細胞膜がカップ状に突出し閉包することで外部溶液が取り込まれる3次元シミュレーション。(B)取り込み量のパラメータ依存性。(C)カップが分裂するシミュレーション。
【今後の展望・この研究の社会的意義】
組織中の多細胞ダイナミクスに関連する細胞形態運動モードとして、マクロピノサイトーシスは癌細胞の成長、免疫監視、細胞遊走、ウイルスの侵入など、様々な場面で重要な役割を果たしています。数理モデルの確立は、これらの病理病変の理解や制御に貢献すると期待されます。また、開発した数理モデルは様々な細胞の3次元的な変形を記述することが可能です。例えば免疫細胞で現れる3次元的な細胞膜のラメラ構造や、癌細胞浸潤の過程のシミュレーションなどの展開も考えられます。
【用語解説】
(注1)反応拡散方程式
空間中に分布している分子の拡散過程と化学反応を数理的に表現した偏微分方程式。
(注2)フェイズフィールド法
結晶成長や相分離現象を記述する数値計算手法として発展してきた手法。近年では細胞運動の記述にも応用されている。
【論文情報】
掲載誌: iScience
論文タイトル: Three-dimensional morphodynamics simulations of macropinocytic cups
著者: Nen Saito, Satoshi Sawai
DOI:10.1016/j.isci.2021.103087
【プロジェクトについて】
この研究はCREST 【細胞動態スペクトラムから紐解く多細胞秩序の創発規則】(代表:澤井哲 CREST JPMJCR1923)、ExCELLS連携研究(20-102、21-102)の支援を受けています。
【お問い合わせ】
(研究に関すること)
自然科学研究機構 生命創成探究センター/基礎生物学研究所
特任准教授 斉藤 稔
(報道に関すること)
自然科学研究機構 生命創成探究センター 研究連携推進室
自然科学研究機構 基礎生物学研究所 広報室