2019-09-26 東京大学,名古屋工業大学,名古屋大学,生命創成探求センター,科学技術振興機構
ポイント
- 既知のロドプシンとはアミノ酸配列が大きく異なる、新規光情報伝達分子であるヘリオロドプシンの立体構造を決定しました。立体構造から、アミノ酸配列が異なるにもかかわらず両者の基本的な構造は実は同じであることを発見しました。しかしながら、細胞生化学解析の結果と合わせて、ヘリオロドプシンは通常のロドプシンとは膜内での配向が逆転した構造を持つことが明らかになりました。
- ヘリオロドプシンの細胞外側部分は疎水的なアミノ酸で塞がっており、イオンなどを通すことはできないと考えられました。一方、レチナールの上には横穴が空いており、レチナールの効率的な取り込みに重要であることが明らかになりました。
- 本研究は、ヘリオロドプシンの生理的な役割の今後の解析に役立つとともに、アミノ酸配列に縛られない「ロドプシンの多様性」への理解を深めるものです。
光応答性タンパク質であるロドプシン注1)は、細菌からヒトに至るまで多くの生物が持っており、さまざまな機能を有しています。2018年に発見されたヘリオロドプシンはこうした既存のロドプシンとはアミノ酸配列が大きく異なり、さらに膜内での配向が逆転しており、光情報伝達を担っていると推測されています。今回、東京大学 大学院理学系研究科の志甫谷 渉 日本学術振興会特別研究員、濡木 理 教授および名古屋工業大学 神取 秀樹 教授らの研究グループは、X線結晶構造解析を用いてヘリオロドプシンの立体構造を決定しました。結晶構造から、ヘリオロドプシンは異なるアミノ酸の組み合わせによって、バクテリオロドプシンと同様の光による構造変化を可能としていることを明らかにしました。本研究成果は、ヘリオロドプシンの構造機能を明らかにするとともに、ロドプシンの多様性や新規ロドプシンの探索に役立つと考えられます。
本研究成果は、2019年9月25日(英国夏時間)に英国科学誌「Nature」のオンライン版で掲載されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)研究領域「光の特性を活用した生命機能の時空間制御技術の開発と応用」(研究総括:影山 龍一郎)研究課題「細胞内二次メッセンジャーの光操作開発と応用」(研究代表者:神取 秀樹)の一環として行われました。
<研究背景>
ロドプシンはヒトの目の中で視覚を担う膜タンパク質の1つで、光を認識し、視神経へ信号を伝えるための初期反応を担っています。タンパク質内部に結合したビタミンAの誘導体色素レチナール注2)が光によって構造変化しタンパク質の構造を動かすことで、情報伝達分子である三量体Gタンパク質注3)を活性化します。細菌などの微生物にもロドプシンは存在し、それらの多くは光によってイオンを細胞内外に輸送します。そうした微生物ロドプシンを動物の脳神経細胞に発現させ、神経興奮や抑制を光で制御することによって動物の行動を操作するオプトジェネティクス(光遺伝学)注4)という技術が近年新たに開発され、ロドプシンファミリーは基礎・応用両面から注目されています。
2018年に、今までのロドプシンとはアミノ酸配列が大きく異なるヘリオロドプシンが発見されました(図1)。ヘリオロドプシンは古細菌や真正細菌のほか、藻類などの真核生物や巨大ウイルスから500種類以上発見されており、第3のロドプシンというべき存在です。ヘリオロドプシンは代表的な微生物ロドプシンであるバクテリオロドプシン注5)と同様にレチナール色素を持ちますが、微生物由来のロドプシンに特徴的なイオンを輸送する性質はありません。さらに光反応サイクルが遅いことから、ヘリオロドプシンは三量体Gタンパク質のような未知の情報変換分子を介した光情報伝達に関わるものと推測されています。
ヘリオロドプシンは微生物由来のロドプシンと同様に7回膜貫通構造を持つと予測されていますが、膜に対しての向きが逆転していると予測されており、本当に同じ立体構造なのか、新規な構造をとっているのか、まったくの謎でした。さらにヘリオロドプシンを持つ生物種の多くはレチナール生合成系を持っておらず、環境中に存在するレチナールを取り込んで機能すると推測されましたが、その機構は不明でした。
<研究内容>
本成果は神取グループから遺伝子の提供を受けて、東京大学の濡木グループが構造解析に取り組んだ結果、好酸菌由来のヘリオロドプシンのX線結晶構造解析注6)に成功しました。その後、生物物理学的解析の専門家である古谷准教授や内橋教授と共同研究を行い、ヘリオロドプシンの構造と機能の相関について詳細に解明しました。
ヘリオロドプシンの膜貫通領域の構造はバクテリオロドプシンと似ており、配列相同性が低いにもかかわらず両者が共通した構造であることが明らかになりました(図2)。さらに、バクテリオロドプシンとよく似た形でレチナールがリジンに共有結合していたことが分かりました。一方、細胞外ループは伸びたシート構造をとっており、結晶構造中では隣の分子の上を覆うことで密な二量体を結晶構造中で形成していました。高速原子間力顕微鏡(AFM)観察注7)によって、この二量体が脂質二重膜中の生理的な条件でも保たれていることを確認し、ヘリオロドプシンは基本的に二量体として機能することを明らかにしました(図3)。
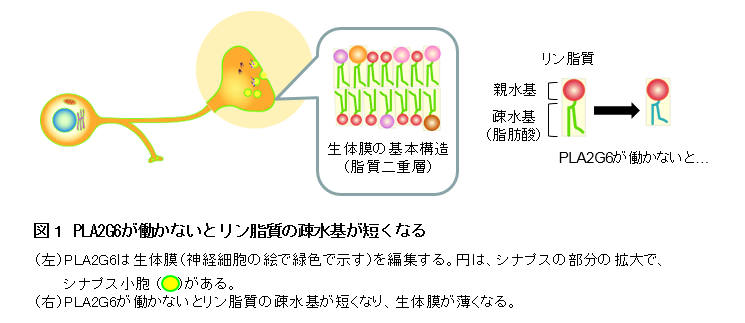
さらに細胞に発現させたヘリオロドプシンのN末端、C末端に異なる蛍光タグを付けることで、1細胞のイメージングを行い、確かにヘリオロドプシンは通常のロドプシンと逆の膜トポロジーを持つことを明らかにしました(図1)。
ヘリオロドプシンの細胞外側は疎水的なアミノ酸残基で塞がっており、イオンや基質が通る隙間はありませんでした(図4)。こうしたアミノ酸残基はヘリオロドプシンの間で保存性が高く、全てのヘリオロドプシンは微生物ロドプシンのような輸送体としては機能できないと推測されました。一方、細胞内側はレチナールから細胞内ループにわたって、水分子を介した広範な親水性相互作用が存在しており、光受容に伴うヘリオロドプシンの構造変化に重要であると考えられました。また時間分解赤外分光解析により、長寿命のO中間体における特徴的な構造変化が1秒間以上、持続することも明らかにしました。
ヘリオロドプシンの構造では、レチナールの上に今までのロドプシンにはみられない、大きな横穴がありました(図5)。この穴を塞ぐようにヘリオロドプシンを変異させると、レチナールの再構成効率が大きく低下しました。したがって、この横穴はヘリオロドプシンが環境中からレチナールを効率的に取り込むために重要だと考えられました。
<研究の意義>
本研究は、ヘリオロドプシンの立体構造を決定しました。ヘリオロドプシンはバクテリオロドプシンとはアミノ酸配列が大きく異なり、さらに膜に対する向きでさえ反転しているにもかかわらず、構造やレチナールの結合様式に多くの類似性がありました。しかし、イオン輸送能がないことから、ヘリオロドプシンが関与する新規の光シグナル伝達システムが存在する可能性が高く、今後の研究が期待されます。また、こうした類似性は、「ロドプシン」というものが配列の縛りに囚われずに環境中にたくさん存在する可能性を示しています。今後本構造情報を活用した配列解析によって、さらなる新型ロドプシンの発見が期待されます。
<参考図>
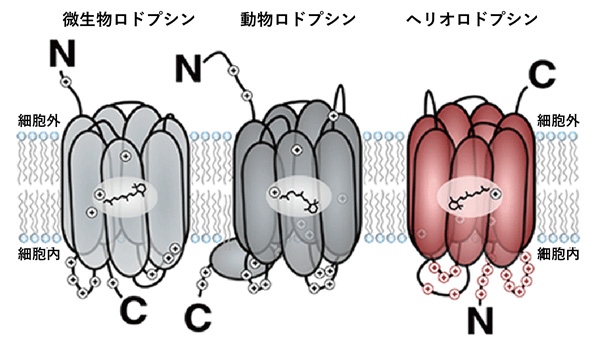
図1 微生物ロドプシン(左)、動物ロドプシン(中)とヘリオロドプシン(右)
微生物ロドプシン、動物ロドプシンがN末端側を細胞外側に向けているのに対して、ヘリオロドプシンはN末端側を細胞内に向けているという特徴がある。
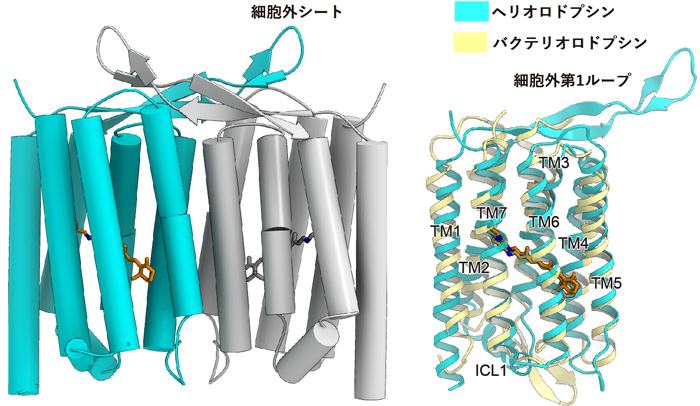
図2 ヘリオロドプシンの全体構造
左は結晶中での二量体構造。右図はバクテリオロドプシンの構造との重ね合わせ。
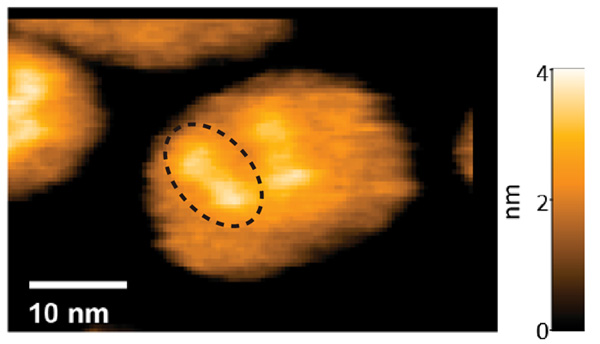
図3 高速AFMを用いた脂質膜内でのヘリオロドプシンの観察
脂質中に埋め込んだヘリオロドプシンの高速AFMでの観察像。結晶構造と同様な二量体が観察できる。
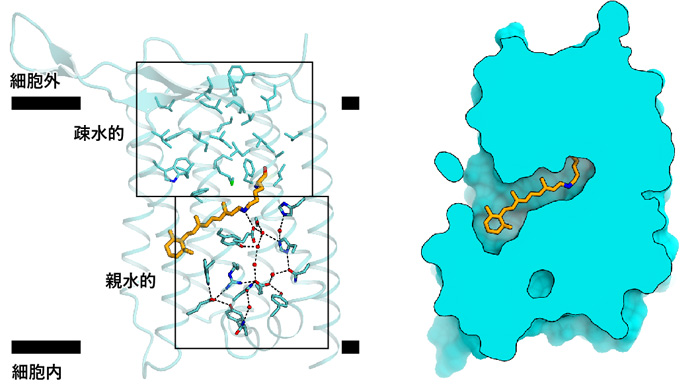
図4 ヘリオロドプシンの分子内相互作用
左図は分子の内側を向いているアミノ酸を一覧で示している。右図は空間充填モデルの切断面であり、細胞内外に閉じていることがわかる。
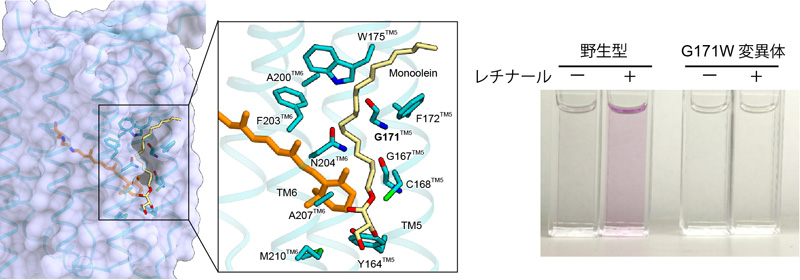
図5 予想外に発見されたヘリオロドプシンの横穴
レチナールのイオノン環の上部に、大きな穴が空いている。これは、直上にあるアミノ酸残基が側鎖のないグリシンになっているためである。精製したヘリオロドプシンのレチナールをヒドロキシルアミンを用いて解離させ、その後レチナールを再構成する実験を試みた結果、横穴を塞ぐ変異体G171Wではレチナールは全く再構成されなかった。
<用語解説>
- 注1)ロドプシン
- 補因子としてレチナールを結合した7回膜貫通タンパク質。一次構造の違いにより微生物ロドプシン、動物ロドプシンに分類される。微生物ロドプシンは真核生物、真正細菌、古細菌より発見されており、光に応じてイオンを運ぶものやシグナルを細胞内に伝えるなど、さまざまな機能を持つロドプシンが存在する。
- 注2)レチナール
- 光を吸収することで、物質に色を付けられる官能基のことを発色団と呼ぶ。ロドプシンでは、レチナールと呼ばれるビタミンAの誘導体が発色団として働いている。多くの生物において、この発色団であるレチナールはロドプシンタンパク質のリジン残基と結合して存在している。光を吸収すると構造を変化させることによって、視覚を始めさまざまな現象に関与する。
- 注3)三量体Gタンパク質
- 細胞内情報伝達に関わるGTP結合タンパク質であり、ロドプシンのような7回膜貫通ヘリックス構造を持つ受容体タンパク質により活性化される。GTP結合タンパク質共役型受容体(GPCR)として総称される受容体は視覚などの感覚だけでなく、神経伝達物質やホルモンなどの情報伝達に関わり、創薬の重要なターゲットである。
- 注4)オプトジェネティクス(光遺伝学)
- 光学(optics)と遺伝学(genentics)を合わせた造語であり、創始者のDeisseroth博士により名付けられた。2005年に行われた最初の実験では、微生物由来のチャネルロドプシンを神経細胞に発現させ、光で神経を興奮させることにより動物の行動を制御した。脳機能解明のための新手法として期待されている。オプトジェネティクスの語は現在では光で生物の活動を制御・操作する手法に対して広く使われる。
- 注5)バクテリオロドプシン
- 代表的な微生物ロドプシン。高度好塩菌の細胞膜に存在する膜タンパク質で、発色団レチナールを持つため紫色をしている。光駆動プロトンポンプとしてエネルギー変換機能を担う。初めて立体構造が解明された膜タンパク質の1つ。
- 注6)X線結晶構造解析
- タンパク質が規則正しく並んだ結晶にX線を照射すると回折像が得られる。その回折像を解析することにより、タンパク質の構造を解明する実験手法。タンパク質を構成する個々の原子の位置を決定できる。
- 注7)高速原子間力顕微鏡(AFM)
- 柔らかい板バネの先に付いた針の先端で試料に触れ、試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより、試料の表面形状を可視化する。試料の表面を高速(最速16フレーム/秒)にスキャンすることにより試料の動きを可視化することができる。
<論文タイトル>
- “Crystal Structure of Heliorhodopsin”
著者名:志甫谷 渉,井上 圭, Manish Singh,今野 雅恵,細島 頌子,山下 恵太朗,池田 健人,樋口 晶光,岡崎 早恵,井爪 珠希,橋本 真典,水鳥 律,富田 紗穂子,山内 夢叶,吉住 玲,片山 耕大,角田 聡,柴田 幹大,古谷 祐詞,Alina Pushkarev,Oded Béjà,内橋 貴之,神取 秀樹,濡木 理 - DOI:10.1038/s41586-019-1604-6
- アブストラクトURL:https://www.nature.com/articles/s41586-019-1604-6
<お問い合わせ先>
<研究に関すること>
濡木 理(ヌレキ オサム)
東京大学 大学院理学系研究科 生物科学専攻 教授
神取 秀樹(カンドリ ヒデキ)
名古屋工業大学 オプトバイオテクノロジー研究センター 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
武田 加奈子(タケダ カナコ) 特任専門職員
大越 慎一(オオコシ シンイチ) 教授・広報室長
東京大学 大学院理学系研究科・理学部
名古屋工業大学 企画広報課
名古屋大学 総務部 総務課 広報室
東京大学 物性研究所 広報室
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
自然科学研究機構 生命創成探究センター 広報担当
科学技術振興機構 広報課