2018-02-22 理化学研究所,九州大学
要旨
理化学研究所(理研)袖岡有機合成化学研究室の平井剛客員研究員(九州大学大学院薬学研究院教授)、太田英介特別研究員(研究当時)、袖岡幹子主任研究員(環境資源科学研究センター グループディレクター)らの共同研究グループ※は、薬剤(生物活性分子)の結合タンパク質[1]同定手法の一つである「光親和性標識法」に利用可能な新たな分子ツールとして、2-チエニル置換型α-ケトアミド構造[2]を開発しました。
光親和性標識法は、生物活性分子の結合タンパク質同定に用いられるケミカルバイオロジー研究には欠かせない手法の一つです。この手法では、光によって結合タンパク質と共有結合を形成する「光反応性基」を用います。従来の光反応性基は十分な反応性を発揮させるために、疎水性で嵩(かさ)高い構造が必要でした。そのため、真の結合タンパク質以外のタンパク質とも非特異的に相互作用し、共有結合を形成するという欠点がありました。しかし、この欠点を克服した新たな光反応性基の開発はほとんど行われてきませんでした。
今回、共同研究グループは、α-ケトアミド構造が光反応性基として機能すると考え、α-ケトアミド構造を生物活性分子としてマンノース構造に連結した分子ツールを作製し、タンパク質のコンカナバリンA[3]との光親和性標識実験を行いました。その結果、チエニル基[4]を持つα-ケトアミド(2-チエニル置換型α-ケトアミド構造)が良好な反応性を示し、光反応性基として十分機能することを見いだしました。この新しい光反応性基は、従来のものよりも疎水性が低くコンパクトで、非特異的な結合が著しく抑制できることが分かりました。
本成果は生理活性天然物や薬剤だけでなく、ペプチド、タンパク質、糖鎖、核酸、脂質など幅広い分子群と結合タンパク質の相互作用の解析に利用可能な分子ツールとして有望と考えられます。また、チエニル基の効果をさらに研究することで、今後、より機能性の高い光反応性基の開発につながると期待できます。
本研究は、米国の科学雑誌『ACS Chemical Biology』オンライン版(2月19日付け)に掲載されました。
※共同研究グループ
理化学研究所
袖岡有機合成化学研究室
客員研究員 平井 剛 (ひらい ごう)
(環境資源科学研究センター 触媒・融合研究グループ 客員研究員、九州大学大学院 薬学研究院 創薬科学部門 教授、研究当時 専任研究員)
特別研究員(研究当時) 太田 英介(おおた えいすけ)
主任研究員 袖岡 幹子(そでおか みきこ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
環境資源科学研究センター
触媒・融合研究グループ
テクニカルスタッフII 大沼 可奈(おおぬま かな)
技術基盤部門 分子構造解析ユニット
ユニットリーダー 越野 広雪(こしの ひろゆき)
九州大学大学院 薬学研究院 創薬科学部門
助教 臼井 一晃(うすい かずてる)
慶應義塾大学 理工学部
名誉教授 西山 繁 (にしやま しげる)
背景
光親和性標識法は、タンパク質などの生体分子と生物活性分子の相互作用解析に以前から利用されている手法です。現在では、薬剤(生理活性分子)の結合タンパク質の同定などを行うケミカルバイオロジー研究には欠かせない手法の一つになっています。薬剤が相互作用するタンパク質を同定するためには、標的ではないタンパク質がたくさん存在する状況で、結合タンパク質だけを見つける必要があります。薬剤と結合タンパク質との相互作用は可逆的で捉えにくいため、光親和性標識法がよく用いられます。
薬剤候補の生物活性分子が細胞内で結合するタンパク質を同定する場合、生物活性分子に「光反応性基」を連結した光親和性標識法用の分子ツールを準備します。分子ツールと細胞の抽出液を混合し、生物活性分子と結合タンパク質を相互作用させ光(紫外線)を照射します。すると、光反応性基が光励起[5]され、反応性活性種に変換されることで、近くにある「生物活性分子の結合タンパク質」のアミノ酸残基と共有結合を形成します(図1)。この共有結合した相手を解析することで、結合タンパク質を同定することが可能です。光反応性基は相手を選ばず、さまざまなアミノ酸残基と連結できるという特徴があります。
これまで、光反応性基としてフェニルアジド、ジアジリン類、ベンゾフェノンなどが用いられてきました(図2)。フェニルアジドやジアジリン類は、光照射によって反応性活性種が不可逆的に発生し、これがタンパク質のアミノ酸残基と反応し共有結合します。ただし、近くにアミノ酸残基が存在しない場合は、水などと反応し活性を失います。一方、ベンゾフェノンは光励起された後、同様に近くのアミノ酸残基と反応しますが、もし反応できなかった場合でも、元のベンゾフェノンに戻る性質があるため、繰り返し光で励起することが可能です。
しかし、いずれの光反応性基も、その反応性を発揮するために比較的疎水性で嵩(かさ)高い構造を持つため、非特異的にさまざまなタンパク質と相互作用し、共有結合を形成してしまいます。場合によっては、真の結合タンパク質が、非特異的に結合した多くのタンパク質に埋もれて、解析を難しくすることもあります。しかし、これらの欠点を克服した新しい光反応性基の開発はほとんど行われてきませんでした。
研究手法と成果
共同研究グループは、ベンゾフェノンのように繰り返し光で励起することが可能でありながら、従来よりも疎水性が低く、コンパクトな光反応性基の開発を目指しました。そこで、タンパク質に損傷を与えない350 ナノメートル(nm、1nmは10億分の1メートル)以上の波長の紫外線で繰り返し励起でき、かつ比較的コンパクトな官能基として、1,2-ジカルボニル構造に着目しました。
しかし、カルボニル基は求電子性[6]が高く、水や求核性[6]アミノ酸と容易に反応し、光励起されない水和体やヘミアセタールを形成する可能性が考えられました。そこで1,2-ジカルボニル構造の中で最も求電子性が低いα-ケトアミド構造が光反応性基に適用できるかを検討しました。これまでの研究結果からは、α-ケトアミド構造は容易に光分解し、光反応性基として不向きだと予想されましたが、α-ケトアミド構造のケト基を変えれば分解が抑えられ、光反応性基として利用できるのではないかと考えました。
そこで、水中での水和体形成と光分解速度を評価するために、α-ケトアミド構造を水溶性の高いマンノース(単糖の一種)構造と連結した分子ツールを合成し反応性を検討しました。その結果、分子ツールの中で、チエニル基を持つα-ケトアミド分子(2-チエニル置換型α-ケトアミド)は水和体を形成せず、光分解速度も他の置換基を持つ分子ツールよりも著しく遅いことを見いだしました。このことから、2-チエニル置換型α-ケトアミドは求電子性が低く、光安定性も十分に高いことが分かりました。
また、マンノース構造を認識するタンパク質のコンカナバリンAとの光親和性標識実験を検討すると、チエニル置換型分子ツールは他の分子ツールよりも標識効率が優れていることを見いだしました。これは、α-ケトアミド構造が光反応性基として利用できることを初めて示した重要な知見となります。
さらに、従来利用されてきた芳香族アジド、芳香族ジアジリン、ベンゾフェノンを同じマンノース構造と連結した分子ツールを調整し、その特性を比較しました。その結果、標識効率だけでなく、他のタンパク質が共存した際の標識選択性も、2-チエニル置換型α-ケトアミドが、最も優れていることを見いだしました(図3)。マンノース-コンカナバリンAの相互作用は、解離定数[7]10-3M程度でありながら、2-チエニル置換型α-ケトアミドが高い選択性でコンカナバリンAを標識している事実は、今回開発した光反応性基の有効性を示しています。
今後の期待
今回開発した光反応性基は、従来のものと比べて疎水性が低くコンパクトなため、生物活性物質の天然物や薬剤だけでなく、ペプチド、タンパク質、糖鎖、核酸、脂質など、幅広い分子群と結合タンパク質の相互作用解析に利用可能な分子ツールとして有望と考えられます。
また、チエニル基の効果をさらに研究することで、今後、より機能性の高い光反応性基の開発につながると期待できます。
原論文情報
- Ota, Eisuke; Usui, Kazuteru; Oonuma, Kana; Koshino, Hiroyuki; Nishiyama, Shigeru; Hirai, Go; Sodeoka, Mikiko, “Thienyl-substituted α-Ketoamide: A Less Hydrophobic Reactive Group for Photo-Affinity Labeling”, ACS Chemical Biology, doi: 10.1021/acschembio.7b00988
発表者
理化学研究所
主任研究員研究室 袖岡有機合成化学研究室
客員研究員 平井 剛 (ひらい ごう)
(環境資源科学研究センター 触媒・融合研究グループ 客員研究員、九州大学大学院 薬学研究院 創薬科学部門 教授)
主任研究員 袖岡 幹子
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
報道担当
理化学研究所 広報室 報道担当
九州大学広報室
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 結合タンパク質
- 薬や毒など、生体に何らかの影響を与える分子がその機能を発揮するために生体内で相互作用するタンパク質のこと。
-
- α-ケトアミド構造
- アミドのカルボニル基側に、もう一つカルボニル基(ケト基)を持つ構造のこと。
-
- コンカナバリンA
- 糖構造に結合できるタンパク質(レクチン)の1種。マンノースとグルコース構造に結合する。
-
- チエニル基
- チオフェンが置換基となっていることを指す言葉。
-
- 光励起
- 分子にある特定の波長の光が照射されたとき、分子中の電子状態が変化して高エネルギー状態(反応性の高い状態、励起状態)になること。
-
- 求電子性、求核性
- 化学反応は、電子を受け入れやすい分子と、電子を与えやすい分子の間で起こることが多い。電子を受け入れる性質を求電子性、電子を与える性質を求核性という。
-
- 解離定数
- タンパク質に結合した分子(リガンド)が、タンパク質から離れるときに、どの程度離れやすいかを示す(平衡)定数のこと。濃度の単位(M、モーラー)で示され、数字が小さい時に、リガンドがタンパク質から離れにくい、すなわちリガンドがタンパク質と強固に結合することを意味する。一般的に、nM単位(10-9~10-7M)の解離定数の場合、そのリガンドはタンパク質と強固に結合すると認識される。
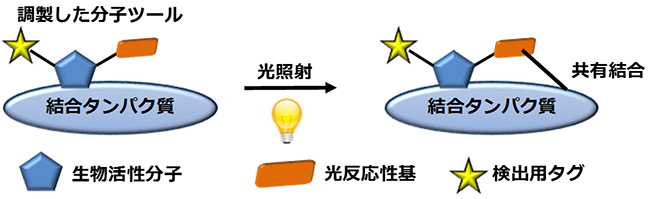
図1 光親和性標識法の概略図
生物活性分子の結合タンパク質同定法の一つである光親和性標識法では、通常、薬剤候補の生物活性分子に「光反応性基」と検出用のタグ(蛍光性官能基やビオチンなど)を連結した分子ツールを準備する。これと細胞の抽出液を混合し、光を照射すると光反応性基とその近くにあるタンパク質との間で共有結合が形成される。これによって、同定したいタンパク質が検出用タグと連結されることになる。
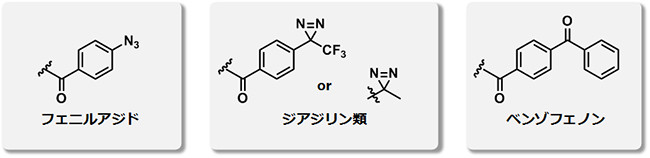
図2 代表的な光反応性基
従来の光親和性標識実験では、光反応性基としてフェニルアジド、ジアジリン類、ベンゾフェノンが用いられてきた。
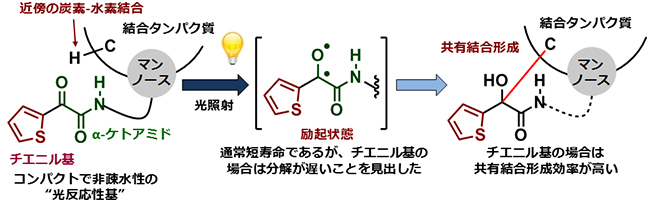
図3 新たに開発した光反応性基:チエニル基置換型α-ケトアミド
α-ケトアミド構造(緑)を光反応性基として利用できるかを検討した。マンノース(単糖の一種)にα-ケトアミドを連結した分子ツールを調製し、求電子性、光反応性、光親和性標識効率、標識選択性を評価したところ、2-チエニル基置換型α-ケトアミドが良好な反応性を示すことが分かった