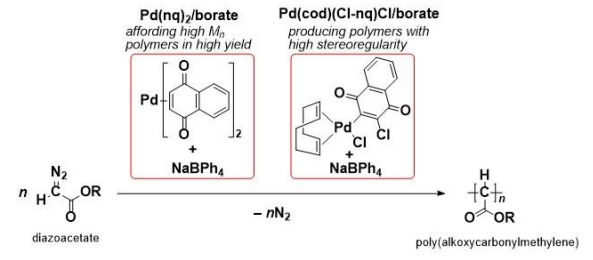
2019-10-15 愛媛大学
【ポイント】
・ E3 リガーゼ MIB2 が脱ユビキチン化酵素 CYLD を分解することにより、炎症を促進することを見出した。
・ CYLD 遺伝子の 904 番目のプロリンがロイシンに点変異することで起こる円柱腫瘍は、MIB2 による積極的な分解によることが示唆された。
【概要】
愛媛大学を主としたチームは、E3 リガーゼ MIB2 が脱ユビキチン化酵素 CYLD を分解することにより、炎症を促進することを見出した。また、CYLD 遺伝子が欠損や点変異すると円柱種という腫瘍になることが知られていたが、点変異で円柱腫瘍が誘導される理由は不明であった。本研究において、904 番目のプロリンがロイシンの点変異では、MIB2 による分解が促進され、その結果 CYLD 欠損と同様の状況となり円柱腫瘍ができる可能性を示した。
【詳細】
NF-κB は、炎症性サイトカインなどの多様な刺激によって活性化され、種々の遺伝子発現を亢進させることで炎症や免疫応答、細胞増殖など様々な生命現象を調節する転写因子である。しかしながら、恒常的に活性化した NF-κB は自己免疫疾患やがんなどの様々な疾患に関与している事が報告されている。NF-κB は翻訳後修飾系の一種として知られるユビキチン化依存的なシグナル伝達経路であることが明らかになってきている。ユビキチンが複数つながったポリユビキチン鎖は、タンパク質の分解のみならず、タンパク質の活性化・転写調節など多様な様式でタンパク質の機能を制御する。CYLD に代表されるようなポリユビキチン鎖を切断する脱ユビキチン化酵素は、シグナル活性を負に制御することにより NF-κB の転写活性を調節している。一方で、CYLD タンパク質の分解が NF-κB シグナルの恒常的な活性化を引き起こすこと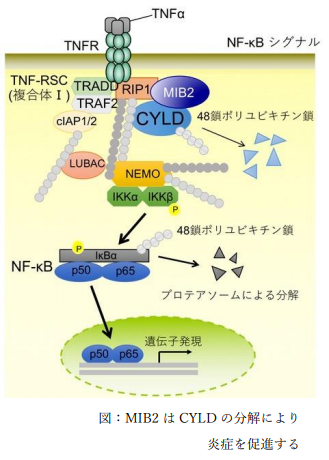 が明らかとなっている。プロテアソームによるタンパク質分解にはユビキチン化する特異的な E3 リガーゼが必要であるが、CYLD を分解誘導し NF-κB を活性化させる E3 リガーゼは未同定であり、ポリユビキチン鎖依存的な新たな疾患メカニズムを解明していく上で重要である。
が明らかとなっている。プロテアソームによるタンパク質分解にはユビキチン化する特異的な E3 リガーゼが必要であるが、CYLD を分解誘導し NF-κB を活性化させる E3 リガーゼは未同定であり、ポリユビキチン鎖依存的な新たな疾患メカニズムを解明していく上で重要である。
NF-κB シグナルにおいて CYLD 分解誘導による抑制制御機構を解明するため、CYLD と相互作用する E3 リガーゼのスクリーニングを行い、 NF-κB シグナルへの関与報告のあった E3 リガーゼ MIB2 を見出した。複数種類のヒトがん由来培養細胞を用いて、1)MIB2 がユビキチン化を付加し CYLD を分解すること、2)MIB2 が CYLD の分解により NF-κB シグナルの活性化を誘導すること、3)MIB2 ノックアウトマウスが関節炎抑制の表現形を示すことを明らかにした。最後に、遺伝性疾患の家族性円柱腫症の患者から見出された CYLD 変異体(P904L)は、MIB2 により優先的に分解されることを発見し、これまで未解明だった CYLD の 1 アミノ酸置換変異による家族性円柱腫症発症機構のモデルを提示した。
【論文情報】
掲載誌:The journal of biological chemistry
題名:The E3 ubiquitin ligase MIB2 enhances inflammation by degrading the deubiquitinating enzyme CYLD(脱ユビキチン化酵素 CYLD の分解により E3 リガーゼ MIB2 は炎症を促進する)
著者:Atsushi Uematsu, Kohki Kido, Hirotaka Takahashi, Chikako Takahashi, Yuta Yanagihara, Noritaka Saeki, Shuhei Yoshida, Masashi Maekawa, Mamoru Honda, Tsutomu Kai, Kouhei Shimizu, Shigeki Higashiyama, Yuuki Imai, Fuminori Tokunaga, Tatsuya Sawasaki
DOI:10.1074/jbc.RA119.010119
URL:http://www.jbc.org/content/294/38/14135.long
【研究サポート】※助成金などの情報を記載
本研究は、次の助成を受けて実施しました。
日本医療研究開発機構(AMED)BINDS 創薬等プラットフォーム事業 19am0101077
文部科学省 新学術領域研究(研究領域提案型) JP25117719 JP16H06579
JSPS 科研費 JP15J03774 JP16K18570 JP16H04729 19H03218
武田科学振興財団
【本件に関する問い合わせ先】
愛媛大学プロテオサイエンスセンター 教授 澤崎達也