2019-11-25 理化学研究所,大阪大学
理化学研究所(理研)生命機能科学研究センター成長シグナル研究チーム(研究当時)の廣中謙一客員研究員、西村隆史チームリーダー、大阪大学大学院理学研究科の藤本仰一准教授らの共同研究チームは、昆虫の種ごとの個体の最終的な体の大きさ(最終サイズ)を決める重要な要因が、「性成熟の開始に必要な最低の大きさ(臨界サイズ)」であることを明らかにしました。
本研究成果は、幼若期から性成熟を伴う最終成長期への発生過程と体のサイズの進化との関係を解明する手掛かりとなり、今後は完全変態昆虫以外でも、その生物に特有の生活史を組み込んだ適切なエネルギー配分モデルを構築することで、生物のサイズの進化における普遍的な原理の発見が期待できます。
今回、共同研究チームは、ショウジョウバエ属[1]の9種を用いて、種ごとに異なる最終サイズ(体重)が、幼虫期において変態[2]の引き金となる臨界サイズ(体重)に比例することを発見しました。観察された最終サイズと臨界サイズの種間変動パターンは、幼体組織[3]と成体組織[3]の最適な成長バランスを求める数学モデルで予測されたパターンとよく一致したことから、臨界サイズへの到達がこれら組織間のエネルギー配分を制御する「スイッチ」として機能していると考えられます。さらに、臨界サイズと最終サイズの比例関係は「成長率[4]」と「最終成長期間」の間に反比例関係があることで説明できること、そして最終成長期間の種間差は性成熟をつかさどるステロイドホルモン[5]活性の時間パターンに由来することを発見しました。これらの発見は、最終サイズを臨界サイズに比例させる仕組みが進化的に保存[6]されていることを示唆しており、「体サイズの進化は、臨界サイズの進化を通してしか起きない」という新たなシナリオが浮かび上がってきました。
本研究成果は、米国のオンライン科学雑誌『iScience』(10月25日号)に掲載されました。

図 実験で用いた9種のショウジョウバエ
背景
体のサイズは、動物のさまざまな機能に影響を与えます。分子遺伝学の発展によって、細胞や器官の成長を制御する仕組みは少しずつ明らかになっていますが、体のサイズそのものを決めるメカニズムについてはいまだに多くの謎が残っています。その背景には、「成長」という現象と併せて「成長停止」という現象についても考えなければならない難しさがあります。
多くの動物は、栄養摂取を続けても終生成長し続けるわけではなく、その種に固有の「ある程度の体サイズ」になった時点で成長が止まります。こうした全身レベルの成長停止は、子供から大人への質的変化を引き起こすホルモンの作用として起こり、性的な成熟を伴います。性成熟を誘導するホルモンの具体例としては、ヒトの思春期を引き起こす性ホルモン、両生類の変態を引き起こす甲状腺ホルモン、昆虫の変態を引き起こすエクジステロイドホルモンなどが挙げられます。
これらのホルモンは、動物の幼体が「臨界サイズ」と呼ばれる特定の大きさに達したときに分泌されます。人間の子供でも、ある程度の体重に達することが、思春期が始まる引き金になると報告されています注1)。臨界サイズに到達してから実際に成長が停止するまでの期間は、人間では思春期に当たり、他の動物では「最終成長期」などと呼ばれています。
以上のような成長停止の仕組みから、動物の最終的な体の大きさ(「最終サイズ」)は、実質的に「臨界サイズ」「最終成長期間」「最終成長期における成長率」の三つの変数だけで決まることになります(図1)。過去の研究では、栄養や温度などの環境要因に加え、栄養摂取に伴う成長制御に関わるインスリンシグナル経路[7]やTOR経路[8]などの遺伝子機能が、これら三つの変数のいずれかを通して最終サイズに影響することが知られていました。
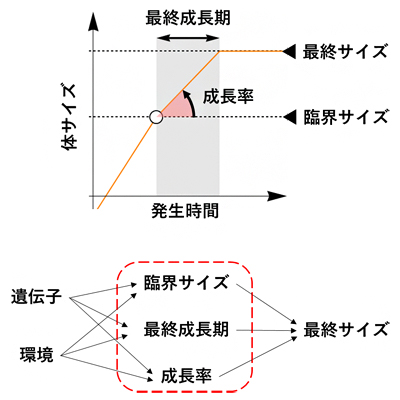
図1 最終サイズを決める三つの変数
動物の最終的な体の大きさは、性成熟の開始に必要な最低サイズである「臨界サイズ」、臨界サイズに到達してから実際に成長が停止するまでの「最終成長期間」、最終成長期における「成長率」の三つの変数によって決まる。
一方で、自然界に存在する動物の体のサイズは非常に多様です。種が分化するような体サイズの進化においても、これら三つの変数の働きが背後にあると予想されますが、それぞれの変数が個々の種のサイズの進化にどれほど寄与しているのかは、これまで明らかになっていませんでした。
注1)Frisch, R.E. and Revelle, R. 1970. Height and weight at menarche and a hypothesis of critical body weights and adolescent events. Science 169, 397-399.
研究手法と成果
廣中謙一客員研究員は、2017年にサイズの進化における臨界サイズの役割を予想する数学的理論を発表しました注2)。この理論は、完全変態昆虫[9]の生活史を反映した器官間エネルギー配分モデルに最適制御理論[10]を応用したもので(図2)、ここから、基本的な個体の成長メカニズムが共通する場合は、臨界サイズと最終サイズの間に比例関係が成り立つ、つまり臨界サイズが大きいほど最終サイズが大きくなるという「最適スケーリング則[11]」を予想しました。この予想は、同種の個体が異なる環境で見せる表現型可塑性[12]の範囲(種内変動)では実証されていましたが、実際に自然界に存在する近縁種の間(種間変動)でも成り立つかは検証されていませんでした。
注2)Hironaka, K. and Morishita, Y. 2017. Adaptive significance of critical weight for metamorphosis in holometabolous insects. J. Theor. Biol. 517, 68-83.
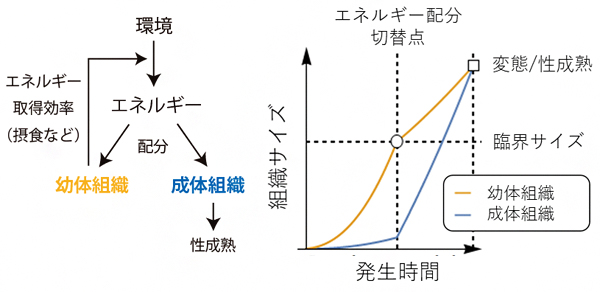
図2 エネルギー配分モデル
(左)動物は環境から取得したエネルギーを、幼体組織と成体組織の成長に配分する。幼体組織のサイズはエネルギー取得効率に、成体組織のサイズは性成熟に関わる。
(右)このモデルにおいて、臨界サイズはエネルギー配分の切替点に対応する。
今回、共同研究チームは、成体サイズ(本研究では幼虫の最終サイズ)が異なるショウジョウバエ属の9種を用いて、臨界サイズやその他のサイズ決定に関わるさまざまな変数を網羅的に測定しました。変態に必要な臨界サイズとは、幼虫がそれ以上栄養摂取をしなくても正常に性成熟(蛹での変態過程)できる最小サイズのことです。これを求めるには、さまざまなサイズの幼虫を飢餓状態にし、蛹化能の有無や蛹になるまでの時間を調べる必要があります。
そこで、臨界サイズの測定に必要なデータを効率よく取得できるワークフローを構築しました(図3)。細胞培養用の48穴プレートを用いて飢餓用の寒天培地を作り、それぞれの穴にさまざまな大きさの幼虫を1匹ずつ入れたプレートを恒温機で長時間のタイムラプス撮影を行いました。ある大きさの幼虫が蛹になるかならないか、および蛹になる場合はそれにかかった時間を測定し、統計的な手法を用いて臨界サイズを求めました。

図3 飢餓実験のタイムラプス撮影と統計解析
細胞培養用の48穴プレートを用いて飢餓用の寒天培地を作り、それぞれの穴に1匹ずつ幼虫を入れたプレートを恒温機で長時間タイムラプス撮影した。画像はその一部を抜き出して拡大したもの。これらの画像を数値化し、飢餓時のサイズ(体重)と蛹になる確率、蛹になるまでの時間の関係について、統計的な解析を行うことによって臨界サイズを求めた。
こうして得られたデータは、ショウジョウバエ属において臨界サイズと最終サイズの間に確かに比例関係が成立することを示していました(図4左)。また、理論的に予想された最適な比例係数が0.42±0.09であるのに対し、実際に観察された比例係数は0.44±0.03と非常に近い値を示していました。この結果は、最適スケーリング則の前提である「臨界サイズがエネルギー配分スイッチである」という仮説を強く支持します。
また、種間で見られる臨界サイズと最終サイズの比例関係は、最終成長期間と成長率の間に反比例関係があることによって成立していることも分かりました(図4右)。つまり、最終成長期間の長い種は成長率が低く、逆に最終成長期間の短い種は成長率が高いというように、最終成長期間と成長率はお互いの効果を打ち消し合うように働いているため、これらの変数が最終サイズに与える影響は無視できるものになっていました。

図4 臨界サイズの最適スケーリング則
(左)9種の間で臨界サイズと最終サイズの間に比例関係(スケーリング則)が成立していた。また、この比例係数は理論的に予測されるものと一致していた。これは「臨界サイズがエネルギー配分スイッチである」という仮説を強く支持している。
(右)9種の間で最終成長期間と成長率の間に反比例関係があることで、臨界サイズのスケーリング則が実現されている。
さらに、最終成長期間が著しく異なる3種を選別し、性成熟の開始を誘導するエクジステロイドホルモンの量的変化を測定したところ、最終成長期間が短い種ほどエクジステロイドホルモンの増加率が大きくなることが分かりました。このことは、種の進化によってホルモンの合成や分泌に関わる遺伝子の働きが変化することで、最終成長期間が変わってきたことを示唆しています。エクジステロイドホルモン合成を制御するインスリンシグナル経路やTOR経路は、昆虫を含む幅広い動物種で成長率の制御にも関与していることが知られています。すなわちこれら二つの経路は、成長率と最終成長期間を同時に制御しているといえるため、最終サイズを臨界サイズに比例させるスケーリング機構の一部としての役割を果たしている可能性があります。
こうした分子遺伝学的知見と今回得られた実験結果を組み合わせることで、「進化的に保存された最適スケーリング機構が存在するために、成体サイズの進化は臨界サイズの進化を通してしか起きない」という、今まで考えられてこなかったサイズ進化の新たなシナリオが浮かび上がってきました。
今後の期待
今回の発見は、完全変態昆虫における体のサイズの進化において、臨界サイズが主要な役割を果たした可能性を示しています。
今後は完全変態昆虫以外でも、その生物に特有の生活史を組み込んだ適切なエネルギー配分モデルを構築することで、生物のサイズの進化における普遍的な原理の発見が期待できます。
補足説明
1.ショウジョウバエ属
モデル生物であるキイロショウジョウバエの属する生物学的分類単位。目が赤く、アルコールに引き寄せられる習性を持つ。猩々(しょうじょう)という酒好きの赤い妖怪にちなんで名付けられた。
2.変態
動物がその発育過程において形態を著しく変化させること。変態とともに生活様式を変えることも多く、チョウに変態するイモムシや、カエルに変態するオタマジャクシなどはその典型である。
3.幼体組織、成体組織
完全変態する昆虫の幼虫には、成虫の体をつくる「成虫原基」と呼ばれる器官が存在し、幼虫の体をつくる器官の多くは蛹の段階で分解される。本研究では幼虫の成長と成虫原基の成長から、幼体組織と成体組織の成長率を求めた。
4.成長率
発生過程において、体のサイズ(体重)の変化量をその期間の長さで割ったもの。変化量として相対値(変化量の絶対値を変化前の体重で割ったもの)を用いた場合、成長率は細胞分裂速度(その期間に細胞が何回分裂したか)と同一視することができる。
5.ステロイドホルモン
コレステロールから合成されるホルモンの一種。脂質に溶解する性質を持つため、体液中から標的細胞の細胞膜を通過して細胞内にある受容体と結合し、さまざまな生理作用をもたらすことができる。昆虫ではエクジステロイドホルモン、ヒトでは性ホルモンがステロイドホルモンに分類される。
6.進化的に保存
生物個体を構成する何らかの要素(遺伝子配列・シグナル経路・発生プログラムなど)が異なる種の間で共有されていること。その要素が進化の間に失われることが個体にとって不利になることを示唆しているため、進化的に保存された要素はそれを持つ種にとって機能的に重要であると考えられる。
7.インスリンシグナル経路
脊椎動物から無脊椎動物まで広く存在するシグナル経路で、成長・代謝・寿命など多様な機能に関わる。体液中に分泌されたインスリン様ペプチドが標的細胞の細胞膜上にある受容体に結合し、細胞内にシグナルを伝達することで始まる。
8.TOR経路
Ser/ThrプロテインキナーゼであるTORを中心としたシグナル経路で、インスリン経路と同じく真核生物において高度に保存されている。栄養状態やインスリンなどのホルモンに応答し、細胞の成長・増殖・代謝などをコントロールする。
9.完全変態昆虫
変態する昆虫のうち、幼虫が成虫になる前に蛹の形態を経るもの。チョウ、ハチ、ハエ、甲虫などがこれに該当する。現存する昆虫種の約8割は完全変態昆虫であるが、昆虫の進化史上では比較的新しい分類である。
10.最適制御理論
時間変化する制御系において、目的関数を最小化(最大化)する制御を求める理論。機械の制御を目的とした工学分野で発達した理論だが、生物学においても最適生活史モデルの構築などにおいて応用される。
11.スケーリング則
二つの量の間の変換関係を主張する法則。生物では特に体サイズに対する代謝率や運動能力の関係がさまざまな種で調べられてきた。一般的には比例関係になるとは限らず、べき乗則やアロメトリー則とも呼ばれる。
12.表現型可塑性
同一遺伝子の生物個体が環境に応じて表現型(形質)を変化させる性質のこと。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「栄養環境の変化に対する適応戦略と成長・代謝制御機構の解析(研究代表者:西村隆史)」、同挑戦的研究(萌芽)「最適制御理論に基づく環境依存的な成長と代謝の調節機構に関するeco-devo研究(研究代表者:西村隆史)」、同特別研究員奨励費「計算機進化によって器官の成長制御機構を明らかにする(研究代表者:廣中謙一)」、同新学術領域研究(研究領域提案型)「進化のゆらぎ応答理論の確立と多階層・発生過程への展開(研究代表者:金子邦彦)」による支援を受けて行われました。
原論文情報
Ken-ichi Hironaka, Koichi Fujimoto, Takashi Nishimura, “Optimal scaling of critical size for metamorphosis in the genus Drosophila”, iScience, 10.1016/j.isci.2019.09.033
発表者
理化学研究所
生命機能科学研究センター 成長シグナル研究チーム(研究当時)
客員研究員 廣中 謙一(ひろなか けんいち)
(現 東京大学 大学院理学系研究科 特任助教)
チームリーダー 西村 隆史(にしむら たかし)
(現 生命機能科学研究センター 形態形成シグナル研究チーム 上級研究員)
大阪大学 大学院理学研究科 生物科学専攻
准教授 藤本 仰一(ふじもと こういち)
報道担当
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
大阪大学 理学研究科 庶務係