PET検査で神経幹/前駆細胞の造腫瘍性変化を可視化
2020-01-06 慶應義塾大学医学部,量子科学技術研究開発機構,日本医療研究開発機構
慶應義塾大学医学部生理学教室の岡野栄之教授、整形外科教室の中村雅也教授、谷本祐之助教、国立研究開発法人量子科学技術研究開発機構(以下、量研)量子医学・医療部門放射線医学総合研究所 先進核医学基盤研究部の山崎友照主任研究員、張明栄部長らを中心としたグループは、ヒトiPS細胞由来神経幹/前駆細胞を移植したモデルマウスの未分化細胞を、臨床応用可能な陽電子放出断層撮影(以下PET、注1)で画像化することにより、iPS細胞を用いた移植治療の懸念であった造腫瘍性変化(注2)を生体内で捉えることに、世界で初めて成功しました。
これまで、慶應義塾大学医学部では、脊髄損傷モデル動物に対してヒトiPS細胞由来神経幹/前駆細胞塊(ニューロスフェア)の移植(注3)を行い、運動機能の改善を報告してきました。
しかし、一部の造腫瘍性を有する株では、未分化性が移植後長期間持続することや未分化神経細胞の増殖傾向があり、そのため、移植後の安全性確保のために、腫瘍化や細胞増殖を継続してモニタリングすることのできる技術が望まれてきました。侵襲性の少ない画像診断により移植細胞を生体内で経過観察することができれば、危険な腫瘍性変化を早期に検出し、病巣部切除などの対策を講じることが可能になると考えられます。しかし、現在まで移植細胞の造腫瘍性変化を可視化できる臨床応用可能なイメージング技術は世界でも報告されていません。
今回、研究グループは、生体内分子の機能情報を観察することができるイメージング技術を用いて、マウスの脳・脊髄内におけるヒトiPS細胞由来神経幹/前駆細胞移植後に残存した未分化神経組織の造腫瘍性変化を生体内で検出することに成功しました。
今回の研究成果は、脊髄損傷患者や脳外傷患者などに対して、ヒトiPS細胞由来神経幹/前駆細胞移植を行なった後の臨床経過を観察するための生体内細胞モニタリング技術として、役立つことが期待され、より安全な再生医療の確立に向けた大きな成果であると言えます。
本研究成果は、2020年1月6日(米国東部時間)に、『STEM CELLS Translational Medicine』に掲載されます。
研究の背景と概要
脊髄損傷は、主として脊椎に強い外力が加わることで脊髄実質に障害が生じ、運動・知覚・自立神経の麻痺を呈する病態です。日本では、年間約5,000人の新規脊髄損傷患者が発生し、累計患者数は20万人以上に達しています。脊髄損傷後の病態は、急性期・亜急性期・慢性期(注4)と、損傷時からの時間経過に大きく依存するため、それぞれの状態に合わせた治療法の選択が必要となります。
これまで、慶應義塾大学医学部では、脊髄再生医療の実現へ向けて、マウス、ラットなどのげっ歯類やコモンマーモセットなどの霊長類脊髄損傷動物モデルにおいて、ヒトiPS細胞由来神経幹/前駆細胞移植による運動機能の回復を世界に先駆けて実証してきました。しかし、一部の細胞株では、移植後の神経やグリア細胞への分化・成熟が十分に進まず未分化な状態で長期残存した神経細胞が、移植長期経過後に腫瘍化することがありました。そのため、慶應義塾大学医学部では、臨床で使用予定の細胞株に対して厳格な品質基準(注5)を設け、その基準を合格した細胞のみを使用することを徹底しています。
しかし、幹細胞の性質上、未分化な状態の細胞が術後一定期間残存する可能性を完全に排除することはできないため、移植後の細胞を生体内で追尾し、腫瘍化を継続的に評価することは、幹細胞を用いた脊髄損傷研究における大きな課題でした。
今回、慶應義塾大学医学部と量研は、中枢神経疾患の早期病変の指標として注目される18kDa トランスロケータタンパク質 (以下、TSPO、注6)をPETで描出し腫瘍化を評価する手法を開発し、検証しました。
PETは、細胞・組織の代謝性変化を定性的且つ定量的に描出することのできる先進のイメージング技術であり、臨床では糖代謝を反映するタンパク質を指標として用いて腫瘍の早期検出などに利用されています。TSPOは、ミトコンドリアの外膜に存在し、その発現量は、正常中枢神経では低く、神経炎症やグリオーマ(注7)などの中枢神経系腫瘍の発生時に増加することから、中枢神経疾患の早期病変を映し出す指標としてイメージング研究の分野において注目を集めています。さらに、TSPOは未分化な神経幹細胞にも発現していることが確認されており、研究グループはその特性に着目し、幹細胞/前駆細胞を標識するバイオマーカーとして用いました。幹細胞移植後、細胞が分化成熟せず未分化なまま過剰に増殖することが腫瘍化の原因の一つであり、未分化な細胞に結合したTSPOのリガンドをPET画像で検出することにより、腫瘍化した部位を特定することができました(図1)。
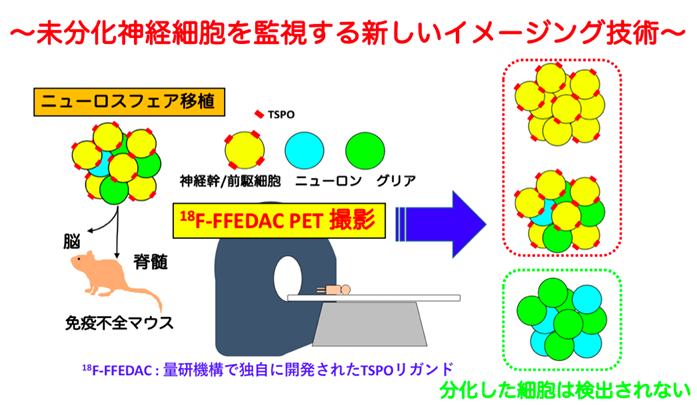
図1
研究の成果と意義・今後の展開
本研究グループは、①細胞レベルにおいて、ヒトiPS細胞由来神経幹/前駆細胞におけるTSPOの発現状態を評価するため細胞分化誘導前後での各種抗体を用いた免疫学的解析を行いました。
その結果、①分化誘導後に残存したヒトiPS細胞由来の未分化神経細胞において、神経幹細胞のマーカーであるネスチンとTSPOの共発現が確認された一方で、分化した成熟神経においては、TSPOの発現が低下することが明らかになりました(図2左)。
さらに、②免疫不全マウスの脳・脊髄に対して、造腫瘍性 (分化抵抗性)を有する細胞株と造腫瘍性を持たない細胞株の移植を行い、移植後4~8週の期間でTSPOに選択的な放射性リガンドである18F-FEDAC(量研で独自に開発されたTSPOリガンド、注8)を経尾静脈投与してPET撮像を行いました。
その結果、②造腫瘍性を有する株を移植したマウス右大脳線条体(注9)において、残存した未分化神経細胞の増殖部位で18F-FEDACの高い集積を検出することが明らかになりました(図2右)。加えて、同様に造腫瘍性を有する株を移植したマウス脊髄モデルにおいても、未分化神経細胞の増殖部位で18F-FEDACの集積を検出しました。
①、②の結果から免疫不全マウスの脳・脊髄へ、造腫瘍性を有するヒトiPS細胞由来神経幹/前駆細胞の移植を行なった場合、過剰に増殖した腫瘍様や腫瘍化した未分化神経組織ではTSPOが高発現になり、PET画像ではっきりと描出されることが確認されました。
今回の研究では、その放射性リガンドである18F-FEDACを用いてPET撮像を行うことで、生体内で腫瘍性変化のモニタリングが可能であることが検証されました。
医療で広く使用されているPETイメージング技術を用いた腫瘍化の診断法は、脊髄損傷患者や脳外傷患者に対するヒトiPS細胞由来神経幹/前駆細胞移植後の経過観察をする上で非常に重要な画像検査になりうると考えられ、より安全な再生医療を実現する上で非常に大きな一歩であると考えられます。今後、本手法の臨床応用を見据え、より大動物での検証実験が望まれます。
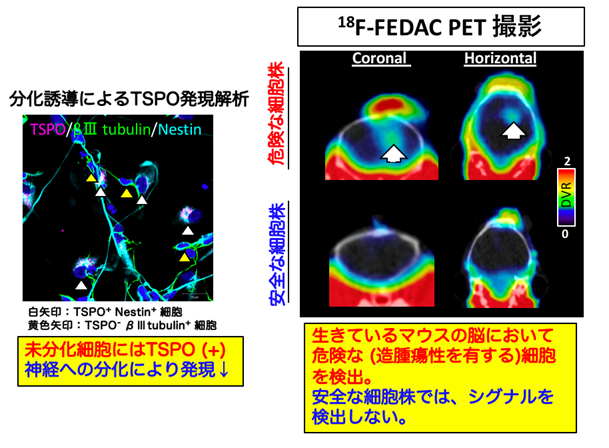
図2
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)・再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点A)「iPS細胞由来神経幹前駆細胞を用いた脊髄損傷・脳梗塞の再生医療」、および一般社団法人日本損害保険協会研究助成の支援によって行われました。
論文
- 英文タイトル:
- In Vivo Monitoring of Remnant Undifferentiated Neural Cells Following Human iPS Cell -Derived Neural Stem/Progenitor Cells Transplantation
- タイトル和訳:
- ヒトiPS細胞由来神経幹前駆細胞移植後に残存した未分化神経組織に対するin vivo イメージング
- 著者名:
- 谷本祐之、山崎友照、名越慈人、西山雄一郎、海苔聡、西村空也、飯田剛、尾崎正大、辻収彦、Ji Bin、青木伊知男、陣崎雅弘、松本守雄、藤林康久、張明栄、中村雅也*、 岡野栄之** (*and** Corresponding authors)
- 掲載誌:
- STEM CELLS Translational Medicine
用語解説
- (注1)PET:
- ポジトロン核種(11C、18F等)で標識された放射性リガンドを生体内に投与することで、特定の分子の動きを生きたままの状態で画像化することを可能にする技術。臨床では糖代謝を反映する18F-FDGを用いて腫瘍の早期検出などに利用されるのが一般的である。
- (注2)造腫瘍性変化:
- 一部のiPS細胞株から樹立された神経幹/前駆細胞を脊髄損傷モデル動物へ移植した後、未分化性が長期間残存し、腫瘍化すること。
- (注3)神経幹/前駆細胞:
- 未分化な状態を保持したまま増殖可能な自己複製能と、中枢神経系を構成するニューロン(情報処理装置としてさまざまな情報伝達を担う)、アストロサイト(中枢神経系に存在するグリア細胞の一つであり、ニューロンに対して補助的な機能がある) 、オリゴデンドロサイト(中枢神経系に存在するグリア細胞で、髄鞘を形成する)の3系統の細胞へ分化可能な多分化能を併せ持つ細胞。
- (注4)急性期・亜急性期・慢性期:
- 脊髄損傷後の病期は、大きく3つに分類することができ、受傷後2週間未満を急性期、受傷後2~4週間を亜急性期、それ以降を慢性期としている。慶應義塾大学医学部では、まずは亜急性期の脊髄損傷患者を対象として、iPS細胞由来神経幹/前駆細胞移植を計画している。
- (注5)品質基準:
- 慶應義塾大学医学部では、移植に用いるiPS細胞由来神経幹/前駆細胞に対して安全なiPS細胞の樹立、遺伝子異常やゲノム安定性の評価、動物モデルを用いた移植実験、移植後の各種画像検査など、さまざまな検査によって、臨床応用へ向けた安全性を確実に担保するように努めている。
- (注6)TSPO:
- ミトコンドリア外膜に存在する輸送タンパク質。他のタンパク質と複合体を形成することにより、ミトコンドリア膜を通り抜けるための穴を作る。生理学的役割に不明な点はあるが、免疫機能の調整や、ステロイド生合成、細胞増殖に関与するとされている。
- (注7)グリオーマ(神経膠腫):
- 脳や脊髄の実質に発生する腫瘍であり、多くは悪性である。上述したグリア細胞が腫瘍化したものであり、その腫瘍化メカニズムは解明しきれていない点が多い。
- (注8)18F-FEDAC:
- N-benzyl-N-methyl-2-[7,8-dihydro-7-(2-18F-fluoroethyl)-8-oxo-2-phenyl-9H-purin-9-yl]acetamideの略。2009年に量研がPET用に開発した、TSPOに特異的に結合する性質を持った試薬。半減期が110分程度の18Fを付けている。
- (注9)大脳線条体:
- 脳の皮質下にある構造体であり、運動機能などに関与し、大脳基底核の構成要素となる。本研究では、大脳線条体と脊髄に対して、それぞれiPS細胞由来神経/前駆細胞の移植を行なっている。
お問い合わせ先
慶應義塾大学医学部生理学教室
教授 岡野 栄之(おかの ひでゆき)
慶應義塾大学医学部整形外科学教室
教授 中村 雅也(なかむら まさや)
国立研究開発法人量子科学技術研究開発機構に関すること
国立研究開発法人量子科学技術研究開発機構
経営企画部 広報課 中(なか)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課