HP1γを欠損した神経幹細胞はニューロンへの分化傾向が強くなる
2020-01-28 京都大学
成瀬智恵 医学研究科准教授、吉原亨 同特定助教、浅野雅秀 同教授らの研究グループは、ヘテロクロマチンプロテイン1(HP1)と呼ばれるタンパク質ファミリー分子のうち、HP1γを欠損したマウス神経幹細胞では、ニューロン特異的に発現する遺伝子の発現量が上昇し、ニューロンに分化しやすくなることを見出しました。
HP1には、遺伝子が使用されないときにヘテロクロマチンと呼ばれる凝集構造を形成して、遺伝子が読み取られないようにする(転写抑制)機能があります。これまでHP1γは、転写抑制の目印である、ヒストンH3の9番目のリジン(H3K9)のメチル化と密接に関係していると考えられてきました。本研究グループは、HP1γが別の転写抑制の目印である、ヒストンH3の27番目のリジン(H3K27)のメチル化の維持にも関与していることを明らかにしました。本研究により、HP1γは、メチル化H3K27の脱メチル化酵素であるJMJD3およびUTXがニューロン特異的な遺伝子に近づくのを妨げることにより、メチル化H3K27を維持することが示唆されました。
本研究成果は、神経幹細胞をニューロンに正常に分化させるための制御には、ヒストン修飾を正常に保つことが必須であることを示唆しており、脳や神経の再生医療などへの応用が考えられます。
本研究成果は、2020年1月21日に、国際学術誌「FASEB Journal」のオンライン版に掲載されました。
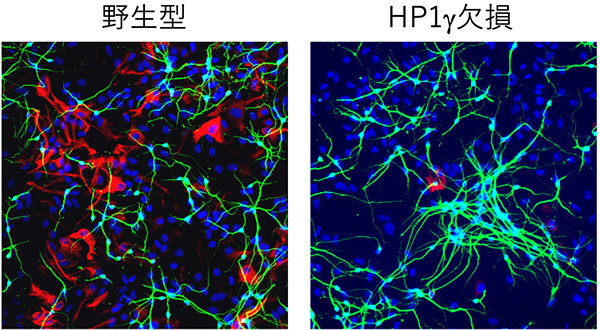
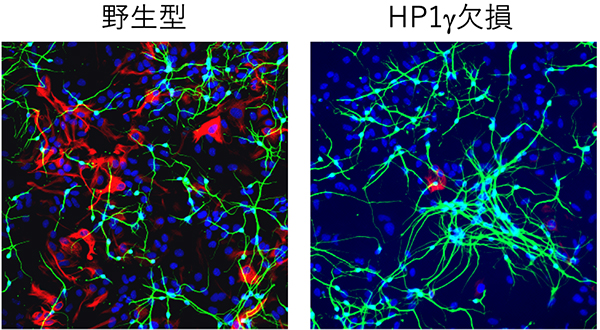
図:神経幹細胞の分化を誘導したところ、HP1γ欠損細胞ではアストロサイト(赤色)が少なく、ニューロンが多く見られた(緑色)。青色:細胞核。
詳しい研究内容について
ヒストン修飾の変化による脳の神経細胞分化の制御メカニズムを解明
―HP1γを欠損した神経幹細胞はニューロンへの分化傾向が強くなる―
概要
私たちの体を構成する細胞は、一つの受精卵から始まり、神経、筋肉、血液などの元となる幹細胞を経て、時間が経つにつれて機能が細分化された最終分化段階に至ります。脳を構成する神経細胞も例外ではありません。脳内には、神経幹細胞から分化した様々な種類の細胞があり、例えばニューロン(一般に言う神経細胞)は情報伝達、情報処理を行い、アストロサイトは主にニューロンを補助する機能があると考えられています。これらの細胞が正常に脳内で分化して機能するためには、これらの細胞で利用されるべき遺伝子が正しくメッセンジャーRNA1)として読み取られてタンパク質に翻訳されることが重要です。また、利用されるべきでない遺伝子は読み取られないように封印しておく必要があります。しかしながら、生体内におけるこれらの制御機序はまだ詳細にわかっていません。
京都大学大学院医学研究科 成瀬智恵 准教授、吉原亨 同特定助教、浅野雅秀 同教授らの研究グループは、ヘテロクロマチン 2)プロテイン 1(HP1)と呼ばれるタンパク質ファミリー分子のうち、HP1γを欠損したマウス神経幹細胞では、ニューロン特異的に発現する遺伝子の発現量が上昇し、ニューロンに分化しやすくなることを見出しました。
HP1 には、遺伝子が使用されないときにヘテロクロマチンと呼ばれる凝集構造を形成して、遺伝子が読み取られないようにする(転写抑制)機能があります。これまで HP1γは、転写抑制の目印である、ヒストン H33) の 9 番目のリジン(H3K9)のメチル化 4)と密接に関係していると考えられてきました。私たちの研究は、HP1γ が別の転写抑制の目印である、ヒストン H3 の 27 番目のリジン(H3K27)のメチル化の維持にも関与していることを明らかにしました。本研究により、HP1γは、メチル化 H3K27 の脱メチル化酵素である JMJD3 および UTX がニューロン特異的な遺伝子に近づくのを妨げることにより、メチル化 H3K27 を維持することが示唆されました。本研究の成果は、神経幹細胞をニューロンに正常に分化させるための制御には、ヒストン修飾を正常に保つことが必須であることを示唆しており、脳や神経の再生医療などへの応用が考えられます。
本成果は 2020 年 1 月 21 日に米国の学術誌「FASEB Journal」のオンライン版に掲載されました。
1.背景
私たちの体を構成する細胞は全て同じ遺伝子セットを持っていますが、それぞれの細胞が必要な遺伝子のみを利用することで、異なるタンパク質を発現し、異なる役割を果たすことが可能です。逆に、不要な遺伝子は利用されないように封印しておく必要があります。細胞では、不要な遺伝子の DNA をメチル化したり、不要な遺伝子周辺のヒストンをメチル化したりします。そうすることでヘテロクロマチンと呼ばれる構造が形成されて、メッセンジャーRNA が作られにくくなります。ヘテロクロマチンでは、ヒストン H3 の 9 番目のリジン(H3K9)や、ヒストン H3 の 27 番目のリジン(H3K27)がメチル化されています。HP1 はメチル化 H3K9 に結合し、ヘテロクロマチン形成に必要なタンパク質を引き付けることにより、遺伝子の特定の領域をヘテロクロマチン化することが知られていました。脳などの神経組織で HP1 が多く発現していることがわかっていましたが、神経組織における HP1 の役割はほとんどわかっていませんでした。
2.研究手法・成果
マウス神経組織および神経幹細胞で HP1 ファミリー(HP1α、HP1β、HP1γ)の発現量を調べたところ、HP1α と HP1γが多く発現していました。HP1γは他のファミリー分子と異なる機能を持っていることがわかっていたため、HP1γ欠損マウスを作製したところ、生後すぐに死んでしまいました。そこで、HP1γ欠損マウスの胎仔の脳より神経幹細胞を採取して培養を続けた結果、神経幹細胞では本来発現しないニューロン特異的遺伝子を発現するなど、ニューロンに分化する傾向を持つことがわかりました(図1)。

図1: 神経幹細胞の分化を誘導したところ、HP1γ欠損細胞ではアストロサイト(赤色)が少なく、ニューロンが多く見られました(緑色)。青色:細胞核
また、これらの遺伝子の転写開始点周辺ではメチル化 H3K27 が減少していることがわかりました。よって、メチル化 H3K27 によって抑制されているはずのニューロン特異的遺伝子が、HP1γ欠損細胞では抑制されなくなって発現が増加してしまうのだろうと考えられました。メチル化 H3K27 が減少している理由として、① H3K27 にメチル基を付与するタンパク質の減少、②逆に、H3K27 のメチル基を除去するタンパク質の増加、の2つが考えられましたが、それぞれに関与するタンパク質の量を測った結果、②であることがわかりました。
HP1γはメチル化 H3K9 と結合して遺伝子の発現を抑制すると考えられていますが、本研究により、HP1γの新しい役割として、メチル化 H3K27 のメチル基を除去するタンパク質(JMJD3 および UTX)の結合を抑制することが示唆されました(図2)。
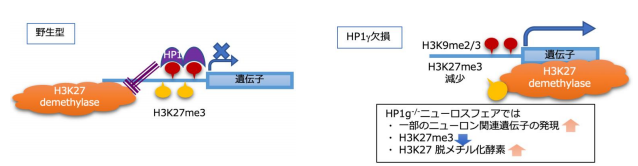
図2:HP1γ欠損細胞で観察されたことから推測して、マウス神経幹細胞における HP1γの役割は、ヒストン H3 の
27 番目のリジンのメチル基を、脱メチル化酵素から保護することであると考えられました。
3.波及効果、今後の予定
本研究により、HP1γがマウスの神経幹細胞においてニューロン特異的な遺伝子の発現を抑制していることがわかりました。本研究成果を発展させることにより、神経幹細胞からニューロンへ効率的に分化を誘導する方法や、逆に、神経幹細胞を分化させずに未分化性を保ったまま維持するメカニズムの解明につながると考えられます。また、本研究は培養細胞での実験により行われましたが、神経細胞特異的に HP1γを欠損させたマウスの解析を行うことで、生きたマウスの脳における HP1γの役割の解析を進める予定です。
また、メチル化 H3K9 を認識して結合する HP1γがメチル化 H3K27 の保護に必要であることは、両ヒストン修飾が密接に関連していることを示唆しています。本研究では HP1γが JMJD3 や UTX と排他的に存在する直接の証拠は得られませんでしたが、今後、HP1γが相互作用する分子を解析するなどして、分子メカニズムを明らかにしていきたいと考えています。
4.研究プロジェクトについて
本研究は日本学術振興会科学研究費助成事業 基盤研究(B)(25290031)と基盤研究(C)(25430085)、京都大学リサーチ・ディベロップメントプログラムいしずえの支援を受けました。
<用語解説>
1) メッセンジャーRNA:DNA からタンパク質ができる間を仲介する物質。DNA 上の遺伝情報は、いったんメッセンジャーRNA に転写され、翻訳という過程を経てタンパク質が合成される。
2) ヘテロクロマチン:遺伝子が利用されるべきでない場所を硬く封印しておくための染色体構造。
3) ヒストン H3:真核生物の染色体構造を構成する主なタンパク質である、ヒストンタンパク質の1つ。DNA がヒストンに巻きついた構造をヌクレオソームといい、ヌクレオソームが高次構造を取ったものが染色体である。
4) ヒストンメチル化:ヒストンの特定のアミノ酸にメチル基が付与されること。メチル化されるアミノ酸の部位により、そのメチル基の持つ機能は異なり、さらにそれらのメチル基を付与および除去する酵素も部位によって異なる。
<研究者のコメント>
私たちはこれまでマウスを用いて,ヒストン修飾因子が哺乳類の発生にどのような役割を持つのか研究してきました。本研究のような基礎研究は,必ずしもすぐに何かに役立つものではありませんが,基礎研究の積み重ねが社会の役に立つ応用研究に結びつくことを忘れずに努力を続けていきたいと思います。(成瀬)
<論文タイトルと著者>
タイトル:Heterochromatin protein 1gamma deficiency decreases histone H3K27 methylation in mouse neurosphere neuronal genes.(HP1γ欠損神経幹細胞ではニューロン特異的遺伝子における H3K27 のメチル化が減少する)
著者:成瀬智恵、阿部可奈恵、吉原亨、加藤智明、西内巧、浅野雅秀
掲載誌:FASEB Journal DOI:10.1096/fj.201900139R