自閉スペクトラム症の治療戦略の開発に期待
2020-02-26 大阪大学,日本医療研究開発機構(AMED),国立精神・神経医療研究センター(NCNP)
分野:生命科学・医学系
キーワード:自閉スペクトラム症(自閉症)、患者由来iPS細胞、遺伝子突然変異、ヒト型疾患モデルマウス
❖ 本研究成果のポイント
■自閉スペクトラム症(自閉症)*1は、胎児期に始まる脳発達の異常によって発症すると考えられていますが、発症のメカニズムはほとんど不明であり、また根本的な治療法は存在しません。
■本研究で解析の対象にしたPOGZ遺伝子は、自閉症患者から同定された突然変異が最も多く存在する遺伝子であり、その解析により、自閉症のメカニズムの一端が明らかになることが期待されますが、その詳細は未解明でした。
■POGZ遺伝子に突然変異を持つ自閉症患者由来のiPS細胞、および同じ変異を導入したヒト型疾患モデルマウスを独自に作製し、POGZ遺伝子の突然変異が自閉症の病態と関連することを発見しました。
■本研究成果をもとに、POGZが制御する神経機能を標的とした創薬研究により、自閉症の新たな治療薬の開発に発展することが、将来的に期待されます。
❖ 研究成果の概要
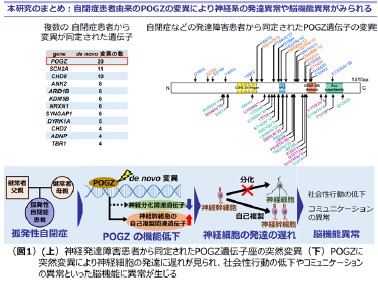
大阪大学大学院歯学研究科の中澤敬信准教授、同薬学研究科の橋本均教授、国立精神・神経医療研究センターの橋本亮太部長のグループは、自閉症患者から最も多くの突然変異が同定されているものの、その機能がほとんどわかっていないPogo transposable element with zinc finger domain (POGZ)タンパク質が脳の正常な発達に必要であることを発見しました。また、その突然変異によるPOGZの機能低下によって、マウス脳の発達期における神経細胞の発達、および自閉症と関連する社会性行動に障害を与えることを新たに見い出しました(図1)。
自閉症の発症の原因は未だ不明な点がほとんどであり、治療薬は存在しないことから、治療戦略の開発が緊急の課題である現状において、自閉症と関連する脳高次機能異常の分子メカニズムを見い出したことは、精神医学/神経科学の領域において極めて注目される成果です。今後、自閉症の新たな治療戦略の開発に発展することが期待されます。
なお、本研究成果は、国際的な総合学術雑誌「Nature Communications」の電子版に2月26日(水)(英国時間10時、日本時間19時)に掲載されました。
本研究成果について、2月25日(火)14時から大阪大学中之島センター 3階 講義室302にて記者発表を行いました。
❖ 研究の背景
自閉症は、社会的相互作用やコミュニケーションの障害、反復的行動、興味の限局、認知機能の低下など、多岐にわたる症状を示す疾患です。胎児期から始まる脳発達の異常によって発症すると考えられていますが、発症の原因やメカニズムは不明な点が多く残されており、自閉症患者の約90%では発症の原因は不明です。また、根本的な治療法や上記のような主要な症状に対する薬物療法は存在しておらず、自閉症の発症のメカニズムの解明やそれに基づく創薬が求められています。
自閉症は、孤発症例*2が多いことなどから、近年、健常者の両親には存在せず、患者(子ども)に生じる突然変異*3が疾患の要因の一つと考えられています。近年、大規模に健常者の両親と自閉症患者のサンプルを用いた全エキソンシークエンス*4が実施され、自閉症との関連性が示唆される遺伝子の突然変異が複数同定されています。患者に生じた突然変異と自閉症の発症との関連性を明らかにするためには、個々の突然変異に着目した詳細な生物学的な研究が必要です。しかし、これまでに個々の突然変異による遺伝子産物の機能異常や、その変異の個体に及ぼす影響を解析した報告例はほとんどありませんでした。
中澤准教授、橋本教授、橋本部長らは、多くの研究室との共同研究で、日本人の健常者(両親)と自閉症患者(子ども)のサンプルを用いた全エキソンシークエンスを実施し、POGZ遺伝子座等に自閉症と関連することが示唆される突然変異を同定してきました。POGZ遺伝子は上述の大規模な全エキソンシークエンスでも突然変異が同定されており、これまでに患者に同定された突然変異数が最も多い遺伝子であることから、自閉症発症のリスクになる可能性が強く示唆されています。しかし、POGZ遺伝子産物の脳における機能、POGZ遺伝子座の突然変異がPOGZの機能に与える影響や自閉症との関連性については未解明でした。
❖ 研究の内容
POGZのマウス脳における機能を解析することを目的として、POGZの発現時期や脳内での発現場所を調べました。その結果、POGZは脳内で神経細胞の産生が盛んに起こる胎児期の胚齢14日から18日にかけて高い発現を示すことがわかりました。興味深いことに、POGZは神経幹細胞*5が多く存在する大脳皮質の脳室帯*6付近に高い発現を示すことがわかりました。これらの結果は、POGZが神経細胞の産生や発達に関与していることを示唆するものです。
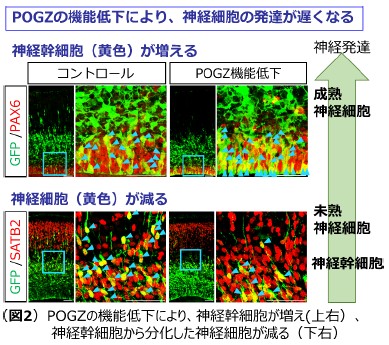
そこで、神経細胞の発達過程におけるPOGZの機能を解明することを目的として、遺伝子ノックダウン法*7を用いて、POGZの脳内での発現量を低下させる実験を実施しました。胚齢14日のマウス胚において、POGZ遺伝子の発現量を下げることによって、その機能を低下させたところ、神経細胞が発達しつつ、大脳皮質の表層に移動する過程が阻害されることが明らかになりました(図2)。また、POGZが遺伝子発現のネットワークを制御することによって、正常な神経細胞の発達に必須の役割を果たしていることを明らかにしました。次に、同様の実験系を用いて、自閉症患者で同定されているPOGZの突然変異が神経細胞の発達にどのような影響を与えているか調べました。その結果、POGZの突然変異により、神経細胞の発達に異常が引き起こされることが明らかになりました。
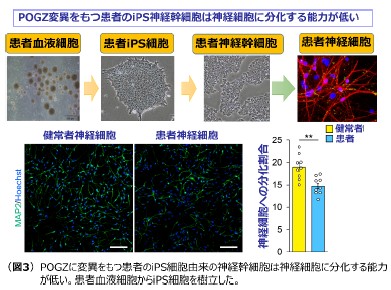
中澤准教授らは、大阪大学大学院医学系研究科精神医学教室を含む多くの研究室との共同研究で、自閉症患者からPOGZの1042番目のアミノ酸部位のグルタミンがアルギニンに置換している突然変異(Q1042R変異)を既に同定しています。次に、実際の患者由来の神経細胞を用いた研究を実施することを目的として、POGZのQ1042R変異を持つ日本人の患者の血液系細胞を用いて、人工多能性幹細胞(iPS細胞)*8を樹立しました。樹立した患者由来のiPS細胞を神経幹細胞および神経細胞に分化させたところ、健常者(両親)由来の細胞に比べて、患者(子ども)由来の神経幹細胞は神経細胞へ分化する能力が低いことが分かりました(図3)。この結果は、POGZの突然変異により、実際の患者神経細胞の発達に異常が生じうることを示しており、患者の脳内でも神経細胞の発達に遅れが見られることを示唆するものです。
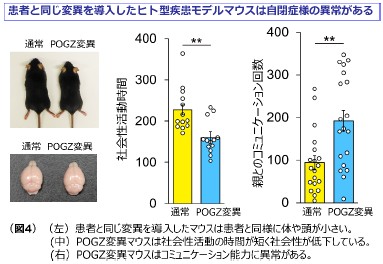
次に、POGZの突然変異による神経細胞の発達異常が個体の脳機能へ与える影響を調べることを目的として、患者と同様のQ1042R変異をPOGZに導入したヒト型疾患モデルマウス(POGZ点変異マウス)を作製しました。POGZ点変異マウスでは、大脳皮質*9の厚さが薄く神経細胞の発達に遅れが見られるとともに、通常のマウスに比べて頭が小さいことが分かりました(図4(左))。これらの異常は、POGZに突然変異をもつ患者では小頭症を併発している症例が多く報告されていることと関連していると考えられます。
更に、POGZの突然変異がマウスの行動に与える影響を解析したところ、POGZ点変異マウスでは、①マウスの社会性行動と考えられている同居マウスに興味を持つ時間が減少している(図4(中))、②コミュニケーション能力と考えられる仔マウスが母マウスを呼ぶために発するcall数(鳴き声)が増えてしまう(図4(右))、といった表現型が観察されました。これらは、自閉症患者の社会性の低下や特定のものに固執するといった症状と関連していると考えられます。また、POGZ点変異マウスの神経回路*10機能が異常に活性化していることから、神経回路の活性を抑えることにより行動異常が回復する可能性が考えられました。実際、神経回路の異常な活性化を抑制するペランパネル(抗てんかん*11薬)の投与により、POGZ点変異マウスの自閉症と関連する行動異常が回復することが明らかになりました。
❖ 本研究成果が社会に与える影響(意義)
神経発達障害の1つである自閉症は人口の約40人に1人が発症する非常に頻度が高い疾患です。近年、その発症割合はますます増加傾向にあることから、自閉症克服の医療ニーズおよび社会的なニーズが高まっています。また、根本的な治療法や中核症状に対する薬物療法は存在しないことから、自閉症の原因や病態の分子メカニズムの解明と、分子メカニズムに基づく創薬が求められています。
本研究は、自閉症患者から同定された遺伝子の突然変異に着目し、実際に変異を持つ患者由来のiPS細胞から分化させた神経細胞と、当該変異を導入したヒト型疾患モデルマウスを統合的に解析するという、世界的に極めて先進的な手法を用いています。本研究成果により、健常者(両親)にはなく、患者(子ども)に突然生じる変異が、自閉症の原因の一つであることが示唆されました。今後、POGZ遺伝子の突然変異が神経細胞の発達異常につながる分子メカニズム、ひいては自閉症発症の原因となるメカニズムを更に詳細に明らかにする研究が重要になります。本研究によりPOGZの突然変異が誘発する神経回路の異常な活性化が自閉症のリスクになること、大人になった後でも薬物による治療が可能である可能性が明らかになったことから、POGZが制御する神経機能を標的とした自閉症の新たな創薬への道が開けたといえます。また、自閉症は、非常に多様な病態や病因が関わっていると考えられており、本研究成果は将来的に、自閉症の発症の分子メカニズムに基づいた疾患の細分類化および患者選択的な治療戦略の構築(テーラーメード医療*12)に貢献することが期待されます。
❖ 用語解説
※1 自閉スペクトラム症(自閉症)
自閉症の症状・病態は多様であるが、根底に共通する特性があると考えられており、それらを総称して自閉スペクトラム症と呼ぶ。
※2 孤発症例
家族に同じ疾患を発症したケースが見当たらない症例のこと。
※3 突然変異
DNAの複製の際などに遺伝子の塩基配列に変化が生じること。自閉症では、健常者の両親には存在せず、子ども(患者)にのみ突然変異が起こる遺伝子が知られている。
※4 全エキソンシークエンス
タンパク質をコードしている遺伝子領域の配列を解析する方法。
※5 神経幹細胞
神経系細胞のもとになる細胞であり、自己複製能と神経系細胞への分化能をもつ。
※6 脳室帯
神経細胞のもととなる神経幹細胞により構成され、大脳皮質を構成する神経細胞が産生される場所。
※7 遺伝子ノックダウン法
特定の遺伝子の転写量や翻訳量を減少させることにより、その遺伝子産物の機能を低下させる方法。
※8 人工多能性幹細胞(iPS細胞)
山中伸弥教授(京都大学)らによって開発された神経細胞を含む多様な細胞に分化でき、かつ自己複製能をもつ細胞。患者から樹立した場合、患者のゲノム情報をそのまま保持した細胞を得ることが可能である。
※9 大脳皮質
脳の表面部分のことであり、人間の思考や感情制御などの中枢である。
※10 神経回路
脳の高次機能の基本単位であり、神経細胞同士の連結によって形成される。
※11 てんかん
神経細胞が過剰な活動を起こすことにより、発作が繰り返し起こる疾患。
※12 テーラーメード医療
患者の情報を調べ、個人個人の体質や病態などに合った医療を提供すること。
❖ 研究者の専門領域
中澤准教授の専門は神経科学であり、大阪大学大学院歯学研究科薬理学教室において、脳高次機能制御の分子メカニズム研究やその破綻による精神疾患発症の分子メカニズム研究に従事しています。また、橋本教授の専門は神経薬理学であり、大阪大学大学院薬学研究科神経薬理学分野において、脳神経科学、脳疾患病態・創薬研究、および脳イメージング研究に従事しています。橋本部長の専門は精神医学であり、国立精神・神経医療研究センターにおいて、精神科医としての診療を行いつつ、精神疾患の臨床研究に従事しています。
❖ 特記事項
本研究成果は、国際的な総合学術雑誌「Nature Communications」の電子版に2月26日(水)(英国時間10時、日本時間19時)に掲載されました。
タイトル:Pathogenic POGZ mutation causes impaired cortical development and reversible autism-like phenotypes.
著者:Kensuke Matsumura, Kaoru Seiriki, Shota Okada, Masashi Nagase, Shinya Ayabe, Ikuko Yamada, Tamio Furuse, Hirotoshi Shibuya, Yuka Yasuda, Hidenaga Yamamori, Michiko Fujimoto, Kazuki Nagayasu, Kana Yamamoto, Kohei Kitagawa, Hiroki Miura, Nanaka Gotoda-Nishimura, Hisato Igarashi, Misuzu Hayashida, Masayuki Baba, Momoka Kondo, Shigeru Hasebe, Kosei Ueshima, Atsushi Kasai, Yukio Ago, Atsuko Hayata-Takano, Norihito Shintani, Tokuichi Iguchi, Makoto Sato, Shun Yamaguchi, Masaru Tamura, Shigeharu Wakana, Atsushi Yoshiki, Ayako M. Watabe, Hideyuki Okano, Kazuhiro Takuma, Ryota Hashimoto, Hitoshi Hashimoto and Takanobu Nakazawa
本研究は、国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域における研究開発課題「神経発達障害の病態解明を目指した革新的イメージングプラットフォーム」(研究開発代表者:岡部繁男)の研究開発分担者(中澤敬信)、脳科学研究戦略推進プログラムの研究開発課題「うつ症状の神経基盤モデルに基づく診断・治療法の開発-皮質・側坐核・中脳系への着目」(研究開発代表者:橋本謙二)の研究開発分担者(橋本均)、革新的技術による脳機能ネットワークの全容解明プロジェクトの研究開発課題「霊長類脳の高速・高精細全脳イメージング技術の開発」(研究開発代表者:橋本均)の研究開発の一環として行われました。
❖ 本件に関する問い合わせ先
<研究内容に関わる件>
大阪大学大学院歯学研究科薬理学教室
准教授 中澤 敬信
大阪大学大学院薬学研究科神経薬理学分野
教授 橋本 均
国立精神・神経医療研究センター 精神保健研究所・精神疾患病態研究部
部長 橋本 亮太
<事業に関わる件>
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
戦略推進部 脳と心の研究課