ライソゾーム関連蛋白を標的とした新規治療法への可能性
2020-03-23 順天堂大学,日本医療研究開発機構
概要
順天堂大学大学院医学研究科神経学の服部信孝教授、波田野琢准教授、王子悠助教ら、および川崎医科大学と長庚大学(台湾)の国際共同研究グループは、ライソゾーム病*1の原因となるプロサポシン*2遺伝子がパーキンソン病*3の発症に関わっていることを発見しました。今回の研究により、遺伝性パーキンソン病の患者におけるプロサポシン遺伝子のサポシン*4D領域に3種類の変異を新たに見出し、孤発性パーキンソン病の患者ではサポシンD領域に2種類の遺伝子多型*5が多いことが分かりました。そして、患者由来のiPS細胞をドパミン神経細胞に分化させたところ、パーキンソン病に特徴的なタンパク質であるαーシヌクレイン*6の蓄積・凝集がみられました。更に、患者と同じ遺伝子変異を持つマウスでは、パーキンソン病によく似た運動障害の症状を示しました。本成果はパーキンソン病の病態解明や新規治療法、新薬の開発に役立ち、疾患克服に向けて大きな一歩になる可能性があります。本成果は英科学雑誌Brain誌(2020年3月23日付)に掲載されました。
本研究成果のポイント
- サポシンD領域の遺伝子変異・遺伝子多型がパーキンソン病に関与することを明らかにした。
- サポシンD領域に遺伝子変異があるパーキンソン病患者由来のiPS細胞で、αーシヌクレインが蓄積・凝集した。
- サポシンD領域の遺伝子変異を導入したマウスは、パーキンソン病の病態モデル動物として有用である。
背景
パーキンソン病は、脳内ドパミンの不足により手足のふるえや動作のしにくさなど特徴的な運動障害の症状や、認知症や便秘などさまざまな症状を起こす神経難病であり、国内には約15万人の患者がいます。最新の研究では、パーキンソン病の発症に遺伝性代謝性疾患であるライソゾーム病の病態メカニズムが関与する可能性が言われていますが、どのように関与するのか詳しいことは分かっていません。そこで本研究では、ライソゾーム病の原因の一つであるプロサポシン遺伝子の変異が、パーキンソン病に関与するのかを明らかにする目的で研究を行いました。
内容
サポシンA~Dはライソゾーム*7で脂質の分解・代謝を行う種々の酵素を活性化するタンパク質(いわばお助け役)であり、細胞内消化器官のライソゾーム内でプロサポシンがサポシンA、B、C、Dの4つに分解されます。サポシンA、B、Cの領域の遺伝子変異がライソゾーム病を起こすことは知られていましたが、サポシンD領域の遺伝子変異がどのような病気を起こすのかはよく分かっていませんでした。そこで、本研究では、国内の290人の家族性パーキンソン病患者のDNAを対象にプロサポシンの遺伝子変異を探索しました。その結果、家族性パーキンソン病の3家系からサポシンD領域の異常を起こす遺伝子変異を発見しました。患者由来のiPS細胞を線維芽細胞*8や中脳のドパミン神経細胞に分化させたところ、ライソゾームの重要な機能であるオートファジー*9に異常があることが分かり、更に、パーキンソン病に特徴的な脳の病理所見として知られる、レヴィ小体*10に含まれるαーシヌクレインの凝集傾向を認めました。これは、本研究で発見したサポシンDの遺伝子変異が原因となり、プロサポシンがライソゾームにうまく運ばれず「小胞体*11」という場所に停滞することで、ライソゾームの機能不良が起こってαーシヌクレインが蓄積・凝集したと考えられます。
次に、孤発性パーキンソン病にもサポシンDの遺伝子変異が関連する可能性を探索するため、日本と台湾の計1105人の孤発性パーキンソン病患者のDNAを解析しました。すると、プロサポシン遺伝子で、サポシンDタンパク質を作るための設計図となる「エクソン」という領域の近くにある「イントロン」という領域において、2か所の遺伝子多型の頻度が多いことが分かりました。更に、サポシンD領域の遺伝子変異を持つマウスを調べたところ、パーキンソン病によく似た運動障害の症状を示し、脳の黒質*12という部分の神経細胞が減少していました。これは、パーキンソン病の状態をモデル動物(マウス)で再現できたことを意味します。
以上の結果から、サポシンDの遺伝子変異や遺伝子多型がパーキンソン病に関係することが分かりました(図)。
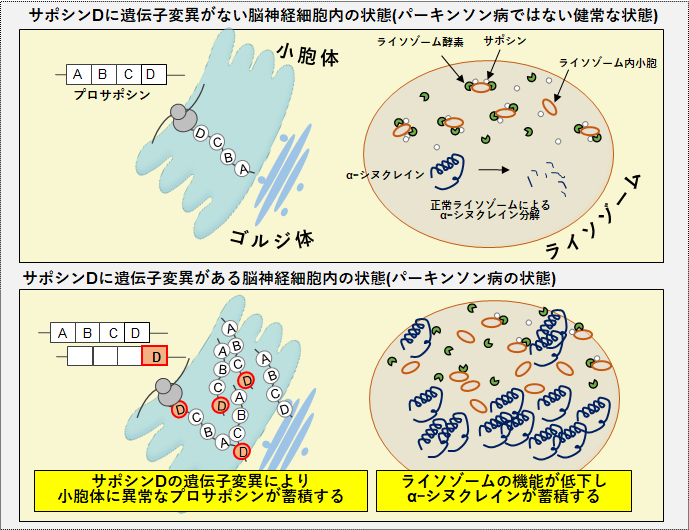
図:本研究で明らかになったサポシンDの遺伝子変異によるパーキンソン病の病態メカニズム上図:健常な状態では、プロサポシンはライソゾームの中で4つのサポシン(A、B、C、D)に分解され酵素補助機能を発揮します。
下図:サポシンD領域に遺伝子変異がある異常なプロサポシン(図中赤色のD)は、小胞体というタンパク質の合成を行う場所で止まってしまい、ライソゾームまでうまく運ばれません。サポシンがきちんと届かないライソゾームでは、サポシンが不足し、ライソゾームの重要な機能が低下してしまいます。そのため、本来ライソゾームで分解されるべきαーシヌクレインが蓄積・凝集してしまう病態メカニズムが考えられます。
今後の展開
研究チームは今回、根本的な治療法がなく原因についても不明な点が多いパーキンソン病の発症メカニズムの一部を解明しました。今回の研究により、オートファジーなど多くの重要な機能を持つライソゾームに関連するサポシンの異常がパーキンソン病に関与することを明らかにできました。今後、サポシンの機能を正常化する薬剤を開発することで、パーキンソン病の根治治療に近づく可能性があります。更に、本研究のモデルマウスはパーキンソン病の状態を再現していることから、新たに開発するパーキンソン病治療薬の効果の確認などに有用なパーキンソン病の病態モデルマウスとして期待できます。
用語解説
- *1 ライソゾーム病:
- ライソゾーム関連蛋白の遺伝子異常によりさまざまな臓器障害を起こす遺伝性疾患。
- *2 プロサポシン:
- ライソゾーム関連蛋白。4つのサポシンの前駆タンパク質。
- *3 パーキンソン病:
- 進行性の運動障害を来たす神経変性疾患。根治治療法は開発されていない。多くの患者は家族に同じ病気はない(孤発性)が、家族にも発症することがあり、その場合は家族性パーキンソン病、もしくは遺伝性パーキンソン病と呼ばれる。
- *4 サポシン:
- ライソゾームで糖や脂質を分解する酵素の活性化に関わる。A、B、C、Dがありそれぞれ対応する酵素がある。その中でサポシンDの詳しい機能は分かっていない。
- *5 遺伝子多型:
- 遺伝子を構成しているDNA配列の個体差。
- *6 αーシヌクレイン:
- レヴィ小体を構成する主要なタンパク質。
- *7 ライソゾーム:
- オートファジーや種々の物質の分解など、細胞環境の調節に重要な細胞内小器官。
- *8 線維芽細胞:
- 皮膚などの結合組織を構成する代表的な細胞。分裂能や分化能を持つ。
- *9 オートファジー:
- 細胞内のタンパク質や細胞内小器官を分解するための仕組みの一つ。
- *10 レヴィ小体:
- パーキンソン病患者の神経細胞に認められるタンパク質の凝集体。病気の特徴とされている。
- *11 小胞体:
- タンパク質の合成や修飾をする膜状の細胞内小器官。
- *12 黒質:
- 中脳にある神経核であり、ドパミンを産生する神経細胞の集まり。ドパミンは分解されるとメラニン色素になるため見た目が黒く、黒質と命名。
原著論文
本研究はBrain誌のオンライン版で(2020年3月23日付)先行公開されました。
- タイトル:
- Variants in saposin D domain of prosaposin gene linked to Parkinson’s disease
- タイトル(日本語訳):
- サポシンDドメインの遺伝子変異体はパーキンソン病に関連する
- 著者:
- Yutaka Oji1, Taku Hatano1, Shin-Ichi Ueno1, Manabu Funayama2, Kei-Ichi Ishikawa1,3, Ayami Okuzumi1, Sachiko Noda1, Shigeto Sato1, Wataru Satake4, Tatsushi Toda4, Yuanzhe Li1, Tomoko Hino-Takai5, Soichiro Kakuta6, Taiji Tsunemi1, Hiroyo Yoshino2, Kenya Nishioka1, Tatsuya Hattori7, Yasuaki Mizutani8, Tatsuro Mutoh8, Fusako Yokochi9, Yuta Ichinose10, Kishin Koh10, Kazumasa Shindo10, Yoshihisa Takiyama10, Tsuyoshi Hamaguchi11, Masahito Yamada11, Matthew J Farrer12, Yasuo Uchiyama2, Wado Akamatsu3, Yih-Ru Wu13, Junko Matsuda5, and Nobutaka Hattori1
- 著者(日本語表記):
- 王子悠1)、波田野琢1)、上野真一1)、舩山学2)、石川景一1)、3)、奥住文美1)、野田幸子1)、佐藤栄人1)、佐竹渉4)、戸田達史4)、日野(高井)知子5)、角田宗一郎6)、常深泰司1)、吉野浩代2)、西岡健弥1)、服部達哉7)、水谷泰彰8)、武藤多津郎8)、横地房子9)、一瀬佑太10)、高紀信10)、新藤和雅10)、瀧山嘉久10)、浜口毅11)、山田正仁11)、Matthew J Farrer12)、内山安男2)、赤松和土3)、Yih-Ru Wu13)、松田純子5)、服部信孝1)
- 著者所属:
- 1)順天堂大学神経学講座、2)順天堂大学大学院老人性疾患病態・治療研究センター、3)順天堂大学大学院ゲノム・再生医療センター、 4)東京大学脳神経内科、 5)川崎医科大学病態代謝学講座、6)順天堂大学大学院医学研究科携帯解析イメージング研究室、7)本町クリニック、8)藤田医科大学脳神経内科、9)東京都立神経病院、10)山梨大学神経内科、11)金沢大学脳神経内科、12)フロリダ大学、13)長庚大学
- DOI:
- 10.1093/brain/awaa064
- URL:
- https://academic.oup.com/brain/article-lookup/doi/10.1093/brain/awaa064
本研究は、JSPS科研費(JP25461290、JP19K17019、JP16H07184、JP24390224、JP18H04043)、文部科学省私立大学戦略的研究基盤形成支援事業、日本医療研究開発機構(AMED)の革新的技術による脳機能ネットワークの全容解明(革新脳)、再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)、「ブレインバンク脳を用いたプロテイノパチーの解析に基づくパーキンソン病修飾薬の研究開発」、ゲノム医療実現推進プラットフォーム事業の研究課題「パーキンソン病に対する真の意味のオーダーメイド治療を目指した研究」 、厚生労働科学研究費補助金難治性疾患政策研究事業の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様に深謝いたします。
お問い合わせ先
研究内容に関するお問い合せ先
順天堂大学大学院医学研究科神経学
准教授 波田野 琢 (はたの たく)
取材に関するお問い合せ先
順天堂大学 総務局 総務部 文書・広報課
担当 長嶋 文乃(ながしま あやの)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部再生医療研究課