2018-05-10 理化学研究所,福島県立医科大学
要旨
理化学研究所(理研)グローバル研究クラスタ疾患糖鎖研究チームの今牧理恵テクニカルスタッフⅠ(研究当時)、北爪しのぶ客員主管研究員(研究当時、現脳神経科学研究センター客員研究員、福島県立医科大学新医療系学部設置準備室教授)、谷口直之チームリーダー(研究当時)、ライフサイエンス技術基盤研究センター微量シグナル制御技術開発特別ユニットの小嶋聡一特別ユニットリーダー(研究当時)、福島県立医科大学看護学部の本多たかし教授らの共同研究グループは、マウスを用いて、血管内皮細胞の細胞膜に発現する接着分子PECAM[1]が持つ糖鎖「α2,6-シアル酸[2]」が、腫瘍の血管新生を調節していることを発見しました。
腫瘍は、一般的に血管内皮増殖因子(VEGF[3])を放出し、腫瘍内部に新たな血管を作ることで酸素や栄養分を得てさらに増大することが知られています。そのため、腫瘍の兵糧攻めを狙い、VEGFとその受容体を標的とした血管新生阻害剤が抗がん剤として開発されています。しかし、期待したほどの効果が得られないことが多く、より効果的な薬剤開発のために腫瘍血管新生に対する理解を深めることが重要です。
今回、共同研究グループは、α2,6-シアル酸を欠損したマウス(ST6GAL1欠損マウス)と野生型マウスに腫瘍細胞を移植し、その後の腫瘍のサイズや腫瘍内の血管新生について調べました。その結果、ST6GAL1欠損マウスでは腫瘍の増殖が野生型マウスと比べて明らかに減退すること、さらにST6GAL1欠損マウスでは腫瘍内部の血管内皮細胞の多くが死ぬことが分かりました。本来PECAMは、α2,6-シアル酸に結合することで細胞同士を接着させると同時に、他の細胞膜上のシグナル分子と機能的複合体を形成して生存シグナルを伝えます。しかし、α2,6-シアル酸が欠損すると、PECAMが細胞表面にとどまれず、結果的に複合体が異常なシグナルを伝えることで、血管内皮細胞が死にやすくなることが明らかになりました。
現在、共同研究グループは、α2,6-シアル酸を模倣した低分子化合物のスクリーニングを行なっています。今後、PECAMの相互的結合を阻害するような選択的化合物を得られれば、新たな血管新生阻害剤の候補になると期待できます。
本成果は、英国の科学雑誌『Oncogene』に掲載されるのに先立ち、オンライン版(5月2日付け)に掲載されました。
背景
日本におけるがんの累積死亡リスクは、2016年には男性で25%、女性で16%であり、男女ともに死亡率、罹患率が年々増加傾向にあります注1)。
腫瘍は、一般的に血管内皮増殖因子(VEGF)を放出し、腫瘍内部に新たな血管を形成することで、酸素や栄養分を得て細胞数を増やし、さらに増大することが知られています。これまで、抗がん剤として血管内皮増殖因子やその受容体の経路を標的とした血管新生阻害剤が開発されてきました。しかし、原発がんには効果がみられるものの、その後のがん転移に対して効果が得られないなどの問題があります。血管新生阻害剤の効果が得られない理由の一つとして、低酸素微小環境下(低酸素でグルコース飢餓状態などのストレス環境)において腫瘍の代謝が再プログラミングされ環境に適応し、腫瘍が増大することが挙げられますが、細胞接着を含む一連の内皮応答も関与していると考えられています。
血管内皮細胞は血管の内腔側を構成する細胞で、内腔側はプロテオグリカン[4]や糖タンパク質由来の糖鎖で一面覆われています。一部の糖鎖は、炎症反応や免疫反応を担う血小板や白血球の接着に関わっています。しかし、血管内皮細胞における接着分子の糖鎖が生理学的・病理学的な血管新生において、どのような役割を担っているかはこれまでほとんど明らかになっていませんでした。
PECAMと呼ばれる糖タンパク質は、血管内皮細胞や血小板などに多く発現している接着分子で、VEGFの受容体であるVEGFR2や接着分子インテグリン[5]などと機能的複合体を形成します。2014年に谷口チームリーダーらは、血管内皮細胞の主要な接着分子PECAMからα2,6-シアル酸が欠損するとPECAM同士の相互作用が失われ、PECAMが伝える生存シグナルが減少し、アポトーシス[6]が上昇することを報告しました注2)。
そこで、共同研究グループは病理学的な血管新生において、α2,6-シアル酸欠損がどのように影響するかを調べました。
注1)国立がん研究センター がん情報サービス「がん登録・統計(最新がん統計)」
注2)Kitazume S, Imamaki R, Kurimoto A, Ogawa K, Kato M, Yamaguchi Y et al. “Interaction of platelet endothelial cell adhesion molecule (PECAM) with alpha2,6-sialylated glycan regulates its cell surface residency and anti-apoptotic role.“ J Biol Chem 2014; 289: 27604-27613.
研究手法と成果
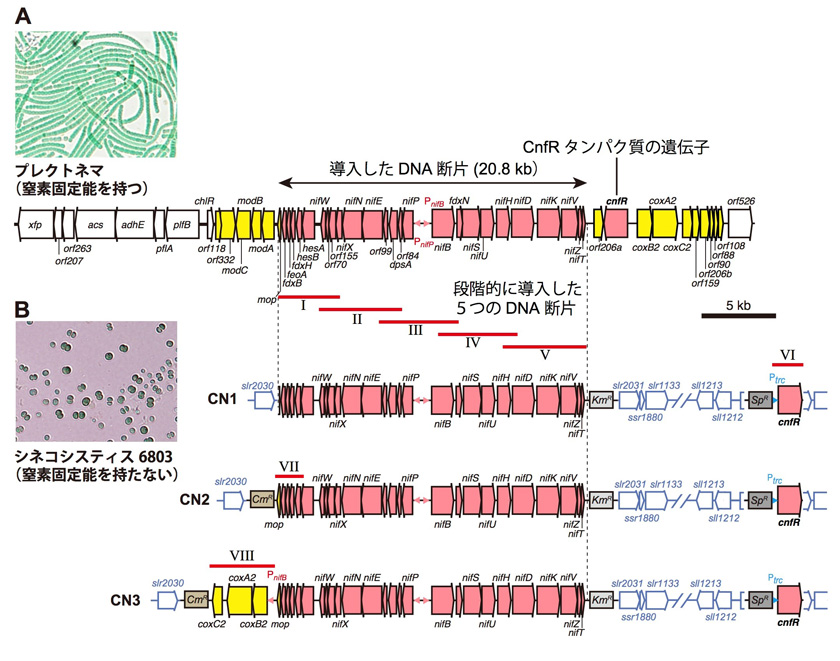
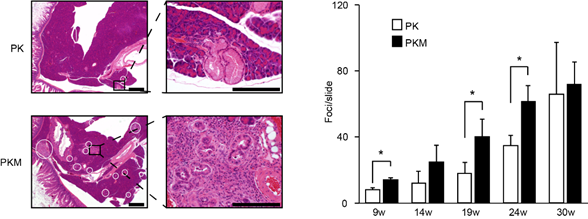
共同研究グループはまず、糖鎖にα2,6-シアル酸を付加する酵素ST6GAL1[2]を欠損したマウス(ST6GAL1欠損マウス)と野生型マウスの皮下に腫瘍細胞を移植し、成長した腫瘍のサイズや腫瘍内の血管新生について調べました。その結果、ST6GAL1欠損マウスにおいて、腫瘍サイズが野生型マウスの腫瘍よりも小さくなることを発見しました(図1左)。また、腫瘍内部の血管を血管マーカーで染色したところ、ST6GAL1欠損マウスでは、腫瘍新生血管が野生型マウスよりも減少していました(図1中)。さらに、この原因としてST6GAL1欠損マウスの腫瘍内の血管内皮細胞で、アポトーシスが亢進していることを確認しました(図1右)。
これらのことから、ST6GAL1が欠損すると腫瘍の新生血管でアポトーシスが上昇し、腫瘍の成長減退が起こることが明らかになりました。
谷口チームリーダーらは、2014年に接着分子PECAMがα2,6-シアル酸依存的に相互作用すること、α2,6-シアル酸が欠損した血管内皮細胞ではPECAM同士が接着できなくなり、十分な生存シグナルを細胞内に伝達できずに細胞が死にやすくなるということを見いだしています。
共同研究グループは、ST6GAL1欠損マウス内の腫瘍内血管でも同様のことが起こっているのではないかと考え、その分子基盤を明らかにするために、血管内皮細胞を用いてPECAMと複合体を形成しているいくつかの分子のシグナル変化を調べました。
まず、VEGFの受容体であるVEGFR2に着目しました。VEGFR2は、血管新生を促進するシグナルを伝達する主要な因子の一つです。α2,6-シアル酸が欠損した場合、あるいは外からα2,6-シアル酸を含む糖鎖(α2,6-シアリル化糖鎖)を加えた場合に、PECAM同士の相互結合が乖離し、膜表面にとどまれなくなりました。その結果、PECAMはVEGFR2と一緒に細胞内に取り込まれ(図2)、異常なシグナルを伝達することが明らかになりました。
また、別の接着分子であるインテグリンについても調べたところ、α2,6-シアル酸が欠損すると、インテグリンを介して異常なシグナルが伝達されることが明らかになりました。
これらをまとめると、ST6GAL1欠損マウスの腫瘍の血管内皮細胞では、細胞膜上でのPECAM同士の相互作用が不安定になり、PECAMのエンドサイトーシス[7](細胞内への取り込み)が起こります。PECAMと機能的複合体を形成している分子も、そのエンドサイトーシスに巻き込まれてPECAMと一緒に細胞内へ取り込まれます。その結果、異常なシグナルが生じ、細胞の状態が増殖よりもアポトーシスに傾くことで、腫瘍内の血管内皮細胞の減少が起こり、腫瘍の増大が減退することが明らかになりました(図3右)。
今後の期待
本研究では、ST6GAL1欠損マウスを用いて、PECAMに付加しているα2,6-シアル酸が腫瘍内血管新生を制御し、腫瘍の増大に大きく関与することを明らかにしました。さらに、ヒトの脳腫瘍内の血管でα2,6-シアル酸が増加することも見いだしており、α2,6-シアル酸は腫瘍内血管の決定的な生存因子の一つであることが示されました。
現在、共同研究グループはα2,6-シアル酸を模倣した低分子化合物を探索しています。将来、PECAMの相互作用を阻害する選択的化合物が得られれば腫瘍の増大を抑制する新たな血管新生阻害剤になると期待できます。
原論文情報
Rie Imamaki, Kazuko Ogawa, Yasuhiko Kizuka, Yusuke Komi, Soichi Kojima, Norihiro Kotani, Koichi Honke, Takashi Honda, Naoyuki Taniguchi and Shinobu Kitazume, “Glycosylation controls cooperative PECAM-VEGFR2-β3 integrin functions at the endothelial surface for tumor angiogenesis”, Oncogene, 10.1038/s41388-018-0271-7
発表者
理化学研究所
グローバル研究クラスタ システム糖鎖生物学研究グループ 疾患糖鎖研究チーム(研究当時)
テクニカルスタッフⅠ(研究当時) 今牧 理恵(いままき りえ)
(現 東京大学医科学研究所 感染・免疫部門 ウイルス病態制御分野 学術支援専門職員)
客員主管研究員(研究当時) 北爪 しのぶ(きたづめ しのぶ)
(現 脳神経科学研究センター 客員研究員、福島県立医科大学 新医療系学部設置準備室 教授)
チームリーダー(研究当時) 谷口 直之(たにぐち なおゆき)
ライフサイエンス技術基盤研究センター 微量シグナル制御技術開発特別ユニット(研究当時)
特別ユニットリーダー 小嶋 聡一(こじま そういち)
(現 生命医科学研究センター 肝がん予防研究ユニット ユニットリーダー)
福島県立医科大学 看護学部 生命科学部門
教授 本多 たかし(ほんだ たかし)
報道担当
理化学研究所 広報室 報道担当
公立大学法人 福島県立医科大学
医療研究推進課 研究推進係
補足説明
-
- PECAM
- 免疫グロブリンスーパーファミリーに属する糖タンパク質。主に血管内皮細胞や血小板に多く発現している接着分子。
-
- α2,6-シアル酸、ST6GAL1
- 酸性糖であるシアル酸がα2,6という結合様式で糖鎖の末端に結合したもの。ST6GAL1は糖転移酵素で、α2,6-シアル酸の糖鎖への付加を担っている。
-
- 血管内皮増殖因子(VEGF)
- 脈管形成および血管新生に関与する一連の糖タンパク質。VEGFは主に血管内皮細胞の細胞膜にある受容体(VEGFR)に結合し、細胞分裂や遊走などを刺激する役割を担っている。また、腫瘍の血管形成や転移など、悪性化の過程にも関与している。VEGFはVascular Endothelial Growth Factorの略。
-
- プロテオグリカン
- タンパク質と多糖の複合体で、保水性が高く長い糖鎖(グリコサミノグリカン)がコアタンパク質に結合したもの。高等多細胞動物にのみ存在する糖タンパク質の一種だが、一般の糖タンパク質にはみられない特徴を持つことからプロテオグリカンの名で区別されている。主に、体全体の組織中の細胞外マトリクス(細胞の外に存在する超分子体)や細胞表面に存在し、コラーゲンやヒアルロン酸とマトリクスを作ることで、身体組織や皮膚の維持の役割を担っている。
-
- インテグリン
- 細胞表面に存在するタンパク質で、細胞と細胞外マトリクスをつなぐ接着因子。α鎖とβ鎖が結合した二量体から成り、細胞外マトリクスや特異的なタンパク質と結合すると、FAKタンパク質がリン酸化され、細胞内にシグナルが伝わる。主な機能は細胞接着や細胞移動である。
-
- アポトーシス
- 細胞死の一種。細胞のシグナル伝達経路を構成するシステインプロテアーゼ(タンパク質分解酵素)であるカスパーゼにより管理・調節された細胞の自殺、すなわちプログラムされた細胞死のこと。
-
- エンドサイトーシス
- 細胞が細胞外の物質を取り込む過程の一つ。細胞膜の一部が物質を包み込むように陥没し、細胞膜から遊離して小胞を形成することで、細胞外の物質を細胞内へと取り込む作用がある。
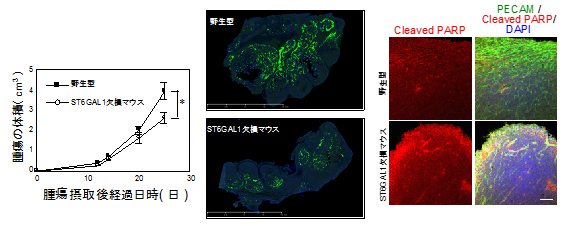
図1 ST6GAL1欠損マウスにおける腫瘍の解析結果
左: 野生型とST6GAL1欠損マウスに腫瘍細胞を移植し、継時的にサイズを計測したところ、ST6GAL1欠損マウスでは腫瘍の大きさが野生型の腫瘍よりも小さかった。
中: 移植した腫瘍内を血管マーカー(VWF : 緑)で染色すると、ST6GAL1欠損マウスの腫瘍は野生型の腫瘍に比べて血管が減少していた。
右: 腫瘍内血管(PECAM : 緑)をアポトーシスマーカー(cleaved PARP : 赤)で染色すると、野生型と比較して、ST6GAL1欠損マウスの腫瘍内血管でのみアポトーシスの上昇が見られた。(DAPI : 青は核マーカー)
図2 PECAM同士の相互作用阻害に伴うPECAM-VEGFR2複合体の細胞内取り込み
左: 血管内皮細胞にα2,6シアリル化糖鎖を添加しない場合。
右: 血管内皮細胞にα2,6-シアリル化糖鎖を添加すると、PECAM-VEGFR2複合体(赤)が細胞内で増加することが分かった。
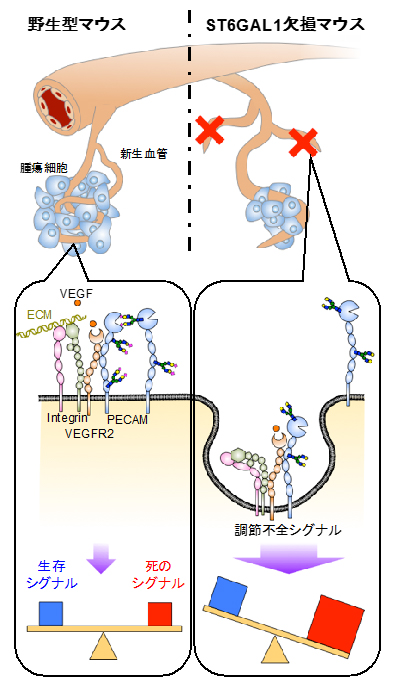
図3 α2,6-シアル酸依存的に腫瘍内血管新生が減少する仕組みの模式図
左: 野生型マウスに腫瘍細胞を移植した場合。
右: ST6GAL1欠損マウスに腫瘍細胞を移植した場合、腫瘍の血管内皮細胞では、細胞膜上でのPECAM同士の相互作用が不安定になり、PECAMのエンドサイトーシス(細胞内への取り込み)が起こる。PECAMと機能的複合体を形成しているインテグリンやVEGFR2もそのエンドサイトーシスに巻き込まれてPECAMと一緒に細胞内へ取り込まれる。その結果、異常な調節不全シグナルが生じ、細胞の状態が増殖よりも細胞死に傾くことで、腫瘍内の血管内皮細胞の減少が起こり、腫瘍の増大が減退する。