B型肝炎や肝臓がんの新しい予防法・治療薬の開発に期待
2018-05-23 理化学研究所,広島大学
理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの中川英刀チームリーダーと広島大学大学院医歯薬保健学研究科消化器・代謝内科学の茶山一彰教授らの共同研究グループ※は、肝臓に感染したB型肝炎ウイルス(HBV)のゲノム解析を行い、HBVのヒトゲノムへの組み込み機序とウイルスによる発がん機構の一部を解明しました。本研究成果は、今後、B型肝炎から発生する肝臓がんに対する新しい治療薬・予防法と新しいウイルス治療薬の開発への貢献が期待できます。
HBVは肝臓がんの主要な原因であり、世界中で年間約88万人がHBVに起因する疾患で死亡していると推定されています注1)。HBVの感染に伴い、肝細胞のヒトゲノムにHBVゲノムの組み込み[1]が起こり、それが肝臓がん発生に寄与すると考えられています。今回、共同研究グループは、HBV感染者の肝臓がんと隣接する肝臓組織、およびHBV感染マウスモデル[2]から抽出したDNAについて、1,600カ所以上の組み込み部位を検出し詳しく解析しました。その結果HBVゲノムが、マウスモデルでは感染早期の3~7週間で主にミトコンドリアゲノム[3]に、ヒトの肝臓がんや隣接肝臓組織では1サンプルあたり1~279箇所も組み込まれていることが分かりました。ゲノム組み込み部位は、クロマチン[4]が開いている領域に多く、肝臓がんでは、特定のがん関連遺伝子に組み込こまれており、これががん化に寄与していると考えられます。さらに、HBVとヒトとの融合遺伝子の発現が確認され、これがHBVの感染成立やがん化と関連があると推測されます。
本研究は、米国の科学雑誌『Oncotarget』に掲載されるのに先立ち、オンライン版(5月18日付け)に掲載されました。
※共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
研究員(研究当時) 古田 繭子(ふるた まゆこ)
広島大学 大学院医歯薬保健学研究科 消化器・代謝内科学
教授 茶山 一彰(ちゃやま かずあき)
東京大学 医科学研究所ヒトゲノム解析センター
教授 宮野 悟(みやの さとる)
和歌山県立医科大学 第2外科
教授 山上 裕機(やまうえ ひろき)
背景
B型肝炎ウイルス(HBV)は、全世界で約3億5,000万人以上が感染しているといわれ、そのうち日本では約130~150万人(約100人に1人)が感染していると推定されています注2)。HBVはヒトとチンパンジーにだけ血液・体液を介して感染し、肝細胞で増殖するという臓器特異性があります。B型肝炎が持続すると、慢性肝炎から肝硬変、さらには肝臓がん(肝細胞がん)へと進展する可能性があり、全世界で毎年88万人が肝がんや肝硬変といった合併症で死亡しています注1)。
B型肝炎の治療には、インターフェロン[5]や核酸アナログ製剤[6]が使われていますが、長期間の投与が必要な上、副作用や耐性ウイルスの出現などの問題があります。また、C型肝炎ウイルス(HCV)に対する治療ほどの効果はなく、日本でも依然多くの患者がHBV感染からの慢性肝炎、それからの肝臓がんの発生に苦しんでいます。
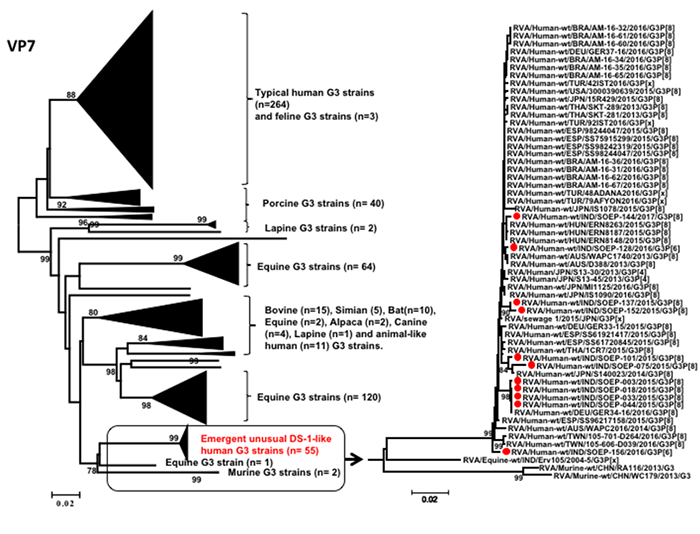
DNAウイルスであるHBVのゲノムは、全長が3,200塩基対程度の環状2本鎖DNAであり、6種類の遺伝子をコードしています(図1)。HBVが肝細胞に感染すると、そのDNAが細胞核に送り込まれ、HBVと肝細胞内のシステムを使って自己複製します。そして、このHBVのゲノムが肝細胞でのヒトゲノム(約30億塩基対)に組み込まれる現象が以前より分かっており注目されてきました。中川チームリーダーらはこれまで、次世代シーケンサー(NGS)[7]を用い、ウイルス性肝臓がんを主とした全ゲノムシークエンス[8]を行ってきました注3)。これらの解析により、肝臓がんにおいてHBVや他のウイルスのヒトゲノムへの組み込み現象を検出しました。このウイルスゲノムの組み込みにより、肝細胞内において、組み込み部位周辺のヒトゲノムが不安定となり、がん関連遺伝子の発現変化を引き起こし、肝臓がんの発生に寄与すると考えられています。
今回、共同研究グループは、ヒトゲノムへのHBVの組み込みとがんとの関連について、詳しいゲノム解析を試みました。
注1)WHOホームページ
注2)一般社団法人日本肝臓学会ホームページ
注3)2016年4月12日プレスリリース「肝臓がん300例の全ゲノムを解読」
研究手法と成果
共同研究グループは、HBV感染者(HBs抗原陽性またはHBV-DNA陽性)の肝臓がん患者から手術によって切除した肝臓がんと隣接する肝臓組織、およびヒト肝細胞を移植してHBVを感染させたマウスモデルの肝臓からDNAを抽出しました(合計111サンプル)。HBVのゲノム配列(約3,200塩基)を特異的に濃縮した後に、NGS技術を用いて大量にHBVのDNA配列を解読し、1,600カ所以上の組み込み部位を検出してそれらを詳しく解析しました。
まず、HBV感染マウスモデルを用いて、HBVゲノム濃縮後のNGS解析の精度の検証を行ったところ、高精度、高感度にHBVのDNA配列を検出できることが証明されました。そして、HBV感染マウスモデルにおいて、HBV感染後に経時的に肝臓組織内のHBVを検出した結果、感染早期の3~7週間でHBVの肝細胞ゲノムへの組み込みが観察され、主にヒト由来のミトコンドリアゲノムに組み込まれていることが分かりました(図2)。
また、ヒト組織でのHBVのゲノム組み込みは、感染肝臓組織では1サンプルあたり1~34カ所、肝臓がんでは1サンプルあたり1~279カ所に観察されました(図3)。HBV組み込み部位は、ヒトゲノムのクロマチン(DNAの折り畳み構造)が開いている領域や早期複製領域である傾向がありました。さらに肝臓がんの場合は、TERT遺伝子[9]やMLL4遺伝子[10]など特定のがん関連遺伝子やそれらのプロモーター領域[11]にHBVゲノムが組み込まれていることが分かりました。これらの組み込みが、がん関連遺伝子の発現上昇につながり、がん細胞の増殖や生存に有利に働き、がん化に寄与していると考えられます。
一方、HBVゲノムについては、感染肝臓組織と肝臓がんともに、HBX遺伝子[12]の下流領域に組み込みの境目が集中しており、HBX遺伝子が組み込み現象にとって重要であると考えられます。さらに、HVBゲノムの組み込みにより、ウイルスとヒトの遺伝子が融合した融合遺伝子の発現が確認され、特に感染肝臓組織においてHBV-FN1の融合遺伝子が多数観測されました(15/41 非腫瘍部肝臓組織)。FN1遺伝子は、細胞外マトリックスであるフィブロネクチン[13]をコードしており、HBVの肝線維化と関連があると推測されます。
今後の期待
HBV感染は、慢性の感染状態(慢性肝炎)の状態から、肝臓の線維化・肝硬変、そして肝がんの発生につながり、それらの治療法は限られています。本研究で得られたHBVのヒトゲノムへの組み込み機序の研究結果は、今後、B型肝炎から発生する肝臓がんの新規の治療薬・予防法、およびミトコンドリアに照準を絞った新しいウイルス治療薬の開発への貢献が期待できます。
原論文情報
Mayuko Furuta, Hiroko Tanaka, Yuichi Shiraishi, Takuro Unida, Michio Imamura, Akihiro Fujimoto, Masahi Fujita, Aya Sasaki-Oku, Kazuhiro Maejima, Kaoru Nakano, Yoshiiku Kawakami, Koji Arihiro, Hiroshi Aikata, Masaki Ueno, Shinya Hayami, Shun-ichi Ariizumi, Masakazu Yamamoto, Kunihito Gotoh, Hideki Ohdan, Hiroki Yamaue, Satoru Miyano, Kazuaki Chayama, and Hidewaki Nakagawa, “Characterization of HBV integration patterns and timing in liver cancer and HBV-infected liver”, Oncotarget, 10.18632/oncotarget.25308
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- HBVゲノムの組み込み
- ウイルスゲノムの組み込みとは、ウイルスのDNA配列がヒトのゲノム配列の入り込む現象のことを指す。HBVの場合、まずウイルスに感染した正常肝臓組織においてHBVゲノム組み込みが起こり、それが契機となってがん化が起こり、がん化に伴いがん細胞にも引き継がれると考えられている。
-
- HBV感染マウスモデル
- HBVはヒトの肝臓にのみ感染するため、HBV感染のモデルには、ヒトの肝臓細胞を移植して生着する特殊なマウスが用いられる。このマウスにHBVを感染させ、経時的に肝細胞を採取し、その中に増殖したHBVを解析する。
-
- ミトコンドリアゲノム
- ミトコンドリアは、細胞に必要なエネルギーを取り出す呼吸機能を担う細胞内小器官。ミトコンドリアは細胞内に数百個以上存在し、ミトコンドリア内にも約16,000塩基対ほどのゲノムが存在する。ミトコンドリアゲノムは、呼吸機能をつかさどる酵素など37個の遺伝子をコードしている。HBVは、感染した際にミトコンドリアに作用するという報告がある。
-
- クロマチン
- 2重DNA鎖は、細胞内ではさまざまな修飾が加わった上で、ヒストンタンパク質の周りに巻き付き、折り畳まれている。この構造をクロマチンという。RNAへの転写、DNAの複製、DNAの修復の際には、この折り畳み構造がほぐれて、2重DNA鎖は露出して、さまざまな分子や外来物が直接作用できる状態になる。
-
- インターフェロン
- インターフェロンは、生体がウイルスに感染したときに細胞が反応して作られるタンパク質で、ウイルスを攻撃したり増殖を抑制したりする働きがある。それを薬として体内に入れることでウイルス感染を治療する。
-
- 核酸アナログ製剤
- HBVの複製に必要なDNA(核酸)ポリメラーゼを阻害し、HBVの増殖を抑える抗ウイルス作用を示す。
-
- 次世代シークエンサー(NGC)
- ヒトゲノムの全配列約30億塩基を1,000米ドル以下のコストで解読すべく、欧米の政府や企業が技術開発を行った結果、より高速高精度の性能を持つシーケンサーが開発された。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができる。
-
- 全ゲノムシーケンス
- 次世代シーケンサーを使って、個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定すること。全ゲノムシーケンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能で、究極のゲノム解析手法といえる。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。
-
- TERT遺伝子
- 染色体の末端構造を維持するための酵素をコードしている。細胞の不死化に重要な役割を担っており、肝臓がんではTERT遺伝子のプロモーター領域のポイント変異や構造異常、ウイルスの組み込みなどのさまざまな変異により発現が上昇する。
-
- MLL4遺伝子
- ヒストン修飾酵素をコードしており、クロマチン構造や遺伝子発現の制御に関わっている。さまざまな腫瘍で変異が観察されているが、そのがんでの詳細な機能は不明である。
-
- プロモーター領域
- 遺伝子の転写開始付近に位置して、遺伝子を発現させる機能を持つ塩基配列。プロモーターがないと遺伝子は発現しない。
-
- HBX遺伝子
- HBVゲノムがコードする遺伝子の一つ。HBVX遺伝子より転写・翻訳されるXタンパク質(HBx)は、HBVの細胞内複製に関わる遺伝子(ウイルスとヒト細胞)の活性化に関わる。HBxを高発現するマウスで発がんが認められることから、直接、がん化にも関わると考えられている。
-
- フィブロネクチン
- 細胞接着分子として細胞の細胞外マトリックスへの接着、結合組織の形成・保持、創傷治癒、血液凝固などの生命機能を支える多くの機能がある。フィブロネクチンは線維芽細胞と肝細胞から多く産出され、その発現異常、分解、器質化は、がんや線維化など疾患と関連している。
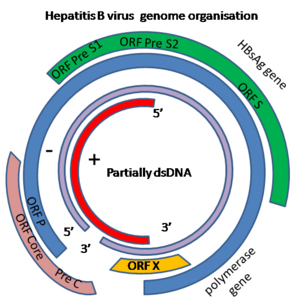
図1 B型肝炎ウイルス(HBV)ゲノムがコードする遺伝子
HBVのゲノムは3,200塩基対ほどで、ウイルスの外枠タンパク質(HBs抗原)やゲノム複製酵素など6個の遺伝子をコードしている。
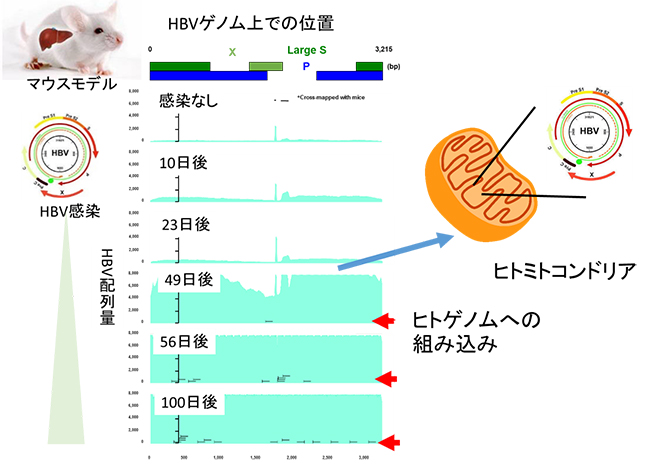
図2 HBV感染マウスモデルにおけるHBVのヒト肝臓への組み込み時期
ヒトの肝臓を移植したマウスにHBVを感染させて、10日後、23日後、49日後、56日後、100日後に肝臓組織を採取し、NGSによりHBVのDNA配列の検出を行った。薄緑青は、HBVのゲノム配列の位置ごとに検出したHBVの配列量を示す。49日後の肝臓にて、ヒトゲノムへの組み込みを示す配列が検出され(赤矢印)、その多くがヒトのミトコンドリアゲノムへの組み込みであった。
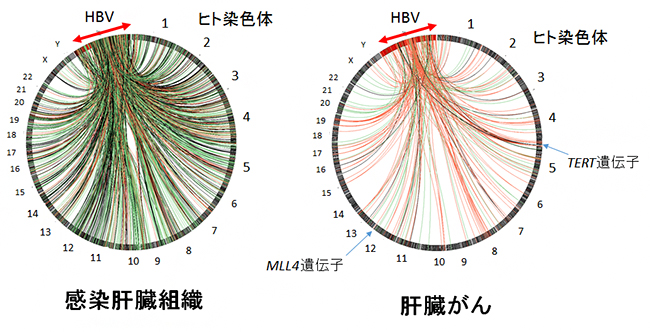
図3 HBVゲノムのヒトゲノムへの組み込み
ヒトのHBV感染者の肝臓がんに隣接する感染肝臓組織と肝臓がんでの組み込み部位の分布。ヒトの染色体(1番から22番、X、Y染色体)とHBVのゲノムを環状につないで、組み込みが起こっている部位は、HBVの配列と線でつながるように示している。感染肝臓組織では、ゲノム上の比較的ランダムに組み込み部位が分布しているが、肝臓がんではがん関連遺伝子のTERT遺伝子やMLL4遺伝子などの好発部位が存在する