2020-07-17 京都大学iPS細胞研究所
ポイント
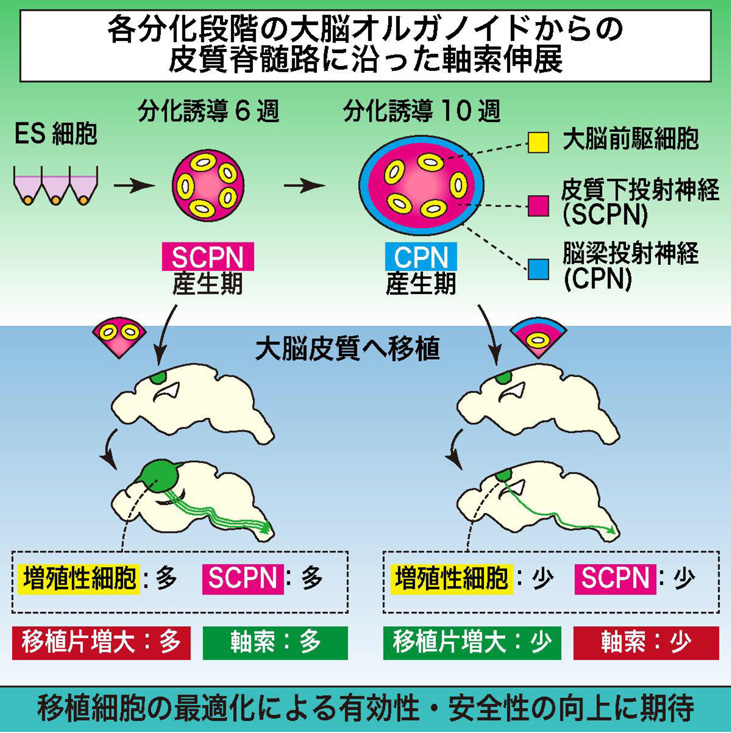
- ヒトES細胞由来の大脳オルガノイド注1)をマウス大脳皮質に移植し、皮質脊髄路注2)に沿った軸索注3)伸展がみられることを明らかにした。
- 分化の前期段階の大脳オルガノイドでは後期段階のものと比べて細胞増殖による移植片増大がより顕著であったが、より多くの軸索伸展が確認された。
- 脳損傷モデルへの移植では、損傷直後よりも損傷1週間後の移植のほうがより多くの軸索伸展が確認された。
1. 要旨
北原孝宏大学院生(CiRA臨床応用研究部門、京都大学大学院医学研究科脳神経外科学)、坂口秀哉元研究員(元CiRA同部門、現理研BDR-大塚製薬連携センター)、髙橋淳教授(CiRA同部門)らの研究グループは、ヒト胚性幹細胞(ES細胞)から分化誘導した大脳オルガノイドをマウスの大脳皮質に移植することにより、神経細胞が皮質脊髄路に沿って軸索を伸展させることを明らかにしました。分化前期段階の大脳オルガノイドのほうがより多くの軸索を伸展させましたが、未分化な細胞がより多く含まれるため移植片のサイズが大きくなることも分かりました。また、脳損傷モデルへの移植では、損傷直後より損傷1週間後に移植したほうがより多くの軸索伸展がみられることを確認しました。これらの結果は、脳血管障害や頭部外傷に対する細胞移植治療の可能性と課題を示すと考えられます。
この研究成果は、2020年7月17日 (日本時間)に米国科学誌「Stem Cell Reports」でオンライン公開されました。
概要図
2. 研究の背景
皮質脊髄路は、大脳皮質の運動野から脊髄に至る軸索の伝導路で、身体を動かす運動機能の情報を伝達しています。脳血管障害や頭部外傷によって皮質脊髄路が障害されると、手足の麻痺などの後遺症が生じてしまいます。この後遺症に対しては、薬物治療やリハビリテーションなどの治療はあるものの根本的な治療は存在しないため、将来的な治療として細胞移植による皮質脊髄路の再構築に期待が寄せられています。これまでのマウス等のげっ歯類を用いた研究では、障害を受けた大脳皮質にマウス胎仔大脳皮質の細胞を移植すると移植した細胞が皮質脊髄路に沿って軸索を伸ばし運動機能が改善することが示されていますが、ヒトへの応用に向けては胎仔大脳皮質に代わる移植細胞の開発が必要です。
近年、胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)などの多能性幹細胞から生体組織と同様の構造と機能を持った3次元組織を分化誘導することが可能となり、このような組織はオルガノイドと呼ばれています。ヒトES/iPS細胞から作製された大脳オルガノイドは、大脳に関連する疾患を対象とした疾患モデルや創薬スクリーニングにおける有用性が報告されると同時に、細胞移植への応用についても注目されています(CiRAニュース:2019年6月28日「大脳オルガノイドを用いた同期発火を有する機能的な神経ネットワークの創出と、その評価方法の確立」)。しかし、大脳オルガノイドの移植によって皮質脊髄路に沿った軸索伸展がみられるかどうかはこれまで検討されていませんでした。また、大脳オルガノイドは分化誘導の段階に応じて細胞構成が変化しますが、どの段階が移植に適しているかもこれまで不明でした。
そのため本研究グループは、ヒトの大脳オルガノイドをマウス大脳皮質に移植することによって皮質脊髄路に沿った軸索伸展がみられるかどうかを検討しました。また、大脳オルガノイドの分化段階の違いが移植後の生着や軸索伸展にどのような影響をもたらすかを検討しました。さらに、ホスト脳環境の違いによる軸索伸展への影響についても検討を加えました。
3. 研究結果
1) 神経産生の前期と後期に該当する大脳オルガノイドの培養時期の同定
研究グループは、多能性幹細胞から大脳組織を3次元で効率よく誘導する方法として知られている無血清凝集浮遊培養法(SFEBq法)注4)を用いて、ヒトES細胞から大脳オルガノイドを分化誘導しました。
大脳の発生における神経産生では、大脳皮質外へ軸索を伸ばす皮質下投射ニューロン(SCPN)が前期に産生され、大脳皮質内へ軸索を伸ばす脳梁投射ニューロン(CPN)が後期に産生されます。この神経産生の順序は、大脳オルガノイドにおいても再現されることが知られています。分化誘導開始6週間後の大脳オルガノイド(6週オルガノイド)では、神経細胞層にSCPNマーカーであるCTIP2を発現する細胞が認められた一方で、CPNマーカーであるSATB2を発現する細胞はまだ認められませんでした。分化誘導開始10週間後の大脳オルガノイド(10週オルガノイド)では、神経細胞層が厚みを増し、CTIP2+細胞に加えてSATB2+細胞も認められました(図1)。
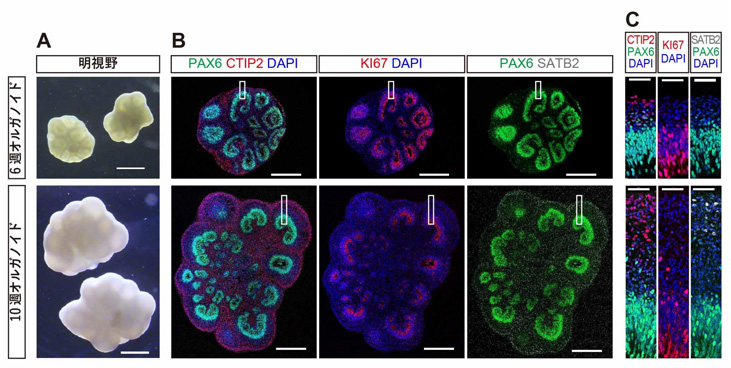
図1:6週オルガノイド(上段)と10週オルガノイド(下段)
A:実体顕微鏡での明視野像(均一な光で照らし、透過した光を観察した像)。
B:免疫染色像。6週オルガノイド(上段)では、CTIP2+の皮質下投射ニューロン(SCPN)は既に認められるが、SATB2+の脳梁投射ニューロン(CPN)はまだ産生されていない。
10週オルガノイド(下段)ではSATB2+のCPNも認められる。
C:Bの白四角で囲まれた部分の高倍率像。
スケールバーは、A:1 mm、B:500 µm、C:50 µm。
6週オルガノイドと10週オルガノイドはそれぞれ神経産生の前期(SCPN産生期)と後期(CPN産生期)に該当すると考えられ、この2つの時期の大脳オルガノイドを移植して比較検討を行うことにしました。
2) 大脳オルガノイドのマウス大脳皮質への生着と軸索伸展
6週または10週オルガノイドをマウス大脳皮質に移植したところ、移植12週間後の時点で6週オルガノイドの方がより大きな移植片を形成しました。大脳オルガノイドの内部に含まれる増殖性細胞(Pax6+の大脳前駆細胞、KI67+の分裂細胞)を調べると移植前、移植後ともに6週オルガノイドの方がより多くの増殖性細胞を含んでおり、このことが移植片増大の原因と考えられます(図2A-B)。
一方、マウスの皮質脊髄路の各部位(線条体、内包、大脳脚、脊髄)に伸びた軸索本数を調べると、6週オルガノイドの方がより多くの軸索を伸ばしていました。大脳皮質に存在する投射ニューロンの中で、皮質脊髄路へ軸索を伸ばすのはCTIP2+のSCPNであることが知られています。マウス大脳皮質に生着した移植片に含まれるCTIP2+細胞を調べると、6週オルガノイドの方が10週オルガノイドよりも多くのCTIP2+細胞を有していました。このことが軸索本数の違いに影響していると考えられます(図2C-D)。
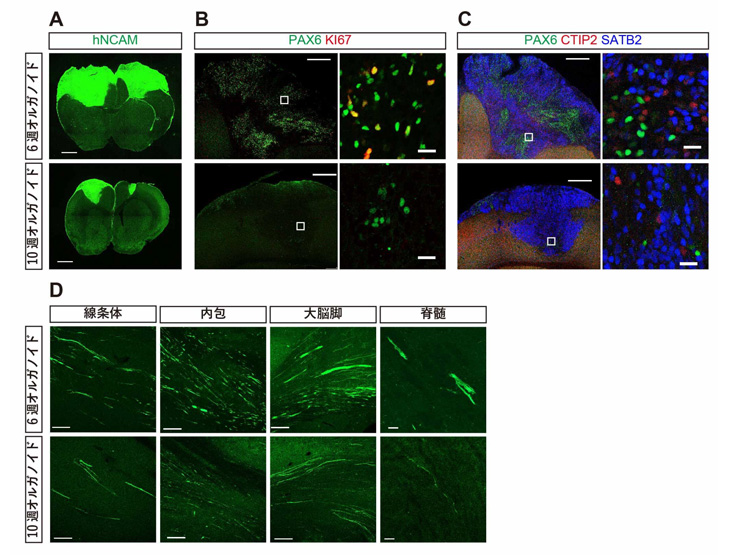
図2:6週オルガノイド(上段)と10週オルガノイド(下段)のマウス大脳皮質への生着と軸索伸展
A:ヒト特異的神経細胞接着分子(hNCAM)で免疫染色された、生着した大脳オルガノイド。
6週オルガノイドでは移植片増大がより顕著であった。
B:生着後の増殖性細胞(Pax6+の大脳前駆細胞、KI67+の分裂細胞)。
右:左の白四角で囲まれた部分の高倍率像。6週オルガノイドは増殖性細胞をより多く含んでいた。
C:生着後のCTIP2+の皮質下投射ニューロン(SCPN)とSATB2+の脳梁投射ニューロン(CPN)。
右:左の白四角で囲まれた部分の高倍率像。
6週オルガノイドはCPNをより多く含んでいた(赤色染色部分)。
D:hNCAMで免疫染色された、大脳オルガノイドから皮質脊髄路に沿って伸展した軸索。6週オルガノイドの方がより多数の軸索を伸展していた。
スケールバーは、A:1 mm、BとCの左列:500 µm、BとCの右列:20 µm、
Dの線条体・内包・大脳脚:100 µm、Dの脊髄:20 µm。
以上より、大脳オルガノイドの移植は皮質脊髄路に沿った軸索伸展をもたらし、皮質脊髄路の再構築に有用な可能性があることが示されました。特に6週オルガノイドはCTIP2+細胞を多く含み皮質脊髄路の再構築に寄与すると期待されますが、未分化な増殖性細胞の残存が課題であることも明らかとなりました。
3) ホスト脳環境による軸索伸展への影響
脳梗塞や頭部外傷に対する細胞移植では大脳皮質が損傷を受けてから時間が経過した後で移植を行うことになりますが、この時間経過に伴うホスト脳環境の変化が移植細胞からの軸索伸展に影響する可能性があります。そこで10週オルガノイドを用いて大脳皮質損傷直後と1週間後に移植した場合を比較したところ、1週間後に移植した場合の方がより多くの軸索伸展が認められました。
以上より、大脳オルガノイドの移植において、ホスト脳環境の変化に伴って皮質脊髄路に沿った軸索伸展が促進されることが示されました。今後、軸索伸展を促進する具体的な因子が明らかになれば、その因子の添加により大脳オルガノイドからの軸索伸展を促進できると考えられます。
4. 本研究の意義と今後の展望
本研究によって、ヒトES細胞由来大脳オルガノイドのマウス大脳皮質への移植によって皮質脊髄路に沿った軸索伸展が得られることが明らかとなりました。この結果から、脳梗塞や頭部外傷による皮質脊髄路障害に対して、大脳オルガノイドを用いた細胞移植による皮質脊髄路再構築が有効なアプローチとなる可能性が示されました。また、移植する大脳オルガノイドの分化段階やホスト脳の損傷後の時間帯により、移植片のサイズや軸索伸展に違いが生じることが分かりました。これらの結果から、移植細胞やホスト脳環境を最適化することにより大脳オルガノイド移植の有効性と安全性を高めることができると考えられます。
5. 論文名と著者
- 論文名
Axonal Extensions along Corticospinal Tracts from Transplanted Human Cerebral Organoids - ジャーナル名
Stem Cell Reports - 著者
Takahiro Kitahara1,2, Hideya Sakaguchi1,*, Asuka Morizane1, Tetsuhiro Kikuchi1, Susumu Miyamoto2, Jun Takahashi1,2,*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)臨床応用研究部門
- 京都大学大学院医学研究科脳神経外科学
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患・組織別実用化研究拠点A」
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 基盤研究 (B) (17H04302)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費基金 若手研究 (18K15046)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 研究活動スタート支援 (16H06897)
- 日本学術振興会(JSPS)特別研究員PD (17J10294)
7. 用語説明
注1)オルガノイド
多能性幹細胞や組織幹細胞から分化誘導された3次元組織で、生体で認められるような構造や機能を保持しているもののこと。神経領域では、大脳、神経網膜、小脳、海馬、中脳、視床、脊髄などの領域が報告されており、神経以外では、腎臓、胃、肝臓、腸管などのオルガノイドが報告されている。
注2)皮質脊髄路
大脳皮質からの情報を、脊髄の神経細胞へ伝達する伝導路。大脳皮質の運動野の神経細胞の軸索で構成され、身体の運動機能の情報を伝達する。
注3)軸索
神経細胞が伸ばす細長い突起で、他の神経細胞や筋肉へ情報を伝達する働きを持つ。
注4)無血清凝集浮遊培養法(SFEBq法)
ES細胞などの多能性幹細胞を酵素により分散した上で、3,000-9,000個程度の細胞の塊に再凝集させた細胞凝集塊を、血清や転写因子などの神経分化阻害効果のある成分を含まない培養液に浮遊させて培養することで、3次元で神経組織への分化誘導を可能とする、神経分化誘導法の一つ。