2020-07-20 名古屋大学,国立がん研究センター
名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学の西川 博嘉 教授(国立がん研究センター研究所 腫瘍免疫研究分野長、同センター 先端医療開発センター 免疫TR分野長併任)らのグループは、胃がんの約5-10%に認められるRas homolog family member A (RHOA)遺伝子変異*1が、腫瘍微小環境の免疫細胞の浸潤に関わるケモカイン*2と、代謝環境に影響を及ぼすことでがん細胞を殺傷する細胞傷害性T細胞*3や制御性T細胞*4の集積をコントロールし、がん免疫療法*5への耐性を導くことを明らかにしました。
胃がん患者の多くは抗PD-1抗体*6治療に抵抗性を示すことが報告されています。 この治療抵抗性機構を解明するために、研究グループは胃がん検体を用いて腫瘍内の免疫状態を詳細に検討しました。その結果、胃がんの腫瘍中に、抗腫瘍免疫を抑える働きがある制御性T細胞が多く存在する一群が存在することがわかりました。また、網羅的遺伝子解析により、この群には胃がんのドライバー変異として知られるRHOA遺伝子の体細胞変異が多く存在していることが明らかになりました。 RHOA変異陽性がん細胞が産生する遊離脂肪酸は細胞傷害性T細胞より制御性T細胞によって効率的に取り込まれることで、腫瘍内の制御性T細胞の増加に寄与していました。一方、RHOA変異はPI3K-AKTシグナル伝達経路*7を活性化することにより、細胞傷害性T細胞を引き寄せるケモカインの生成を低下させました。 その結果、RHOA変異胃がんは、制御性T細胞が多く集簇し免疫応答が弱い腫瘍環境を形成していました。
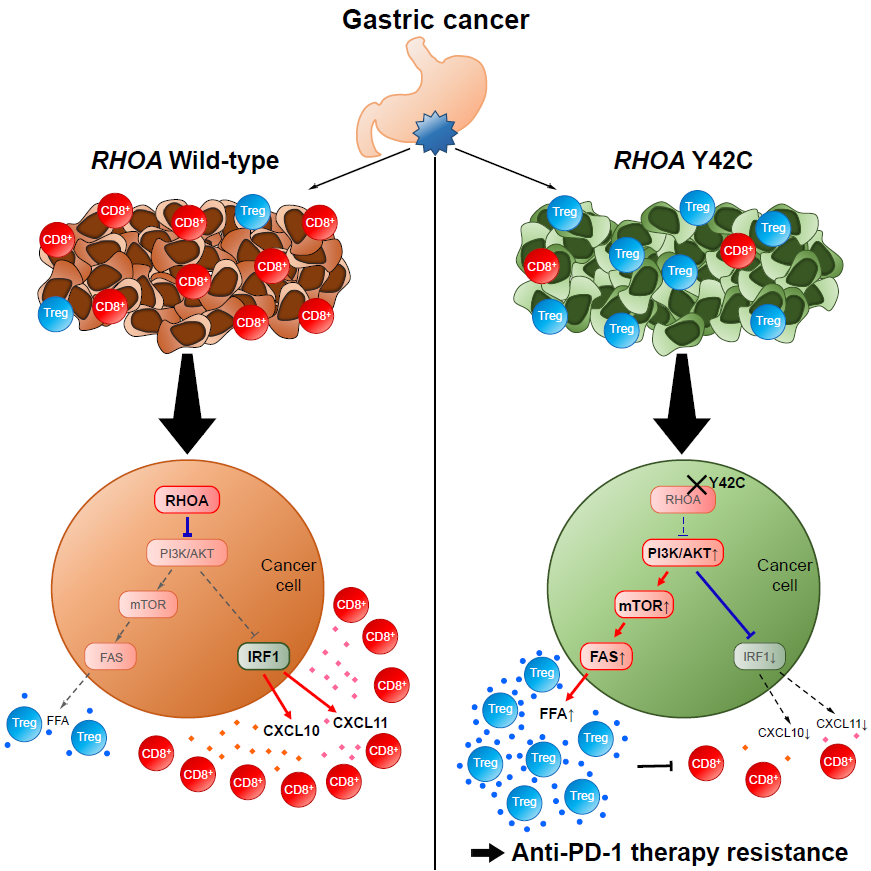
これらのデータからPI3K阻害薬*8と抗PD-1抗体を併用することで、免疫抑制的な腫瘍環境が改善され、抗腫瘍効果が増強することが明らかになり、新たながん免疫併用療法の可能性が示されました。本研究成果は、今後がん免疫療法を受ける患者さんにおいて、治療効果の改善につながることが予想されます。
本研究成果は2020年7月7日付米国科学雑誌「Immunity」電子版に掲載されました。
ポイント
- 胃がんに対する抗PD-1抗体治療は、科学的に有効性が証明され臨床現場で使用されていますが、患者さんによって薬の効果に差があり、治療の効果予測バイオマーカーに基づく治療の最適化が求められています。
- 本研究では、胃がん腫瘍内の免疫状態を評価し、その免疫抑制環境が引き起こされるメカニズムを解明しました。
- その結果、特にRHOA変異胃がんでは抗PD-1抗体とPI3K阻害剤とのがん免疫療法の併用により、良好な治療効果が得られる可能性を示しました。
1.背景
抗PD-1抗体治療は、胃がんを始めとした様々ながん種に奏効することが報告されています。しかし、胃がんに対する抗PD-1抗体治療の奏効率は悪性黒色腫や肺がんに比べて低いことを考慮すると、胃がんではより強い免疫抑制性の腫瘍環境が形成されている可能性があります。従って、本研究では、抗腫瘍免疫応答の中心的役割を担う細胞傷害性T細胞と免疫応答を抑制する働きのある制御性T細胞とのバランスなどの胃がん腫瘍内の免疫状態を評価し、その免疫抑制環境が引き起こされるメカニズムを解明し、新規がん免疫併用治療の開発の可能性を明らかにしました。
2.研究成果
胃がん手術検体の遺伝子発現のデータを、免疫応答に関わる遺伝子セットを用いてクラスタリングしました。腫瘍に浸潤するリンパ球のフローサイトメトリー*9による解析結果と統合すると、制御性T細胞が多く浸潤する一群の中に、エフェクター免疫細胞による免疫応答が強い群と免疫応答が弱い群が存在することが明らかになりました。免疫応答が弱く制御性T細胞が多く浸潤している一群の中で、半数がRHOA Y42C変異を持つことが判明しました(図1)。
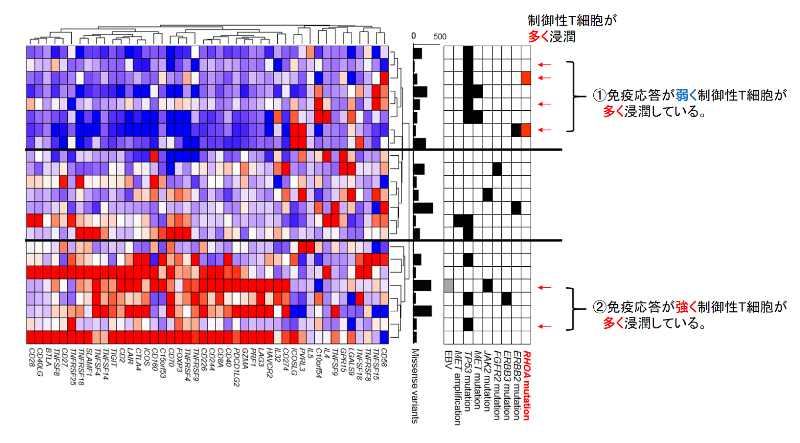
図1. 胃がん手術検体の免疫関連遺伝子発現解析とフローサイトメトリー解析の統合的検討
胃がん手術検体の遺伝子発現のデータを免疫応答に関わる遺伝子セットを用いてクラスタリングし、腫瘍に浸潤するリンパ球のフローサイトメトリーによる解析結果と統合解析しました。
免疫応答関連遺伝子によるクラスタリングと腫瘍浸潤リンパ球の統合解析の結果から、RHOA変異を持つ胃がんではエフェクター免疫応答が十分に誘導されていないとともに、制御性T細胞が多く浸潤している可能性があると考えました。そこで新たに進行胃がん症例の腫瘍浸潤リンパ球を解析したところ、RHOA Y42C変異胃がんの腫瘍微小環境ではCD8陽性T細胞に比べて制御性T細胞が多く浸潤し、免疫抑制機能を司るCTLA-4発現が高いことが判明しました(図2)。
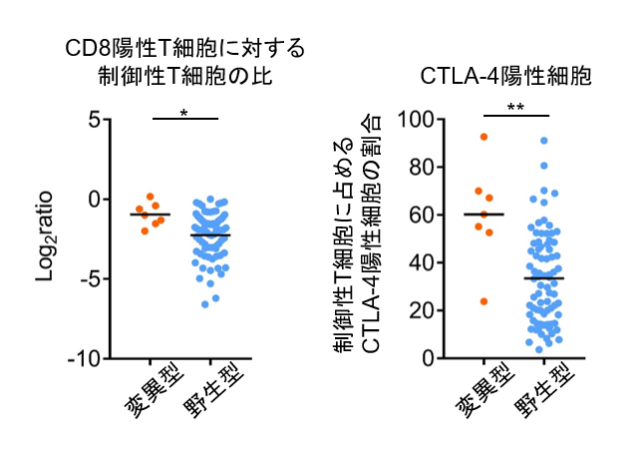
図2. RHOA遺伝子変異の有無による胃がん浸潤リンパ球のフローサイトメトリー解析の比較検討
胃がんに浸潤するリンパ球をフローサイトメトリーを用いて解析し、CD8陽性T細胞と制御性T細胞の比や制御性T細胞上のCTLA-4発現をRHOA変異型と野生型で比較検討しました。
続いてなぜRHOA Y42C変異腫瘍では抗腫瘍免疫応答が起きにくくなっているのかを検討しました。胃がん細胞株であるMKN1にRHOA野生型とRHOA Y42C変異を強制発現させたところ、RHOA Y42C変異強制発現株では活性化型RHOAの発現が低下している(RHOAシグナルが低下している)ことが判明しました。マイクロアレイ*10にて遺伝子発現を網羅的に解析したところ、CD8陽性T細胞を誘導することが知られているCXCL10/CXCL11の発現がRHOA Y42C変異強制発現株で低下していることが判明しました。この結果は胃がん患者の臨床検体でも検証されました(図3)。
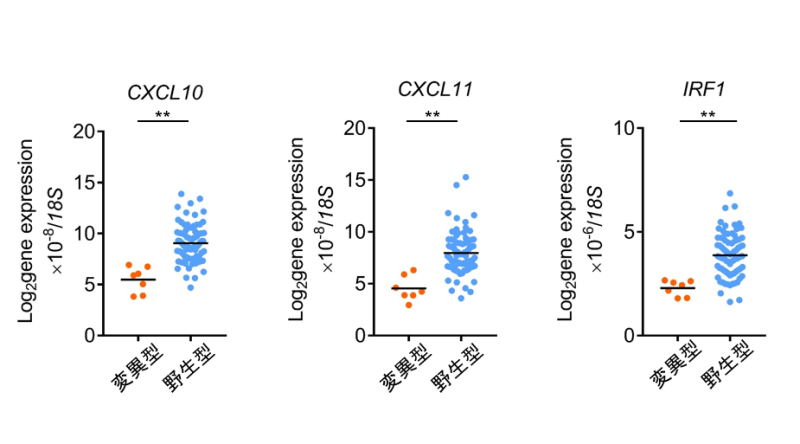
図3. RHOA遺伝子変異の有無による胃がんにおけるケモカイン関連遺伝子発現の比較検討
Quantitative real-time PCRを用いて胃癌におけるケモカイン関連遺伝子発現をRHOA変異型と野生型で比較検討しました。
次に、RHOA Y42C変異でこれらのケモカイン発現が低下するメカニズムを検討しました。RHOA野生型とRHOA Y42C変異強制発現株の網羅的遺伝子発現の結果を解析したところ、CXCL10/CXCL11発現を制御することが知られているIRF1発現がRHOA Y42C変異強制発現株で低下していることが判明し、転写調節によりCXCL10/CXCL11発現が低下していることが明らかになりました。この結果は胃がん患者の臨床検体でも検証されました(図3)。IRF1発現低下についてより詳細に検討したところ、RHOA Y42C変異ではPI3K/AKT経路が活性化することで、IRF1発現が低下することが判明しました(図4)。
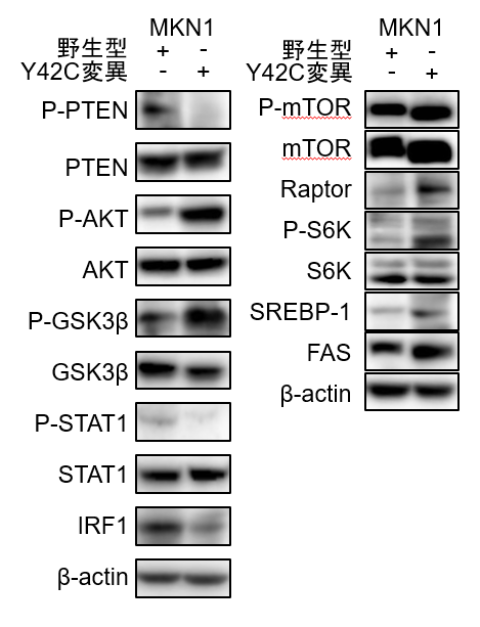
図4. RHOA野生型とY42C変異強制発現細胞株におけるタンパク発現の比較検討
RHOA野生型とY42C変異強制発現細胞株を用いて、PI3K/AKT経路のタンパク発現を比較検討しました。
続いてRHOA Y42C変異でなぜ制御性T細胞が多く浸潤するかを検討しました。臨床検体の遺伝子発現を解析し、変動が大きい遺伝子を検索したところ、RHOA変異胃がんで脂肪酸代謝に関わる遺伝子群が増加しました。その遺伝子群の中で、脂肪酸合成に深くかかわるFASN遺伝子発現がRHOA Y42C変異強制発現株で有意に高い結果となり、培養上清の脂肪酸濃度も有意に上昇していました。RHOA Y42C変異によりPI3K/AKT/mTOR経路を介し(図4)、脂肪酸合成が有意に亢進することが判明しました。
また、マウスの消化管由来のがん細胞株であるMC-38をマウスに皮下移植し、腫瘍浸潤リンパ球を解析し、各リンパ球サブセットと制御性T細胞の脂肪酸代謝にかかわる分子発現を比較したところ、制御性T細胞において脂肪酸取り込みが上昇し、脂肪酸代謝に関わる分子の発現が亢進していることが判明しました(図5)。この結果は、臨床検体でも検証されました。
以上よりRHOA Y42C変異胃がんでは、がん細胞が脂肪酸を多く生成することで、他のリンパ球に比較して制御性T細胞が生存・機能しやすい環境を作り、制御性T細胞優位の環境を形成している可能性が考えられました。
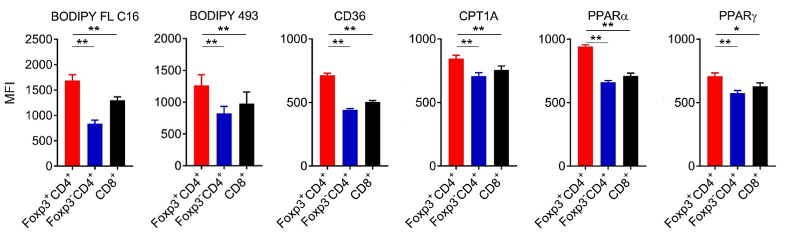
図5. 腫瘍浸潤リンパ球サブセットにおける脂肪酸代謝関連分子発現の比較検討
MC-38をマウスに皮下移植し腫瘍浸潤リンパ球を抽出し、フローサイトメトリーを用いて、各リンパ球における脂肪酸代謝関連分子発現と脂肪酸取り込み能(BODIPY FL C16)、脂肪酸貯蓄能(BODIPY 493)を比較検討しました。
次に、脂肪酸と制御性T細胞の関係を明らかにするため、腫瘍のFASN発現と腫瘍浸潤制御性T細胞の関連を評価しました。MC-38に脂肪酸合成酵素を強制発現させ、マウスに皮下移植し、腫瘍浸潤リンパ球を解析しました。腫瘍に脂肪酸合成酵素を強制発現させることにより、腫瘍浸潤制御性T細胞の割合は増加し、抑制活性も増強することが判明しました。また、RHOA Y42C変異により腫瘍浸潤制御性T細胞が増加するかをマウスモデルで検証しました。MC-38にRHOA 野生型とRHOA Y42C変異をそれぞれ強制発現させ、マウスに皮下接種し腫瘍浸潤リンパ球を解析しました。RHOA Y42C変異腫瘍の微小環境では制御性T細胞が多く浸潤し抑制活性が高いことが判明しました。続いて、RHOA Y42C変異腫瘍が抗PD-1抗体治療に奏効するかを検討しました。RHOA野生型細胞株と RHOA Y42C変異細胞株をそれぞれマウスに皮下移植し、抗PD-1抗体治療を実施したところ、RHOA Y42C変異腫瘍は抗PD-1抗体治療に耐性でした(図6)。さらに、国立がん研究センター東病院で抗PD-1抗体治療を実施したRHOA変異胃がん症例を検討したところ、同様に全例治療に抵抗性を示しました。
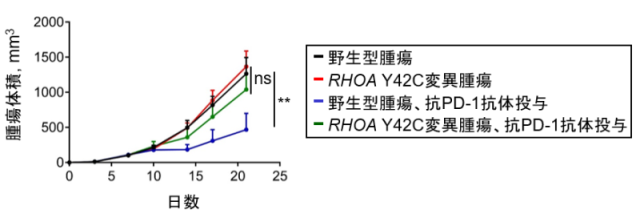
図6. RHOA遺伝子変異有無が抗PD-1抗体治療反応性に及ぼす影響の比較検討
RHOA野生型細胞株と RHOA Y42C変異細胞株をそれぞれマウスに皮下移植し、抗PD-1抗体治療を実施し腫瘍増殖を比較検討しました。
続いて、RHOA変異に特徴的なシグナルを阻害することで抗PD-1抗体治療抵抗性を解除できるかを検討しました。RHOA変異によりPI3K/AKT経路が活性化することがこれまでの検討で明らかになっていましたので、PI3K阻害剤を用いて検討しました。RHOA Y42C変異細胞株においてPI3K阻害剤を投与すると、IRF1発現が亢進した結果、CXCL10/CXCL11発現は増強する一方で脂肪酸合成能は低下しました。RHOA Y42C変異腫瘍に対するPI3K阻害剤と抗PD-1抗体の併用治療の有効性をマウスモデルで検討したところ、PI3K阻害剤を併用することで抗PD-1抗体治療抵抗性は解除されました(図7)。
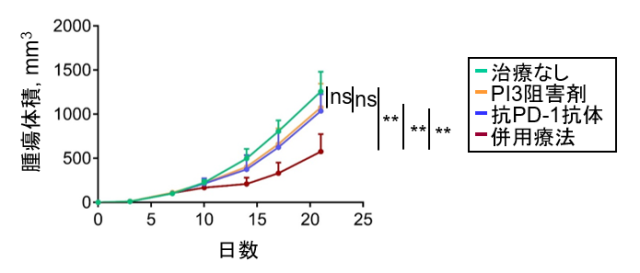
図7. RHOA遺伝子Y42C変異腫瘍において抗PD-1抗体とPI3K阻害剤併用療法の有効性の検討
RHOA Y42C変異細胞株をマウスに皮下移植し、PI3K阻害剤、抗PD-1抗体およびそれらの併用療法を実施し、腫瘍増殖曲線を比較検討しました。
3.今後の展開
これまで胃がんにおいて特定の遺伝子変異が免疫応答に与える影響は解明されていませんでした。本研究により、RHOA変異胃がんでは制御性T細胞の浸潤が多く免疫応答が弱いという特徴があることが明らかになりました。がんドライバー遺伝子変異であるRHOA変異によるシグナルは従来がん細胞の生存や増殖に関わると考えられてきましたが、それだけではなく、脂肪酸を合成することで制御性T細胞の生存に有利な環境を形成し、免疫抑制性に働いているという新しい概念が示されました。
また、制御性T細胞は炎症性の腫瘍環境に浸潤すると考えられてきましたが、本研究によりがん細胞自身が多数の制御性T細胞が存在できる環境を提供していることが明らかになり、制御性T細胞を標的としたがん免疫療法の新たな展開につながると考えられます。特にRHOA変異胃がんでは、RHOA変異の下流シグナルであるPI3Kを阻害し、抗PD-1抗体と併用治療を実施すると治療抵抗性が改善する可能性が示され、今後の新たな胃がん治療戦略につながることが期待されます。
4.用語説明
(1)RHOA遺伝子変異
RHOA遺伝子に変異があると、細胞を増殖させるスイッチが常にオンとなっているような状態となり、細胞が限りなく増殖し続け、がんを引き起こします。このような発がんを誘発する遺伝子変異のことを、ドライバー遺伝子変異と呼びます。
(2)ケモカイン
リンパ球を引き寄せる化学メディエーターです。細胞傷害性T細胞や制御性T細胞といったリンパ球を局所に引き寄せ、炎症の形成、抑制に関与するサイトカインの一種です。
(3)細胞傷害性T細胞
体内の免疫細胞、とりわけT細胞のうち、CD8分子陽性のT細胞集団で、標的抗原を発現する細胞を殺傷します。がん免疫では、がん細胞に発現するがん抗原を認識してがん細胞を殺傷します。
(4)制御性T細胞
体内の免疫細胞のうち、CD4分子陽性かつFOXP3分子陽性のT細胞集団で、免疫抑制機能を発揮します。体内で起こる様々な免疫応答を抑制する働きがありますが、がん免疫では抗腫瘍免疫応答を抑制してしまいます。
(5)がん免疫療法
生体内の免疫細胞ががん細胞を異物として認識し、攻撃することを利用したがん治療法です。従来の標準治療法として知られている化学療法・外科的治療・放射線療法に比較して副作用が少なく長期的な治療効果が期待できることから、近年大きな注目を集めています。
(6)抗PD-1抗体
Programmed cell Death 1 (PD-1)に対する抗体です。本邦ではニボルマブ(Nivolumab)やペンブロリズマブ(Pembrolizumab)として様々ながん種に医薬品承認を受けています。PD-1はがん細胞のPD-L1やPD-L2分子と相互作用することで細胞傷害性T細胞の活性化を阻害します。抗PD-1抗体はこの抑制性の相互作用をブロックし、細胞傷害性T細胞の活性化を維持します。
(7)PI3K-AKTシグナル伝達経路
PI3K-AKTシグナル伝達経路は元来、正常な細胞が生存するために必要であるシグナル伝達経路です。この経路が過剰に活性化することが腫瘍形成の原因の一部となることが知られています。多くのがんでは増殖や成長するのに、この伝達経路は大切であり、これまでたくさんの研究がなされてきました。
(8)PI3K阻害薬
PI3K-AKTシグナル伝達経路を阻害する薬で、たくさんの種類のPI3K阻害薬が研究されてきました。実際にがん患者さんの治療に有効性が示されたPI3K阻害薬もあります。
(9)フローサイトメトリー
フローサイトメトリーは主に細胞一つ一つのタイプを評価するために用いられるシステムであり免疫学の分野では古くから用いられてきました。細胞に発現する分子に抗体で蛍光物質を標識し、一定波長のレーザー光を細胞に当てます。その際にレーザー光によって生じた蛍光を検出器で検出し、細胞に発現する分子の発現の強さを評価することができます。
(10)マイクロアレイ
マイクロアレイは板の上にDNAの配列の一部分を高密度に配置し固定したものです。このシステムを用いることで数万種類の遺伝子の発現状況を網羅的に評価することができます。
5.発表雑誌
雑誌名
Immunity(米国時間7月7日の電子版)
論文タイトル
An oncogenic alteration creates a tumor microenvironment that promotes tumor progression by conferring a metabolic advantage to regulatory T cells
著者
Shogo Kumagai1,2, Yosuke Togashi1*, Chika Sakai1, Akihito Kawazoe3, Masahito Kawazu4, Toshihide Ueno4, Eiichi Sato5, Takeshi Kuwata6, Takahiro Kinoshita7, Masami Yamamoto8, Sachiyo Nomura9, Tetsuya Tsukamoto10, Hiroyuki Mano4, Kohei Shitara3 and Hiroyoshi Nishikawa1,2*
所属
- Division of Cancer Immunology, Research Institute /Exploratory Oncology Research and Clinical Trial Center (EPOC), National Cancer Center, Tokyo/Chiba, Japan
- Department of Immunology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Department of Gastrointestinal Oncology, National Cancer Center Hospital East, Chiba, Japan
- Division of Cellular Signaling, Group for Cancer Development and Progression, National Cancer Center Research Institute, Tokyo, Japan
- Department of Pathology, Institute of Medical Science, Tokyo Medical University, Tokyo, Japan
- Department of Pathology and Clinical Laboratories, National Cancer Center Hospital East, Chiba, Japan
- Department of Gastric Surgery, National Cancer Center Hospital East, Chiba, Japan
- Division of Physiological Pathology, Department of Applied Science, School of Veterinary Nursing and Technology, Nippon Veterinary and Life Science University, Tokyo, Japan
- Department of Gastrointestinal Surgery, Graduate School of Medicine, The University of Tokyo, Tokyo, Japan
- Department of Pathology, Graduate School of Medicine, Fujita Health University, Aichi Japan.
DOI
10.1016/j.immuni.2020.06.016
6.問い合わせ先
研究内容
名古屋大学医学部・医学系研究科 微生物・免疫学講座 分子細胞免疫学
教授 西川 博嘉
広報担当
名古屋大学医学部・医学系研究科
総務課総務係
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)