2020-09-07 国立がん研究センター
1.発表者
- 坂本 祥駿(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 博士後期課程1年生)
- 鈴木 絢子(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 特任准教授)
- 白石 友一(国立がん研究センター研究所 ゲノム解析基盤開発分野 分野長)
- 小林 進(国立がん研究センター先端医療開発センター ゲノムトランスレーショナルリサーチ分野(柏) 分野長)
- 河野 隆志(国立がん研究センター研究所 ゲノム生物学研究分野 分野長)
- 土原 一哉(国立がん研究センター先端医療開発センター トランスレーショナルインフォマティクス分野 分野長)
- 鈴木 穣(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
2.発表のポイント
- 新しいゲノムシークエンス技術を活用して、肺がんゲノムを網羅的に解析しました。
- 従来の解析方法では見逃されてきたがんのゲノムの異常(突然変異)を見出しました。
- これまで見つけることができなかったゲノムの異常を新たに検出することで、新しい発がん・悪性化のメカニズムの解明や治療標的の探索に役立つと考えています。
3.発表概要
近年、がんの遺伝子異常を網羅的に調べて診断や治療に役立てるクリニカルシークエンスが進み、がん細胞の持つ遺伝子全体(ゲノム)の解析は世界的に進められています。一方で、ゲノムを調べても、治療に結び付く遺伝子異常が見つからないケースが一定数存在します。
今回、東京大学大学院新領域創成科学研究科の鈴木穣教授らのグループは、国立がん研究センターとの共同研究により、これまでの方法では見逃されてきたゲノムの異常を発見するために、従来法よりもゲノムの塩基配列を長く解析することができるナノポアシークエンサー(注1)を活用して肺がん細胞のゲノム配列を解析しました。その結果、非常に複雑な構造変化を伴うゲノムの異常(注2)を見出し、その全体像を明らかにしました。
本研究成果は、2020年9月4日(金)に米国科学雑誌「Genome Research」のオンライン版で掲載されました。
4.発表内容
近年、がん細胞の持つ遺伝子全体(ゲノム)の解析が世界的に急速に進んでいます。がんの遺伝子変異を網羅的に調べて診断や治療に役立てるクリニカルシークエンスも広く行われるようになりました。我が国でも、昨年度、がんゲノム医療中核拠点が全国に設置されました。日常の診療でがんゲノムのDNA配列を解読して、その変異パターンに最適な治療法を選択する、いわゆる最適化医療が一般的に行われるようになっています。実際、ここ5年の間に、基礎医学、臨床医学におけるがんの理解とその治療法は飛躍的に進歩しています。しかし、その一方で、ゲノムを調べても、その異常がよく分からない症例が依然として一定の割合で存在します。
今回、東京大学大学院新領域創成科学研究科の鈴木穣教授らのグループは、国立がん研究センターとの共同研究により、これまでの方法では検出できなかったゲノムの異常の発見を試みました。この目的に、従来法よりもその塩基配列を長く解析することができるナノポアシークエンサーを活用した新しい手法を開発しました。この新しい手法では、1つ1つの塩基配列の解読精度はそう高くはありません。その代わりに、現在使われている方法に比べて、100倍の長さのゲノム配列を解読することが可能です。この新規の手法を用いれば、比較的広い範囲で起こるゲノム異常を俯瞰的に解析できます(図1)。実際に、本研究グループでは、この新しいゲノムDNA解読手法を肺がんの培養細胞や国立がん研究センターの肺がん(非小細胞肺がん)検体のがんゲノム解析へと用いました。その結果、これまでのシークエンス解析では見出せなかったような非常に複雑な構造変化を伴うゲノムの異常があることを見出しました。
例えば、STK11という遺伝子では、ゲノム配列のつなぎ方が4か所にわたって壊れているような複雑なゲノムの構造上の異常が見出されました(図2)。ただし、このゲノム異常ではつながり方こそ異常ですが、1つ1つの塩基配列自体をみるとそのすべてが正常です。実際、従来の1つ1つの塩基を正確に解読するシークエンス解析ではこのような変異を見出すことはできませんでした。さらに詳細な細胞生物学的解析を進めたところ、その細胞ではこの遺伝子異常が中核となった細胞内シグナルの異常が起こっていました。この細胞では確かにSTK11遺伝子が異常を起こしており、それは従来の方法では検出できなかったことが明らかになったわけです。この遺伝子はがん患者さんの治療を考える上で非常に重要な遺伝子です。具体的には、この遺伝子は、近年注目が集まる新規の抗がん剤(免疫チェックポイント阻害剤)の効果に関連している、ということが示されています(Rizvi et al. 2018 J Clin Oncol.; Skoulidis et al. 2018 Cancer Discov.)。STK11遺伝子が変異しているがんではこの新規の抗がん剤が効きにくく、この異常が見出されたがん患者さんは別の治療法を選択する必要がある可能性があります。
この他にも、そもそも、従来の解析手法ではなぜその患者さんががんになっているのか、その原因となるゲノム異常が分からない、という例が存在します。これらの症例についても新規の手法を用いたがんゲノムの解析が進めば、そのメカニズムが明らかになり、新しい治療薬の開発につながると考えられます。今回、直接解析が行われたのは肺がんでしたが、他の多くのがん種で、今回の手法を用いて今までに見いだされていなかったゲノム異常が見つかれば、より多くのがん患者さんに対して、よりよい治療法を結びつけることができると期待されます。
本研究は、日本医薬研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)(JP19cm0106539)、文部科学省科学研究費助成事業(16H06279)、ならびに、国立がん研究センター研究開発費(29-A-6)の支援のもとに行われました。公開可能な研究データは、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)統合推進化プログラムにより支援されているデータベースDBKERO(https://kero.hgc.jp/)より公開しています。
5.発表雑誌
雑誌名
Genome Research(9月4日オンライン版)
論文タイトル
Long read sequencing for non-small cell lung cancer genome
著者
Yoshitaka Sakamoto, Liu Xu, Masahide Seki, Toshiyuki T. Yokoyama, Masahiro Kasahara, Yukie Kashima, Akihiro Ohashi, Yoko Shimada, Noriko Motoi, Katsuya Tsuchihara, Susumu S. Kobayashi, Takashi Kohno, Yuichi Shiraishi, Ayako Suzuki, Yutaka Suzuki*
6.問い合わせ先
報道関係のお問い合わせ先
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
7.用語解説
(注1)ナノポアシークエンサー
シークエンスとは、DNAの塩基配列を決定することを指し、シークエンサーはシークエンスを行う機器のことです。ナノポアシークエンサーは、タンパク質でできたナノポアの中に、DNAやRNAが通る際の電流の変化を読み取ることで塩基配列を決定するシークエンサーです。従来の次世代シークエンサーより、長い塩基配列を読み取ることができます。
(注2)構造変化を伴うゲノムの異常
比較的大きな領域のゲノム配列が挿し込まれる(挿入)、失われる(欠失)、もしくは、ひっくり返る(逆位)ような異常を指します。短いDNA配列を正確に解読するこれまでの方法では解析することが難しく、長いDNA配列を決定することができるナノポアシークエンサーを用いると、その全体構造をより簡単に見つけることができます。
8.添付資料
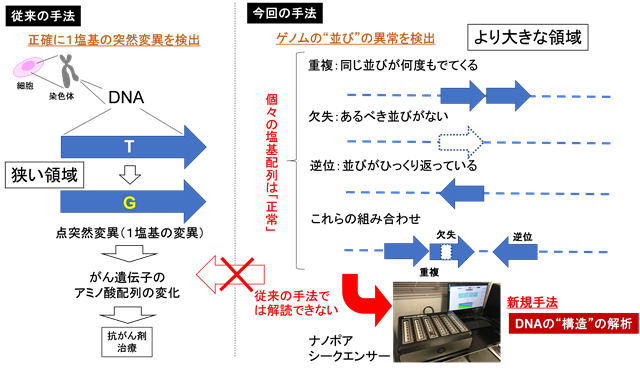
図1:従来のがんゲノム解析と、本研究で実施した新規手法によるゲノム構造異常の同定
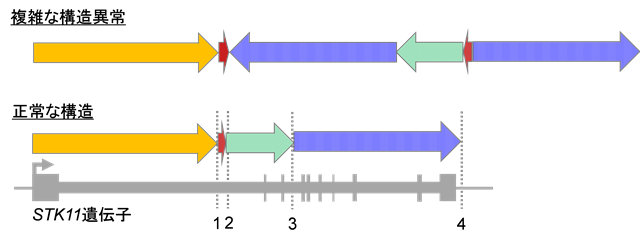
図2:STK11遺伝子におけるゲノムの異常の例
STK11遺伝子に複雑な構造変化を伴うゲノムの異常がある例を発見しました。ナノポアシークエンサーで解析した結果、逆位と重複が複雑に組み合わさった構造になっていることが明らかになりました。