ウイルス感染症防御、自己免疫疾患、癌、神経変性疾患などの疾患の原因解明への一歩
2020-09-11 東京大学

胡桃坂仁志教授ら東京大学定量生命科学研究所のグループは、米国ロックフェラー大学の船引宏則教授らのグループと共同で、自然免疫におけるDNAセンサーcGASが、自己の染色体DNAによって不活化されるメカニズムを解明しました。
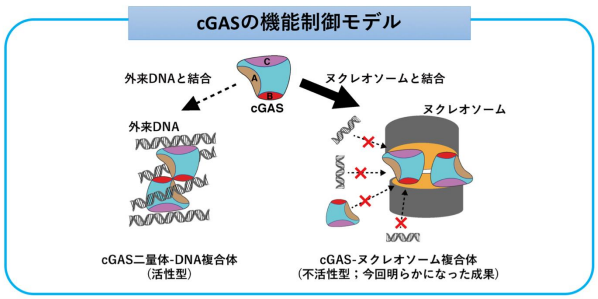
生物は、ウイルスなどの外来の微生物に対する防衛策として自然免疫機構を備えています。この機構で中心的な役割を担うのが、cGAS(cyclic GMP-AMP synthase)-STING(stimulator of interferon genes)経路です。この経路では、外来の非自己DNAが細胞に侵入すると、DNAセンサーであるcGASが結合して活性化し、STINGを通じて炎症反応が誘起されます。一方で細胞内には、自己の設計図である染色体DNAが存在するため、自己のDNAに対する免疫応答を回避するためにcGASは染色体DNAに対しては常に不活性化されている必要があります。船引宏則教授らによる近年の研究から、cGASが染色体の基本単位であるヌクレオソームに結合すると、cGASのDNAに対する応答反応が不活化されることが報告され、これにより自己免疫応答が回避されることがわかってきました。しかし、その詳細なメカニズムは不明でした。
本研究チームは、最新のクライオ電子顕微鏡による立体構造解析と生化学的解析とを組み合わせて、cGASがヌクレオソームにより不活化される分子メカニズムを解明しました。具体的には、cGASとヌクレオソームが結合した複合体を試験管内で再構成し、その立体構造をクライオ電子顕微鏡により解析することで、cGASがヌクレオソームによって不活性化されている様子を捉えました。その結果、cGASの活性化に必要な、3つのDNA結合領域と二量体形成領域のすべてがヌクレオソームによってブロックされることを発見しました。そして、立体構造情報に基づき変異体解析を行った結果、cGASのヌクレオソーム結合領域の変異によって、ヌクレオソームによるcGASの不活化が損なわれ、自己免疫応答の状態になることがわかりました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP20am0101076)、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」における「ヌクレオソーム高次構造とダイナミクスの解析によるクロマチン潜在能の解明」(代表:胡桃坂仁志、JP18H05534)、若手研究「自然免疫DNAセンサーによるクロマチンの認識と構造制御機構の解明」(代表:鯨井智也、JP20K15711)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(総括:胡桃坂仁志、JPMJER1901)の支援を受けて実施されました。
本研究成果は、2020年9月10日(米国東部標準時)に米国科学誌「Science」のオンライン速報版に掲載されました。