2020-09-14 東京大学 小林 修(化学専攻 教授)
発表のポイント
- ロジウム触媒の新規固定化方法を開発し、小分子医薬の約4割に含まれる重要な化合物群であるキラルアミンの連続合成を実現した。
- 本法は、さまざまなキラルアミンの合成に適用できる一般性のある合成法であり、実際、本法を用いて種々の医薬有効成分中間体の連続合成を達成した。
- キラルアミンの生産は現在、バッチ法を用いて、主に中国をはじめ国外で行われているが、今回、より効率の良いフロー法が開発されたことにより、キラルアミン生産の国内回帰が期待される。
発表概要
連続フロー法(注1)を用いる触媒的不斉水素化(注2)による有機合成は、廃棄物を出さない光学活性化合物(注3)の理想的な合成法であるといえるが、高価かつ希少な金属錯体触媒が使い捨てされてしまうなどの問題点から、これを用いた工業的製法はほとんど確立されていなかった。東京大学大学院理学系研究科の小林 修教授らの研究グループは、キラルなロジウム錯体触媒を化学修飾を施すことなく固定化する手法を開発した。本不均一系触媒(注4)は、種々のエナミド・デヒドロアミノ酸を基質として用いる連続フロー不斉水素化において有効に機能し、医薬品合成等で重要な中間体であるキラルアミドや非天然アミノ酸誘導体が、高収率・高選択的に得られた。また、本触媒は非常に高い安定性を示し、90時間以上の連続反応においても活性・選択性は維持されたまま触媒種の溶出は確認されず、均一系触媒以上の高い触媒回転数を記録した。さらに本手法は、種々のキラル配位子を有するロジウム錯体に対して、共通の手法での固定化が可能な汎用性の高い手法であり、基質の構造に対する触媒構造のチューニングが容易に実現された。本フロー法は、種々の医薬有効成分の中間体合成にも適用可能であり、GABA受容体拮抗剤であるCGP-55854、アルツハイマー型認知症治療剤であるリバスチグミン、高カルシウム血症治療薬であるテカルセト、二次性副甲状腺機能亢進症治療薬であるシナカルセトの鍵中間体の連続合成を達成した。これらの成果により現在、中国をはじめ国外に強く依存しているキラルアミンの生産を、国内へ回帰させることが期待される。 本研究成果は、アメリカの化学雑誌「Journal of American Chemical Society」のオンライン速報版で日本時間9月14日(月)午前0時に公開されました。
発表内容
<研究の背景>
医薬有効成分や天然物のほとんどは光学活性化合物であり、その効率的合成法の確立は重要な研究課題である。そのような化合物の理想的な合成方法の一つとして連続フロー法によるプロキラル化合物(注5)の不均一系触媒的水素化があげられる。連続フロー法は従来までのバッチ法と比較し効率・安全性・環境調和性に優れ、また連続的に目的物を供給できるため、必要な時に必要な量だけ生産できるといったオンデマンド合成を実現できる。2011年に米国食品医薬品局(FDA)でも今後25年で医薬品製造はバッチ法から連続フロー法に替わるべきだと提言されている。触媒的水素化は廃棄物を一切生じず、不均一系触媒を用いることで生成物への触媒の混入を防ぐのみならず、希少金属触媒の回収・再使用も実現される理想的な方法になる。さらに、気相(水素)・液相(基質溶液)・固相(触媒)の三相からなる反応形式は、効率的な物質輸送を得意とするフロー法に適している。特に、エナミド等の窒素官能基を含む基質を用いると、医薬有効成分に多く含まれるキラルアミンの合成が可能となる。しかしながら従来までのキラル不均一系触媒は、煩雑かつ一般性に欠ける固定化手法・活性や選択性の低下・活性種の不活性化や溶液中への溶出が問題となり、報告例は非常に限られていた。
<研究の内容>
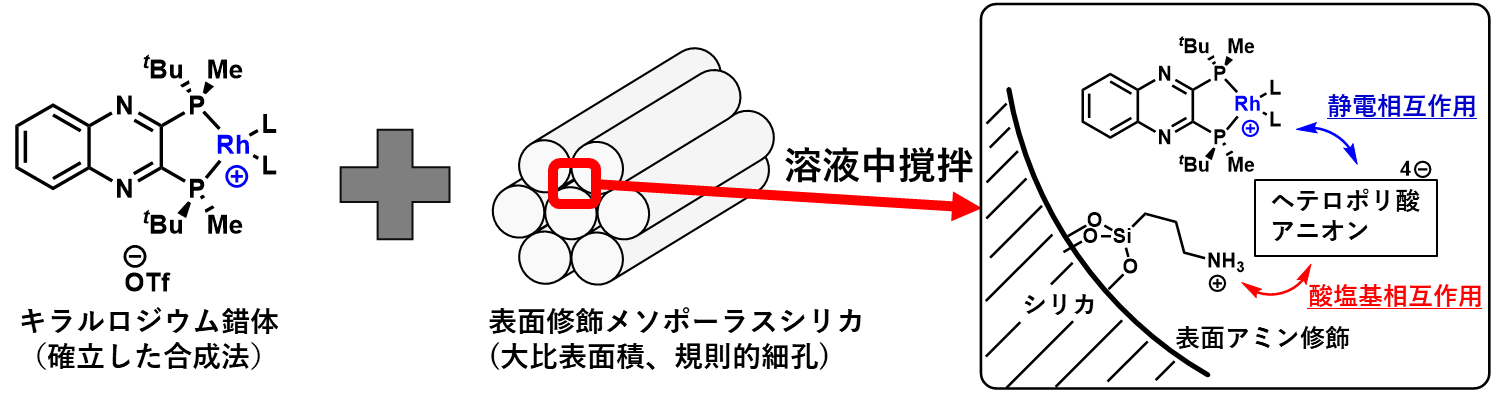
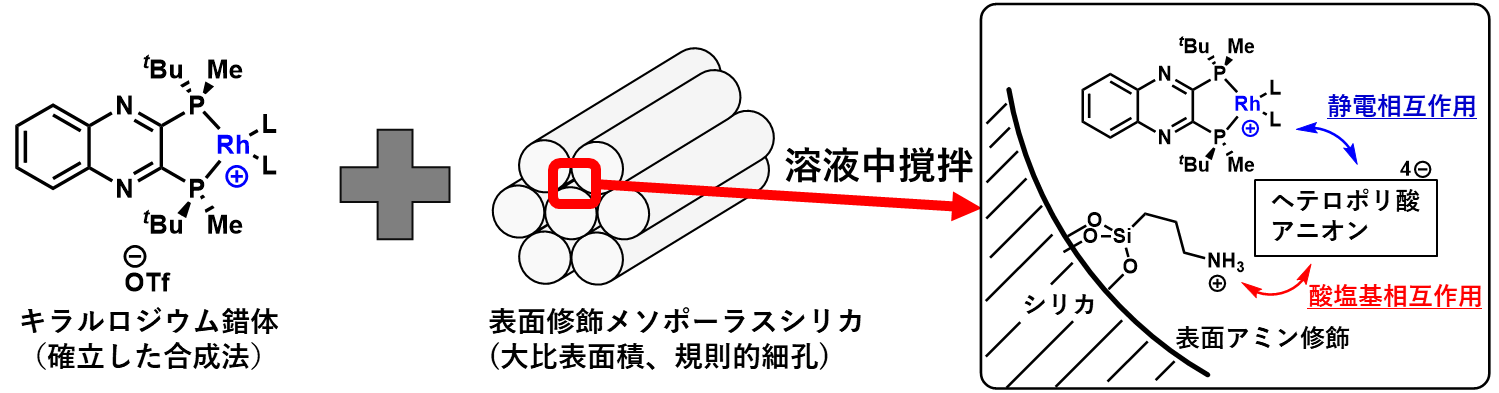
本研究では、エナミドの不斉水素化に有効な不均一系触媒の開発を行った。報告のあるカチオン性ロジウム錯体触媒をベースに、非共有結合的相互作用を活用する固定化手法を開発した (式1)。
式1:不均一系ロジウム触媒の調製法
特に、担体として大きな比表面積とナノメートルサイズの規則的な細孔構造を有するメソポーラスシリカを用い、細孔内に表面アミン修飾とヘテロポリ酸との塩形成といった化学修飾を施し、複合体を調製した。本複合体と既存のロジウム錯体を溶液中撹拌するのみで、容易かつ定量的に錯体の固定化が実現した。
調製した不均一系ロジウム触媒をカラムに充填することで触媒カートリッジを調製し、連続フロー法でのエナミドの不斉水素化の検討を行った (式2)。
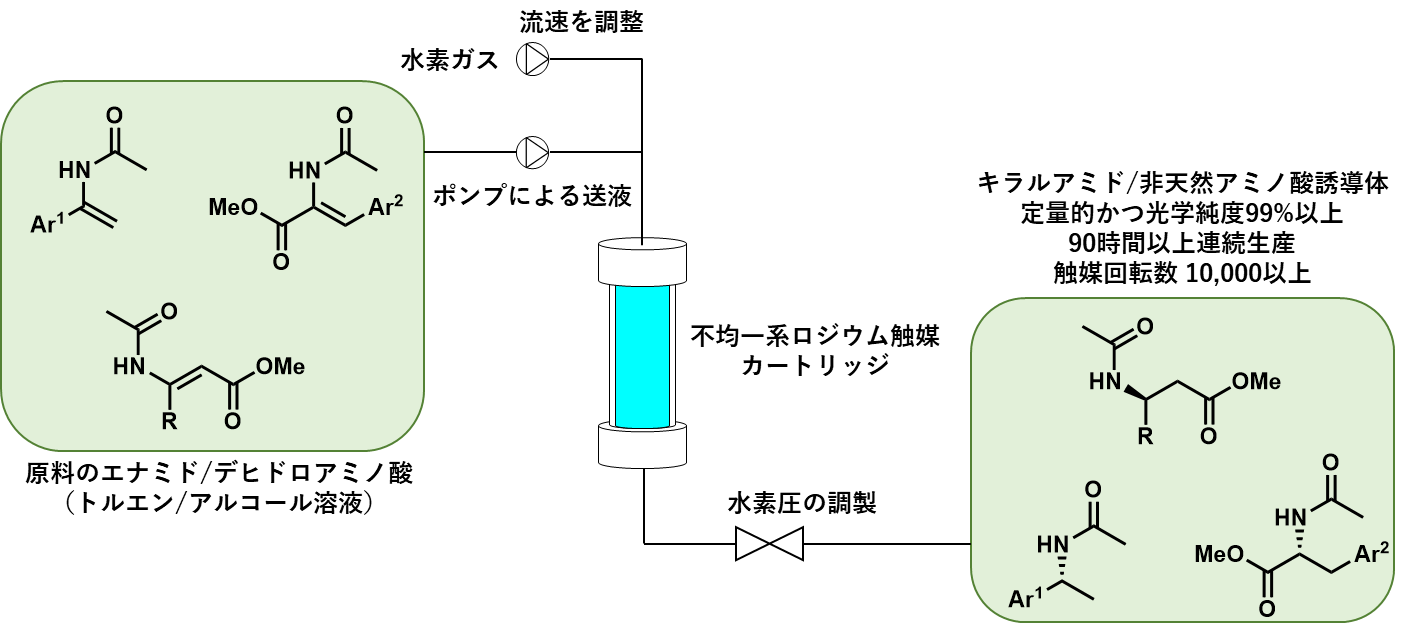
式2:連続フロー不斉水素化反応によるキラルアミド類の合成
本不均一系ロジウム触媒においては、高活性及び長寿命実現のためには表面アミン修飾と細孔径のコントロールが鍵であることが分かった。最適条件では、目的のキラルアミドが定量的かつ99%以上の光学純度で連続的に得られた。本触媒系は幅広い基質一般性を有し、種々の置換基を有するキラルアミドのみならず、基質構造を変更することで非天然アミノ酸誘導体の合成も可能であった。また、本触媒は非常に高い安定性を有し、90時間以上の連続反応においても活性・選択性は維持され、金属種の溶液中への溶出も検出限界以下であった。さらに、本フロー反応はバッチ反応と比較し高い活性を示すのみならず、回収・再使用が可能となることで大幅な触媒回転数の向上が実現した。
一方、一般に触媒的不斉水素化では基質の構造によって、選択性向上のため錯体の配位子構造の変更がしばしば求められる。従来までの固定化手法では配位子に化学修飾を施すことが一般的であったため、そのような構造変更は困難であった。一方で本固定化手法では、錯体を直接固定化に用いることが可能であり、実際に種々の錯体に対し共通の手法で固定化が可能な汎用性の高い手法であった。これにより、触媒構造のチューニングが容易に達成され、これを活用することで4種類の医薬有効成分の中間体の連続合成を実現した。
<今後の展開>
本研究では、連続フロー不斉水素化反応のためのロジウム錯体触媒の汎用的な固定化手法の開発に成功した。本不均一系触媒は、エナミドやデヒドロアミノ酸を基質として用いることで、対応するキラルアミドや非天然アミノ酸誘導体の定量的かつ非常に高い光学純度での連続生産を可能にした。本手法の開発により、中国をはじめ国外に強く依存している光学活性アミンの生産を、国内へ回帰することが可能となると期待される。また、種々の配位子を有する錯体に対して固定化を施すことで、迅速な不均一系触媒ライブラリの構築が可能であり、より高難易度の基質や反応の実現も期待される。
発表雑誌
- 雑誌名
Journal of American Chemical Society論文タイトル
Development of Robust Heterogeneous Chiral Rhodium Catalysts Utilizing Acid-base and Electrostatic Interactions for Efficient Continuous-Flow Asymmetric Hydrogenations著者
Yuki Saito and Shū Kobayashi *DOI番号
10.1021/jacs.0c08109
用語解説
注1 連続フロー法
反応原料を連続的に反応器に供給し、同時に生成物を反応器から連続的に取り出す合成法を連続フロー法と呼ぶ。不均一系触媒を用いる場合は触媒が充填された筒状のカートリッジを反応器として使用する。原料としては溶液のみでなく、水素ガス等の気体も用いることができる。送液速度や運転時間を調整することで様々なスケールの合成に対応でき、省スペース・高エネルギー効率・安全性といった利点を有する。
注2 触媒的不斉水素化
わずかなキラル源を用いて大量のアキラルな分子からのキラル分子を合成する手法を触媒的不斉反応と呼ぶ。水素化反応は、炭素-炭素、炭素-酸素、炭素-窒素などの多重結合に対してそれぞれの原子に水素を付加する反応であり、この過程でキラル分子を生じる反応を不斉水素化反応と呼ぶ。副生成物を生じない付加反応であることから、環境調和型の合成が実現できる。
注3 光学活性化合物
分子が自身の鏡像と重ね合わせられない場合これをキラル分子といい、鏡像体のペアは「右手型」と「左手型」に分類される。どちらかの型が過剰に存在する場合旋光性を有するため、その様な化合物が光学活性化合物と呼ばれる。医薬有効成分のほとんどはキラル分子であり、片方の異性体のみが目的の生理活性を有するため、非常に高い光学純度の化合物が求められる。
注4 不均一系触媒
触媒は均一系触媒と不均一系触媒に分類される。均一系触媒は金属錯体など反応溶液に溶解する触媒であり、合成や構造のチューニングが容易である一方、反応終了後に生成物との分離が必要となり、触媒の回収・再使用も困難である。不均一系触媒は固体そのものや固体表面に活性種が固定化された触媒である。一般に、不均一系触媒は高選択性の実現や活性種の溶出が問題となる一方、触媒の分離・回収・再使用がろ過により容易に可能になる利点を有する。
注5 プロキラル化合物
その化合物自体はキラリティを有さないが、適切な付加反応・置換反応などにより一段階の化学反応によりキラリティを持つ化合物へ変換できる。炭素-炭素二重結合の水素化ではアルケンの平面(プロキラル面)に対し、裏表のどちらの面の方向から水素が付加してくるかが、生成物のキラリティを決定する。この際不斉触媒を用いることで、わずかなキラル化合物から大量のキラル化合物を合成することが可能となる。
―東京大学大学院理学系研究科・理学部 広報室―