心不全において心臓のドパミン受容体が致死的不整脈を誘導する
2020-10-07 東京大学,日本医療研究開発機構
発表者
山口敏弘(東京大学医学部附属病院 循環器内科・国際検診センター 特任助教)
野村征太郎(東京大学医学部附属病院 循環器内科/東京大学大学院医学系研究科 重症心不全治療開発講座 特任助教)
小室一成(東京大学医学部附属病院 循環器内科/東京大学大学院医学系研究科 教授)
内藤篤彦(研究当時:東京大学大学院医学系研究科 肺高血圧先進医療研究学 特任助教/現東邦大学医学部医学科 生理学講座 教授)
住田智一(研究当時:東京大学大学院医学系研究科 健康医科学創造講座 特任助教/現エール大学医療学校 神経科学部 助教[Yale school of medicine (Yale University), Department of Neurology, Assistant professor])
発表のポイント
- 心不全時に発現の増加した心臓ドパミン受容体が、慢性心不全患者の主な死因である突然死の原因となる致死的不整脈をおこすことを世界で初めて明らかにしました。
- マウスおよびヒトの心不全の心筋細胞においてドパミン受容体の発現が増えていること、さらにそのドパミン受容体が致死的不整脈の原因になることが、初めて明らかになりました。
- 慢性心不全患者の主な死因である心臓突然死の原因は今まで不明でしたが、その一端を明らかにしたことより、今後、突然死を予防する治療法の開発に繋がる可能性があります。
発表概要
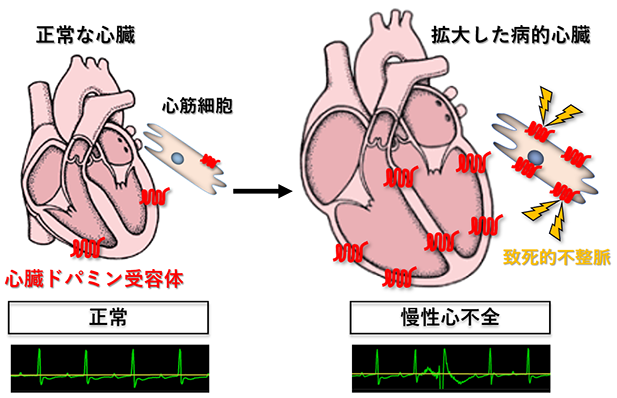
高齢化社会が進む中、慢性心不全(注1)の患者数は増加し続けています。若年者を含む重症心不全(注1)の患者さんにおいて、現時点で最善とされる内科的治療を行っても、致死的な不整脈による突然死を免れられないことが大きな問題となっています。この度、東京大学医学部附属病院循環器内科の山口敏弘特任助教および野村征太郎特任助教、小室一成教授、現東邦大学医学部医学科生理学講座の内藤篤彦教授、現エール大学医療学校神経科学部の住田智一助教らのグループは、これまで明らかになっていなかった心臓ドパミン受容体(注2)の役割に着目し、同受容体が心不全時の致死的な不整脈の発症に寄与していることを世界で初めて明らかにしました(図1)。今回の研究成果により、重症心不全の患者さんの突然死を抑制する新たな治療法の開発に、大きく貢献することが期待されます。本研究成果は、日本時間2020年8月31日に英国科学雑誌Nature Communicationsにて発表されました。
なお、本研究は、日本医療研究開発機構(AMED)ゲノム医療実現推進プラットフォーム事業「マルチオミックス連関による循環器疾患における次世代型精密医療の実現(研究代表者:小室一成)」ならびに革新的先端研究開発支援事業ユニットタイプ(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究課題「心筋メカノバイオロジー機構の解明による心不全治療法の開発」(研究代表者:小室一成)、革新的先端研究開発支援事業ソロタイプ(AMED-PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究課題「心臓ストレス応答における個体シングルセル四次元ダイナミクス」(研究代表者:野村征太郎)、日本学術振興会科学研究費助成事業基盤研究A「心不全発症における心筋細胞不均一性の意義(18K15881、研究代表者:小室一成)」、日本学術振興会科学研究費助成事業若手研究「心不全の病態生理においてドパミン受容体D1が果たす役割の解明(17H01560、研究代表者:山口敏弘)」等の支援により行われました。
発表内容
研究の背景
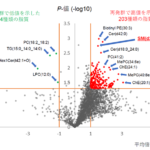
高齢化社会の進展に伴い、日本の慢性心不全患者数は年々増加しています。心不全の年間死亡者数は7万人を超えており、その予後は未だ不良です。特に重症心不全に対する内科的治療の選択肢は限られており、新たな治療法の開発が待たれています。これまで心不全の基礎研究では心不全のモデル動物による解析を中心とした研究が行われてきましたが、これらの研究を臨床応用する際には、モデル動物とヒトとの種差が大きな課題となっていました。そこで、東京大学医学部附属病院循環器内科の山口敏弘特任助教および野村征太郎特任助教、小室一成教授らの研究グループは、この課題を解決するために、心不全モデルマウスとヒト心不全患者の網羅的遺伝子発現解析(注3)の結果を用いて、ヒト心不全に対して臨床応用が可能となるシーズ探索(注3)を行い、モデルマウスおよびヒト両者に共通して心不全時に大きく発現が増加するドパミン受容体に着目しました。ドパミンは急性心不全(注1)の治療薬として、古くから医療現場で使用されてきましたが、実はその受容体であるドパミン受容体の心臓における役割や作用機序は、これまで明らかにされていませんでした。
研究の内容
本研究グループは、前述のシーズ探索の結果に基づいて、心筋細胞に特異的なドパミン受容体欠損(ノックアウト)マウスや強制(過剰)発現マウス(注4)を作製し、体表心電図、埋め込み型心電図、心臓超音波検査を用いた機能解析を行いました。その結果、ドパミン受容体欠損マウスでは心不全時の不整脈が抑制されるとともに予後が改善され、強制発現マウスでは致死的不整脈が増加しました。このことから、心不全時に心筋細胞で発現が増加するドパミン受容体が致死的不整脈の発症に寄与していることが世界で初めて明らかとなりました。その作用機序としては、心筋細胞内のリアノジン受容体(注5)のリン酸化を介して、細胞内のカルシウム濃度の変化に異常をきたしていることが関与していると考えられました。さらに、東京大学医学部附属病院および共同研究先であるコロラド大学附属病院の2病院において、重症心不全患者の病歴を解析し、致死的不整脈の治療歴あるいは埋め込み型除細動器による治療歴のある患者群(不整脈群)と対照群(非不整脈群)の比較を行ったところ、心臓ドパミン受容体は不整脈群の患者において、より発現増加が認められており、心臓ドパミン受容体がヒトにおいても心不全時の致死的不整脈の発症に関与していることが明らかとなりました。
社会的意義・今後の予定
今回の研究結果に基づいて、心不全時に心臓ドパミン受容体の働きを適切に抑制する薬剤を使用することで、心不全時の突然死を抑制する新たな治療法に繋がることが期待されます。今後は、核医学検査(注6)により、心臓ドパミン受容体の発現量を画像検査のみで測定することができる検査システムの確立を試み、さらなる臨床応用に向けての研究を目指します。核医学を用いた画像検査によって、患者さんに負担をかけずに突然死を予測することが可能となり、さらには心臓ドパミン受容体をターゲットとした薬効が期待できる患者さんを、効率よく予測することも可能になると考えています。
発表雑誌
- 雑誌名:
- Nature Communications(オンライン版:2020年8月31日)
- 論文タイトル:
- Cardiac Dopamine D1 Receptor Triggers Ventricular Arrhythmia in Chronic Heart Failure
- 著者:
- Toshihiro Yamaguchi*, Tomokazu Sumida*, Seitaro Nomura*, Masahiro Satoh, Tomoaki Higo, Masamichi Ito, Toshiyuki Ko, Kanna Fujita, Mary E. Sweet, Atsushi Sanbe, Kenji Yoshimi, Ichiro Manabe, Toshikuni Sasaoka, Matthew R. G. Taylor, Haruhiro Toko, Eiki Takimoto, Atsuhiko T. Naito* and Issei Komuro*
- DOI番号:
- 10.1038/s41467-020-18128-x
- URL(open access):
- https://rdcu.be/b6zfM
用語解説
- (注1)急性心不全、慢性心不全、重症心不全
- 心不全とは、心臓の機能が低下することで息切れやむくみが生じ、寿命を縮める病気です。心臓の機能が低下する原因はさまざまですが、心筋梗塞などにより急激に機能が低下した場合は急性心不全に、弁膜症などによりゆっくりと心臓の機能が低下していった場合は慢性心不全となっていきます。個々の患者さんの病状に応じて内科的治療(薬物治療)やカテーテル治療、手術などが行われますが、内科的治療を含めそれぞれの治療に限界があるのが現状で、さまざまな治療法を組み合わせても改善の難しい状態を重症心不全と呼びます。
- (注2)ドパミン、ドパミン受容体
- ドパミンは主に脳神経や交感神経から放出される神経伝達物質で、運動、情動行動、学習などに影響していると考えられています。ドパミンを含む伝達物質を受け取る構造物を受容体といい、ドパミンを受け取る受容体としてドパミン受容体が存在します。これまでドパミンやドパミン受容体は主に神経領域で研究が進んできました。一方では、ドパミンを血管内に投与すると、心拍数の上昇あるいは心臓の収縮が強くなることは古くから知られていましたが、そのメカニズムはこれまで明らかではありませんでした。
- (注3)網羅的遺伝子発現解析、シーズ探索
- 生命活動を担うために、生体は必要に応じてたんぱく質の設計図である遺伝子を発現させ、mRNAと呼ばれる物質を作ります。網羅的遺伝子発現解析とは次世代シーケンサーと呼ばれる機器を用いて、この生命活動の情報を積んだ全mRNAの発現量を調べることを指します。また、シーズ探索とは、研究において将来花開き実を結ぶ可能性のある“シーズ(種)”を探すことを意味します。本研究では、上記の遺伝子発現の網羅的解析をシーズ探索として行い、ドパミン受容体を見出しました。
- (注4)欠損(ノックアウト)マウス、強制(過剰)発現マウス
- ノックアウトマウスとは、遺伝子操作によって、特定の遺伝子の配列部分を欠損させて発現をなくす(ノックアウト)処理を施したマウスです。一方で、強制(過剰)発現マウスとは、同様の遺伝子操作によって、特定の遺伝子を過剰(強制的に)に発現させたマウスのことです。このような遺伝子操作を施したマウスの機能解析を行うことで、特定の遺伝子の機能や、その遺伝子に起因する生体内の作用機序を知ることができます。
- (注5)リアノジン受容体
- 筋細胞や神経細胞などの興奮可能な細胞内ではナトリウム、カリウム、カルシウムなどのイオンの濃度が変化することにより興奮が起こります。リアノジン受容体は、このうち細胞内のカルシウムを貯蔵している「筋小胞体」という細胞内小器官に存在し、細胞内のカルシウム濃度を変化させる役割を担っています。リアノジン受容体がリン酸化されるとカルシウムイオンが筋小胞体から細胞内に放出され、細胞内のカルシウム濃度が上昇します。本研究では、ドパミン受容体がリアノジン受容体のセリンと呼ばれる部位の病的な過剰リン酸化を誘導し、細胞内の病的カルシウム濃度上昇が起きることによって不整脈が生じると考えられました。
- (注6)核医学検査
- 核医学検査の中ではPET検査が有名ですが、核医学検査は特定の臓器や組織に集まりやすい性質を持った微量の放射線を出す元素を患者に投与し、その元素が目的の臓器や組織に集まったところでそこから放出される放射線をカメラで検出し、その分布を画像化する検査です。この検査により臓器や組織の形態や機能、代謝状態などを評価することができます。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 循環器内科・国際検診センター
特任助教 山口敏弘(やまぐちとしひろ)
東京大学医学部附属病院 循環器内科
教授 小室一成(こむろいっせい)
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課
ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究:GRIFIN)担当
シーズ開発・研究基盤事業部 革新的先端研究開発課