2020-12-02 理化学研究所,沖縄科学技術大学院大学
理化学研究所(理研)生命医科学研究センター免疫恒常性研究チームの秋山 泰身チームリーダー、疾患遺伝研究チームの山本雅チームリーダー(沖縄科学技術大学院大学教授)らの国際共同研究グループは、メッセンジャーRNA(mRNA)[1]の分解を制御するタンパク質複合体が、異常な細胞死を防ぐことでTリンパ球[2]の正常な発生を促すことを発見しました。
本研究成果は、免疫応答に重要なTリンパ球の発生機構の解明に貢献すると期待できます。
リンパ組織の胸腺[3]では、正常な免疫応答が可能なTリンパ球だけが発生しますが、その機構の全貌は明らかになっていません。Tリンパ球の発生段階で、多くのmRNAが発現上昇しますが、その中には、Tリンパ球の細胞死を誘導する遺伝子のmRNAも含まれます。
今回、国際共同研究グループは、Tリンパ球の発生段階で、タンパク質複合体「CCR4-NOT」が正常なTリンパ球の細胞死を防ぐことを発見しました。CCR4-NOT複合体は、mRNAの末端に存在するアデニル酸[4]のポリマー鎖を短縮(脱アデニル化)することで、細胞死を誘導する遺伝子のmRNAを分解します。その結果、細胞死が防止され、免疫応答可能なTリンパ球が生存できることが明らかになりました。
本研究は、オンライン科学雑誌『Nature Communications』(12月2日付)に掲載されます。
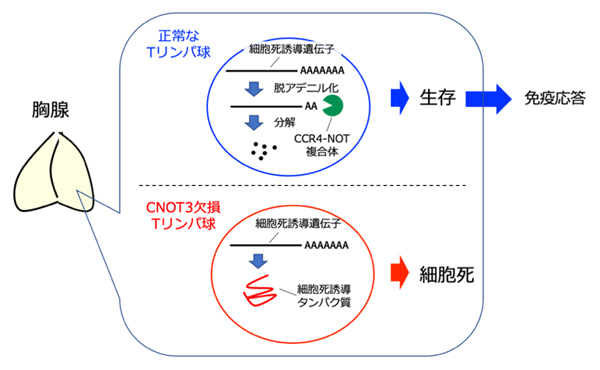
CCR4-NOT複合体による正常なTリンパ球の異常細胞死の防止機構
背景
さまざまな免疫応答で司令塔としての役割を持つTリンパ球のほとんどは、リンパ組織の胸腺で産生されます。その際、正常な免疫応答を引き起こすTリンパ球だけが、胸腺内で選別されます。その選別機構が異常になると、免疫不全症[5]や自己免疫疾患[6]の原因になることが知られています。
胸腺内で起きるTリンパ球の選別には細胞死が重要です。すなわち、正常な免疫応答が可能なTリンパ球だけが生存し、不要なTリンパ球は胸腺外へ移動する前に細胞死を起こします。このTリンパ球の生死の分かれ目は、巧妙な機構により調節されていると考えられていますが、その全貌はまだ明らかになっていません。
真核細胞のメッセンジャーRNA(mRNA)は、約150個のアデニル酸で構成されるポリマー鎖(ポリA鎖)を末端に持ち、ポリA鎖はmRNAの安定性やmRNAからタンパク質への翻訳に重要です。そのため、ポリA鎖が短くなると、mRNAの分解促進やタンパク質への翻訳効率の減少が起こり、結果としてタンパク質の発現量が低下します。
「CCR4-NOT」は、複数のタンパク質から形成される巨大なタンパク質複合体であり、ポリA鎖を短縮する酵素活性(脱アデニル化活性)を持ちます。この脱アデニル化により細胞内のmRNAを分解に導き、mRNAがコードするタンパク質の発現量を減少させると考えられています。最近、CCR4-NOT複合体が、さまざまな細胞の分化や生存、機能に重要であることが報告されつつありますが注1-2)、Tリンパ球での役割は不明でした。
注1)2020年1月22日プレスリリース「mRNA分解に必須な酵素活性因子を特定」
注2)2019年2月22日プレスリリース「肝臓の成熟に必要なRNA分解」
研究手法と成果
国際共同研究グループは、Tリンパ球が選別を受ける過程で、CCR4-NOT複合体が発現上昇することを発見し、CCR4-NOT複合体がTリンパ球の選別過程で重要な役割を持つと予想しました。その証明を目指し、まずCCR4-NOT複合体の重要な構成因子であるCNOT3をTリンパ球だけで欠損させたマウス(CNOT3欠損マウス)を樹立しました。次いで、CNOT3欠損マウスの胸腺からTリンパ球を採取し、フローサイトメーター[7]で解析しました。その結果、通常は胸腺内で選別されて成熟するTリンパ球が、CNOT3欠損マウスの胸腺では大きく減少することが判明しました(図1)。
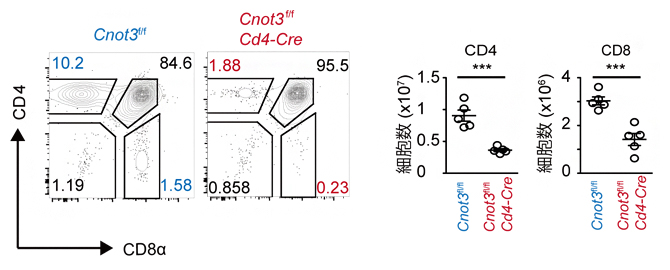
図1 T細胞特異的なCNOT3欠損マウス胸腺のフローサイトメーター解析
T細胞特異的なCNOT3欠損マウス(Cnot3fl/fl CD4-Cre)の胸腺では、コントロール(Cnot3fl/fl)に比べて、CD4陽性CD8陰性あるいはCD4陰性CD8陽性の成熟したTリンパ球が減少する。
次に、Tリンパ球が減少する原因を調べるため、次世代シークエンサー[8]を用いて、Tリンパ球の選別過程で発現量が変動する遺伝子を探索しました。その結果、細胞死誘導因子であるBbc3やDab2ipをコードするmRNAが異常に増加することが判明しました(図2)。また、CNOT3欠損マウスのTリンパ球では、Bbc3タンパク質も増加していました。
これらの結果から、CCR4-NOT複合体機能を欠失したTリンパ球では、アポトーシス[9]による細胞死が異常に亢進していると推測されました。実際、アポトーシスを防ぐ機能を持つタンパク質であるBcl-2をCNOT3欠損マウスのリンパ球で発現させると、Tリンパ球の減少が抑制されました。さらに、Tリンパ球の細胞表面の抗原受容体[10]を刺激することで起きる細胞死が欠損マウスのリンパ球で亢進していました。
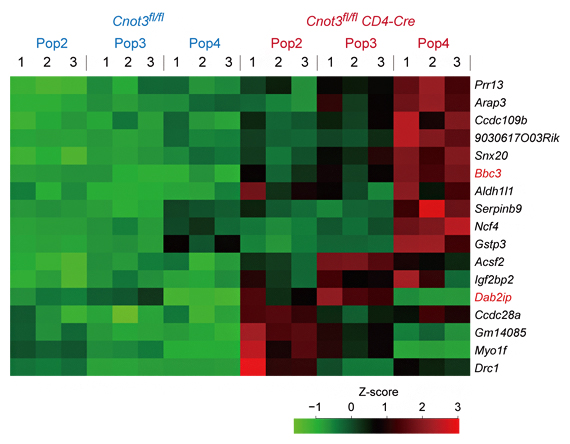
図2 次世代シークエンサーによるTリンパ球の遺伝子発現解析
T細胞特異的なCNOT3欠損マウス(Cnot3fl/fl CD4-Cre)では、赤字で示した細胞死誘導因子の遺伝子(Bbc3、Dap2ip)の発現が上昇する。
また、Bbc3やDab2ipのmRNAに付加しているポリA鎖が、CNOT3欠損マウスでは長くなることも分かりました(図3)。すなわち、CCR4-NOT複合体は、Tリンパ球が選別を受ける際に増加するアポトーシス誘導性のBbc3やDab2ipのmRNAに付加しているポリA鎖を短くすることで、それらのmRNAの分解を促進し、Tリンパ球の異常な細胞死を防ぐ安全装置のような役割を持つと考えられます。
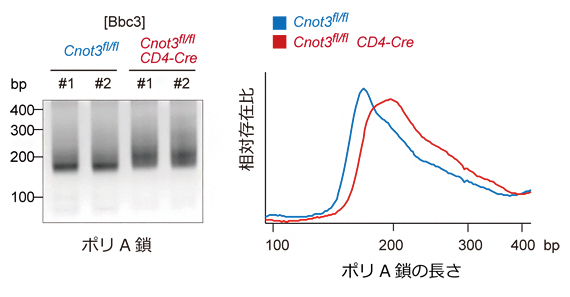
図3 Bbc3遺伝子のポリA鎖長の解析
T細胞特異的なCNOT3欠損マウス(Cnot3fl/fl CD4-Cre)の胸腺では、コントロール(Cnot3fl/fl)に比べて、細胞死誘導因子mRNAのポリA鎖が伸長する。電気泳動の図(左)と各ポリA鎖の長さを持つmRNAの相対的存在比のプロット(右)。
今後の期待
細胞死を起こすタンパク質や炎症を誘導するタンパク質の異常な増加は、細胞に有害と考えられ、これらのタンパク質の量は適切に制御される必要があります。その際、mRNAの分解による制御は、タンパク質が翻訳される前に抑制できる点で、タンパク質を直接分解するよりも効率的かつ安全な抑制機構といえます。
本研究から、Tリンパ球の分化や細胞死の新たなRNA分解制御機構が明らかになりました。本成果は今後、Tリンパ球でRNA分解機構を制御する新たな機構の発見に加え、それらを利用したTリンパ球発生の人為的制御機構の開発や免疫不全症治療への応用などへと発展すると期待できます。
また、最近Tリンパ球のRNA分解機構に関わる因子が、がんに浸潤するTリンパ球を不活性化していることが報告されています。本研究により、CCR4-NOT複合体やその制御因子を標的としたがん免疫治療[11]の改善も期待できます。
補足説明
1.メッセンジャーRNA(mRNA)
ゲノム DNAにコードされた遺伝情報を読み取るため重要なリボ核酸の一種。メッセンジャーRNAに写された遺伝情報は翻訳され、タンパク質が合成される。
2.Tリンパ球
免疫応答に重要なリンパ球の一種。細菌などに対する免疫応答だけでなく、アレルギーやがんに対する免疫応答にも重要である。
3.胸腺
Tリンパ球を産生するリンパ組織。
4.アデニル酸
RNAを構成する分子の一つ。
5.免疫不全症
免疫機能が低下し、感染などに対する抵抗性が下がる疾患の総称。
6.自己免疫疾患
自分の臓器に対して免疫応答が始まり、それが継続する疾患の総称。代表的なものに関節リウマチがある。
7.フローサイトメーター
細胞を個々に観察できる分析装置。蛍光抗体を結合させたり、蛍光タンパク質を発現させた細胞を検出できる。
8.次世代シークエンサー
大量の遺伝子配列を高速で決定する実験機器のこと。
9.アポトーシス
細胞の自死。細胞が持つ自分を殺すための機構を利用して、細胞が死ぬこと。
10.抗原受容体
リンパ球の細胞表面に発現する、抗原を認識するためのタンパク質。
11.がん免疫治療
免疫応答を利用してがんを除く治療方法。
国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫恒常性研究チーム
チームリーダー 秋山 泰身(あきやま たいしん)
(横浜市立大学 大学院生命医科学研究科 免疫生物学研究室 客員教授)
技師 宮尾 貴久(みやお たかひさ)
疾患遺伝研究チーム
チームリーダー 山本 雅(やまもと ただし)
(沖縄科学技術大学院大学 細胞シグナルユニット 教授)
上級研究員 秋山 伸子(あきやま のぶこ)
上級研究員 鈴木 亨(すずき とうる)
沖縄科学技術大学院大学
細胞シグナルユニット
スタッフサイエンティスト 呉羽 拓(くれは たく)
スタッフサイエンティスト 高橋 明格(たかはし あきのり)
技術員 西島 さおり(にしじま さおり)
免疫シグナルユニット
准教授 石川 裕規(いしかわ ひろき)
スタッフサイエンティスト 小泉 真一(こいずみ しんいち)
研究支援ディビジョン
ビジネスアナリスト アレハンドロ・ビジャールブリオネス(Alejandro Villar-Briones)
テキサス大学サンアントニオ校 ヘルスサイエンスセンター
AssistantProfessor 森田 斉弘(もりたま さひろ)
東京大学大学院 薬学研究科
教授 一條 秀憲(いちじょう ひでのり)
准教授 名黒 功(なぐろ いさお)
研究支援
本研究は、沖縄科学技術大学院大学運営費補助金(山本 雅)、日本学術振興会(JSPS)科学研究費補助金基盤研究B「自己免疫疾患発症を抑制する胸腺上皮細胞の機能を制御する新規転写因子の解析(研究代表者:秋山泰身)」による支援を受けて行われました。
原論文情報
Taku Ito-Kureha, Takahisa Miyao, Saori Nishijima, Toru Suzuki, Shin-ichi Koizumi, Alejandro Villar-Briones, Akinori Takahashi, Nobuko Akiyama, Masahiro Morita, Isao Naguro, Hiroki Ishikawa, Hidenori Ichijo, Taishin Akiyama*, and Tadashi Yamamoto*, “The CCR4-NOT deadenylase complex safeguards thymic positive selection by down-regulating aberrant pro-apoptotic gene expression”, Nature Communications, 10.1038/s41467-020-19975-4
発表者
理化学研究所
生命医科学研究センター 免疫恒常性研究チーム
チームリーダー 秋山 泰身(あきやま たいしん)
疾患遺伝研究チーム
チームリーダー 山本 雅(やまもと ただし)
(沖縄科学技術大学院大学 細胞シグナルユニット 教授)
報道担当
理化学研究所 広報室 報道担当
沖縄科学技術大学院大学 広報メディアセクション