2020-12-23 生命創成探究センター
理化学研究所(理研)環境資源科学研究センター分子生命制御研究チームの泉正範上級研究員、中村咲耶訪問研究員、萩原伸也チームリーダー、東北大学大学院生命科学研究科の日出間純准教授、自然科学研究機構生命創成探究センターの根本知己教授(同機構生理学研究所教授)らの共同研究グループ※は、細胞内自己分解システムである「オートファジー[1]」が植物ミトコンドリア[2]の品質管理を担うことを発見しました。
本研究成果は、過酷な自然環境や地球外環境での植物栽培に向けたストレス耐性植物の設計に役立つと期待できます。
これまで、太陽光を利用して生きる植物が常にさらされている紫外線障害の耐性に、オートファジーが関わることが明らかになっていました。しかし、オートファジーが紫外線耐性をどのように支えているか、その全容は未解明でした。
今回、共同研究グループは、モデル植物のシロイヌナズナを用いて、紫外線耐性におけるオートファジーの役割を詳細に解析しました。最新の顕微鏡装置を含む細胞内イメージング解析などを積み重ねた結果、葉において紫外線障害で機能不全となったミトコンドリアが、オートファジーによるミトコンドリア分解(マイトファジー[3])で除去されることを明らかにしました。
本研究は、科学雑誌『Plant and Cell Physiology』において特に重要な成果を発表するrapid paperとしての掲載に先立ち、オンライン版(12月23日付:日本時間12月23日)に掲載されます。
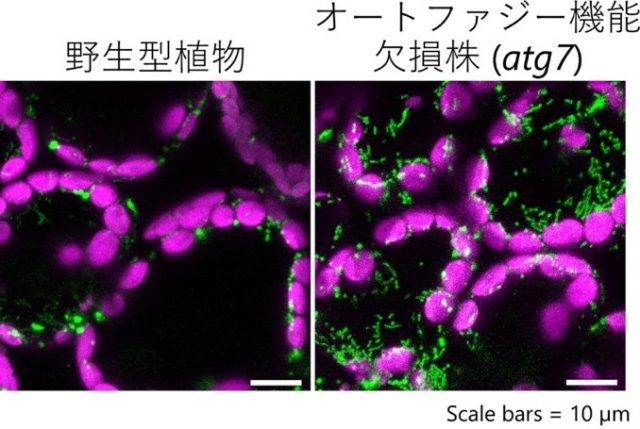
シロイヌナズナの葉で観察したミトコンドリア画像(緑がミトコンドリア)
※共同研究グループ
理化学研究所 環境資源科学研究センター 分子生命制御研究チーム
上級研究員 泉 正範 (いずみ まさのり)
訪問研究員 中村 咲耶 (なかむら さくや)
チームリーダー 萩原 伸也 (はぎはら しんや)
自然科学研究機構 生命創成探究センター/生理学研究所
教授 根本 知己 (ねもと ともみ)
助教 大友 康平 (おおとも こうへい)
東北大学大学院
生命科学研究科
准教授 日出間 純 (ひでま じゅん)
農学研究科
准教授 石田 宏幸 (いしだ ひろゆき)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「葉緑体を基軸とするオルガネラ・ゾーンの形成因子と機能実証(研究代表者:泉正範)」、同若手研究「植物の光障害耐性を支える新奇オルガネラ・オートファジー経路の同定(研究代表者:中村咲耶)」、同新学術領域研究(研究領域提案型)「損傷葉緑体を除去するミクロオートファジーの作動機構(研究代表者:中村咲耶)」による支援を受けて行われました。
研究の背景
植物科学の基礎研究で広く用いられる人工気象器やガラス温室での栽培では、屋外での栽培に比べて、植物に到達する紫外線は大幅に減少します。しかし、本来自然太陽光の下で生きている植物は、強い太陽紫外線による障害に常にさらされています。つまり、太陽光エネルギーを利用した光合成で生きる植物は、紫外線障害に常に対応する必要があります。また、このような障害は地球外環境ではさらに強くなることから、植物の紫外線耐性機構の理解は将来的な地球外での植物栽培を目指す上でも重要とされています。
そのような視点から、泉正範上級研究員らは植物の紫外線応答に着目し、2017年にモデル植物シロイヌナズナにおいて細胞内自己分解システムである「オートファジー」が紫外線耐性に関わることを明らかにしました注1)。しかし、オートファジーがどのように植物の紫外線耐性を支えているか、その全容は未解明でした。
注1)Izumi et al. (2017) Entire photodamaged chloroplasts are transported to the central vacuole by autophagy. The Plant Cell 29: 377-394,
研究手法と成果
共同研究グループは、まずオートファジー機能が欠損したシロイヌナズナであるatg2変異株、atg5変異株、atg7変異株を用いて紫外線耐性を評価し、これら変異株が、紫外線Bランプ1時間照射の障害条件で葉が枯れやすくなる感受性を示すことを確認しました(図1)。

図1 シロイヌナズナのオートファジー機能欠損株の紫外線感受性
左から、野生型シロイヌナズナ、オートファジー機能欠損株であるatg2、atg5、atg7変異株の写真。上段が通常栽培区で、下段が1時間の紫外線処理後7日目の植物体。オートファジー機能欠損株では紫外線耐性が低下し、葉が枯死した。
そこで、各種細胞内小器官(オルガネラ)を蛍光タンパク質で可視化した植物(野生型背景)と、オートファジー機能欠損株(atg7変異株)を同じ紫外線障害にさらし、各オルガネラの様子を観察しました。その結果、野生型の葉では障害1日後にミトコンドリアの数が減少するのに対し、atg7変異株の葉ではミトコンドリアの数が著しく増加することを見いだしました(図2)。
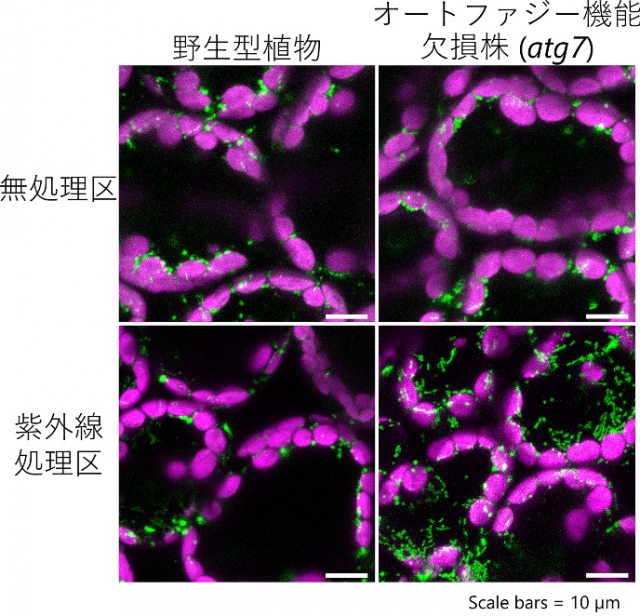
図2 顕微鏡によるシロイヌナズナの葉の細胞の観察画像
左列は野生型シロイヌナズナ、右列はオートファジー機能が欠損したatg7変異株、上段は通常栽培区、下段は1時間の紫外線処理後1日目に葉の中の細胞2~4個を観察した画像。緑色蛍光タンパク質(GFP)がミトコンドリアを緑色に可視化している。マゼンタは細胞の外周にある葉緑体を表している。オートファジー機能欠損株では、紫外線処理後にミトコンドリアの数が増加しているのが分かる。
さらに、電子顕微鏡観察、健全ミトコンドリアの染色剤に加え、根本知己教授らが開発を進めている「マルチビーム走査型2光子顕微鏡[4]」を用いて、ミトコンドリアの形態評価を行いました(図3)。そして、紫外線障害を受けたオートファジー機能欠損株では、細かく断片化した機能不全ミトコンドリアが残存・蓄積していることを明らかにしました。一方、野生型の葉では、蛍光タンパク質で可視化したオートファジーの輸送体(オートファゴソーム[1])がミトコンドリアを輸送することを確認しました。以上から、オートファジーによるミトコンドリア分解(マイトファジー)により、紫外線で機能不全となったミトコンドリアが除去されていることが明らかになりました。
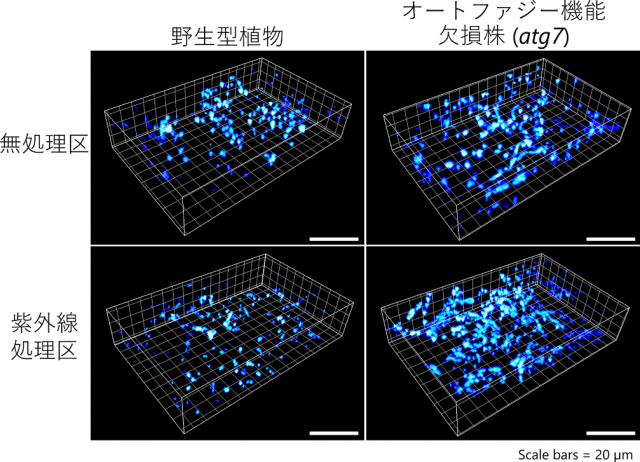
図3 マルチビーム走査型2光子顕微鏡によるミトコンドリア観察
左列は野生型シロイヌナズナ、右列はオートファジー機能が欠損したatg7変異株、上段は通常栽培区、下段は1時間の紫外線処理1日後で、それぞれ葉の細胞において蛍光タンパク質で可視化したミトコンドリアを観察した像。オートファジー機能欠損株では、紫外線処理後にミトコンドリアが増加している。
次に、正常なミトコンドリア機能に必要なFRIENDLY遺伝子とオートファジー機能の二重欠損株を作出し、ミトコンドリア機能への影響を評価しました。その結果、FRIENDLY遺伝子の欠損により増えた機能不全ミトコンドリアが、オートファジーの欠損によりさらに増加することを確認しました。つまり、マイトファジーがFRIENDLY遺伝子欠損により生じたミトコンドリアストレスを軽減しているものと考えられます。この結果は、マイトファジーが葉のミトコンドリア品質管理に寄与していることをさらに支持しています。以上のことから、マイトファジーが植物ミトコンドリアの品質管理を担うことが明らかになりました。
今後の期待
本研究は、オートファジーが植物細胞内の障害成分を取り除くことが植物の紫外線耐性に重要であることを明らかにしたものです。今後、その詳細な仕組みを明らかにしていくことで、強い太陽光障害に負けずに育つ植物の設計のための新たな方策を見いだすことにつながると期待できます。
また、さまざまな生物種で盛んに進められているオートファジーが関わる研究分野において、酵母や哺乳類におけるマイトファジーの重要性が広く認識されてきましたが、植物マイトファジーによるミトコンドリア品質管理の存在は長らく明確な証拠が示されてきませんでした。本成果は、植物でマイトファジーがミトコンドリア品質管理を担うことを直接示したものであり、関連分野のさらなる研究発展に貢献すると期待できます。
論文情報
掲載誌:Plant and Cell Physiology
論文タイトル:Autophagy contributes to quality control of leaf mitochondria
著者:Sakuya Nakamura, Shinya Hagihara, Kohei Otomo, Hiroyuki Ishida, Jun Hidema, Tomomi Nemoto, Masanori Izumi
補足説明
[1] オートファジー、オートファゴソーム
オートファジーは植物、動物、酵母など、真核生物に広く保存されるタンパク質などの細胞内成分の分解システム。「自食作用」とも呼ばれる。細胞質の一部や細胞内小器官(オルガネラ)をオートファゴソームと呼ばれる二重膜小胞で取り囲み、細胞内で高い分解活性を持つ酸性の小器官である液胞(あるいはリソソーム)に運ぶことで、分解・消化する仕組み。タンパク質や脂質をアミノ酸や脂肪酸にまで分解することで、それらを新しいタンパク質の合成や若い器官の形成に再利用できる。
[2] ミトコンドリア
動植物を含むほとんど全ての真核生物の細胞に存在する二重膜のオルガネラであり、主に呼吸によるエネルギー生産を担う。内膜の電子伝達鎖によるエネルギー生産の過程で、副次的に活性酸素が形成されてしまうため、酸化障害が起こりやすい。
[3] マイトファジー
ミトコンドリアを分解対象とするオートファジーのこと。哺乳類や酵母においては、特にその仕組みや重要性について盛んに研究されてきており、機能障害を起こした、あるいは余分となったミトコンドリアはマイトファジーで積極的に取り除かれることが知られている。植物でマイトファジーが起こる直接的な証拠はこれまで示されていなかった。
[4] マルチビーム走査型2光子顕微鏡
スピニングディスク共焦点ユニットによる多点ビーム照射と、近赤外波長レーザーによる2光子励起技術を組み合わせた新しいタイプの顕微鏡装置。生きた細胞内構造の3D形態やその時間変化の正確な観察に適しており、現在、自然科学研究機構・生命創成探究センター・バイオフォトニクス研究グループにおいて、さらなる高度化が進められている。
本件に関するお問い合わせ先
研究者連絡先
理化学研究所 環境資源科学研究センター 分子生命制御研究チーム
上級研究員 泉 正範(いずみ まさのり)
チームリーダー 萩原 伸也(はぎはら しんや)
訪問研究員 中村 咲耶(なかむら さくや)
自然科学研究機構 生命創成探究センター/生理学研究所
教授 根本 知己 (ねもと ともみ)
東北大学大学院 生命科学研究科
准教授 日出間 純 (ひでま じゅん)
報道連絡先
理化学研究所 広報室 報道担当
自然科学研究機構 生命創成探究センター 広報担当
東北大学大学院生命科学研究科 広報室