2021-01-15 鳥取大学,日本医療研究開発機構
発表者
中村貴史(鳥取大学医学部医学科ゲノム再生医学講座分子医学分野 准教授)
中武大夢(鳥取大学医学部医学科ゲノム再生医学講座分子医学分野 プロジェクト研究員)
桑野望(鳥取大学医学部医学科ゲノム再生医学講座分子医学分野 大学院生 研究当時)
発表のポイント
- 新しいがん治療“ウイルス療法”への応用が期待される次世代がん治療用ワクシニアウイルス(注1)(FUVAC)を単離した。
- FUVACは、従来のがん治療用ワクシニアウイルスでは見られない細胞融合を生じながら増殖する特性を持っている。
- この特性によって、直接的ながん細胞の溶解が高まり、それに伴って腫瘍内の免疫抑制環境(注2)が改善されることで、より効果的に抗腫瘍免疫応答(注3)が賦活化されることを見出した。
- さらにFUVACは、免疫チェックポイント阻害薬(注4)抵抗性の腫瘍を応答性に変えることを見出した。
発表概要
ウイルス療法は、がん治療用ウイルスによってがん細胞を直接溶解し破壊する局所療法が、抗腫瘍免疫応答を賦活化し、全身のがんにも治療効果を及ぼすという新しい概念のがん治療法です。しかしながら、ウイルスを投与したがん原発巣における治療効果は十分であるものの、ウイルスを投与しない転移巣における治療効果は限定的であるなどの問題点が残されています。
今回、鳥取大学医学部医学科ゲノム再生医学講座分子医学分野の中村貴史准教授、中武大夢プロジェクト研究員、桑野望大学院生(研究当時)らの研究グループは、従来のがん治療用ワクシニアウイルスでは見られない細胞融合を生じながら増殖する次世代ウイルスFUVACを単離し、担がんマウスモデルにおいて、より高い抗腫瘍効果を発揮することを実証するとともに、その作用機序を解明しました。また、FUVACと免疫チェックポイント阻害薬抗PD-1抗体との併用により、腫瘍を完全に退縮させることにも成功しました。
本研究の成果は、日本時間2020年12月18日に国際科学誌Molecular Therapyのオンライン版に掲載されました。
発表内容
研究の背景
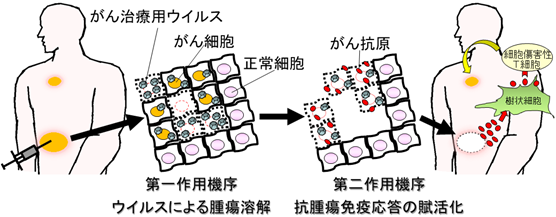
ウイルス療法は、正常細胞は傷害せず腫瘍のみを標的破壊するように改良したがん治療用ウイルスを抗がん剤として用いる新しいがん治療法であり、2015年の米国でのがん治療用ウイルス薬の承認を皮切りに、世界中で研究・開発競争が激化しております。ウイルス療法の作用機序は、第一にウイルスが感染したがん細胞・組織内で増殖伝播することによって直接腫瘍を溶解します。第二にそれに伴って抗腫瘍免疫応答が賦活化され全身に治療効果を発揮します(図1)。
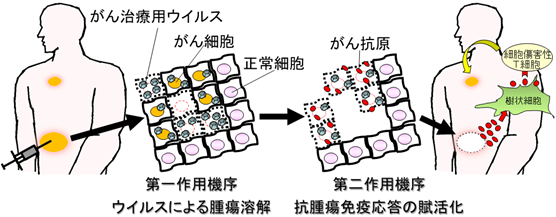
図1.ウイルス療法の概念図
この多様な作用機序により、がん治療用ウイルスを腫瘍内に投与する局所療法が、抗腫瘍免疫応答を賦活化し、遠隔に位置する転移がんに対しても全身性に治療効果を発揮する画期的ながん治療法であると言えます。しかしながら、ウイルスが直接行き渡らない遠隔腫瘍への治療効果はウイルスによる直接作用を欠いてしまうため、投与局所と比較するとその効果が弱まる傾向にあります。さらに腫瘍内の免疫抑制環境などにより、投与局所においても十分な治療効果が得られない場合も存在します。
研究手法と成果
これまで当研究グループは、ワクシニアウイルスの持つ細胞増殖促進因子をコードするVGFとO1L遺伝子を欠損させることで、MAPK経路の異常により過剰な細胞増殖促進状態にあるがん細胞でのみウイルス複製が可能となるがん治療用ワクシニアウイルスMDRVVの独自開発に成功してきました。本研究では、MDRVVを細胞中で複製させている際、通常では見られない細胞融合しながら増殖するウイルスを発見し、その単離に成功しました。単離されたウイルスは、全ゲノムシークエンス解析によってウイルスの持つK2L遺伝子にナンセンス変異が生じていることが判明し、Fusogenic Oncolytic Vaccinia Virus(FUVAC)と名付けました(図2)。
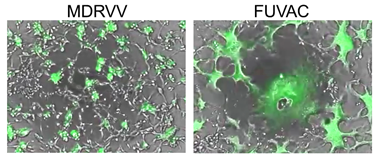
図2.緑色蛍光タンパク質(GFP)遺伝子を搭載発現するMDRVV、またはFUVAC感染後のマウス大腸癌CT26細胞
そこで、細胞融合を生じることなく増殖する従来のMDRVVと細胞融合を生じながら増殖するFUVACの抗がん効果を比較すべく、マウス大腸癌CT26細胞を両側の皮下に移植した担癌マウスモデルにおいて、各ウイルスを片側の腫瘍内にのみ投与しました。その結果、MDRVVを投与した局所の腫瘍(=原発巣)での治療効果は十分に得られるものの、MDRVVを投与しない遠隔の腫瘍(=転移巣)では十分な治療効果が得られないことが分かりました。それに対してFUVACは、投与側の腫瘍だけではなく非投与側の腫瘍に対しても、MDRVVと比べ有意な治療効果を発揮しました。組織学的および免疫学的解析によってFUVACの作用機序を詳細に調査したところ、
- ウイルスを投与した腫瘍内において細胞融合を引き起こすことで、広範な腫瘍溶解が生じ、
- それに続き抗腫瘍免疫応答を惹起しやすいと知られている免疫原性細胞死が誘導され、
- 腫瘍内の制御性T細胞、腫瘍関連マクロファージや骨髄由来免疫抑制細胞が減少することで免疫抑制環境が改善されるとともに、
- ウイルスを投与した腫瘍だけではなく投与しない腫瘍への細胞傷害性T細胞の浸潤が高まることで
より効果的に抗腫瘍免疫応答が賦活化されることを見出しました(図3)。
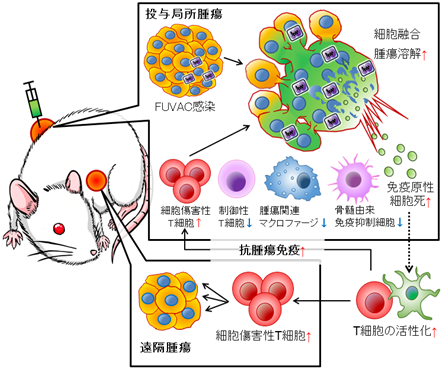
図3.FUVACの作用機序
又、これらFUVACの作用機序は、抗腫瘍免疫応答のスタート役そしてアクセル役となるため、そのブレーキの解除役である免疫チェックポイント阻害剤との併用に適していることが示唆されました。そこで同様の担がんマウスモデルを用いてFUVACと抗PD-1抗体との併用を検討しました。その結果、MDRVVまたはFUVACの単独、およびMDRVVと抗PD-1抗体の併用では十分な治療効果が得られなかったのに対し、FUVACと抗PD-1抗体の併用では投与側腫瘍を完全に退縮させたのみでなく、半数のマウスで非投与側腫瘍も完治させるに至りました。抗PD-1抗体単独では治療効果が得られなかったことから、FUVACにより腫瘍内免疫環境が改善し、免疫チェックポイント阻害薬抵抗性の腫瘍を応答性に変えることで、抗がん効果をより効果的に最大化できることを実証しました(図4)。
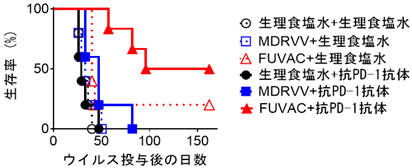
図4.がん治療用ウイルスと抗PD1抗体との併用による治療効果
今後期待される展開
今後、FUVACの作用機序をより深く解明するとともに、この次世代がん治療用ワクシニアウイルスの早期実用化を目指して、トランスレーショナルリサーチや製薬企業への導出を推進していきます。一方、免疫チェックポイント阻害薬は標準療法では治癒できないような難治性の進行がんに対しても優れた効果を示しますが、抗腫瘍免疫が十分に誘導されていない患者さんには効果が認められません。従ってFUVACとの併用はこの問題を解決する1つの手段となることが期待されます。
研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「次世代がん治療用ワクシニアウイルスの研究開発」(研究代表者:中村貴史)をはじめ、AMED再生医療・遺伝子治療の産業化に向けた基盤技術開発事業「日本発がん治療用ウイルス開発の革新技術研究拠点」(研究代表者:藤堂具紀)、日本学術振興会科学研究費助成事業基盤研究(B)「MAPK/ERK経路の異常を指標にしてを標的破壊するウイルス療法の開発」および「がん原発巣と転移巣の両方の根治を目指した抗がんウイルス療法の新戦略」(研究代表者:中村貴史)、AMED橋渡し研究戦略的推進プログラム事業(シーズA・九州大学拠点)「難治性がんを標的破壊する次世代遺伝子組換えワクシニアウイルスの開発」(研究代表者:中村貴史)などの支援により行われました。
用語説明
- (注1)がん治療用ワクシニアウイルス
- ワクシニアウイルスは天然痘のワクチン株として樹立されたウイルス株であり、ワクチンという言葉の語源とされています。実際に天然痘が根絶される1980年まで種痘接種に用いられるなど、既にヒトで使われてきた実績があります。また、その増殖の速さ、様々ながん細胞への感染能、変異原性の低さなどの特性を持っており、ウイルス療法に適したウイルスと言えます。一方、がん治療用ウイルスとは、遺伝子換え技術を用いてウイルスゲノムを再設計して、がん細胞では複製しても正常細胞では複製しない人工的に作製したウイルスのことで、本研究ではMDRVVやFUVACのことを指します。
- (注2)免疫抑制環境
- がん細胞が宿主からの免疫応答を回避し自身の成長・生存に有利な環境を生み出す防御機構のことです。具体的には、がん細胞自身の持つ免疫チェックポイント機構と、がん細胞が自身の味方としてリクルートしてくる抑制性の免疫細胞集団です。前者はPD-1とPD-L1などに代表される分子レベルでの免疫抑制機構であり、後者は制御性T細胞、腫瘍関連マクロファージや骨髄由来免疫抑制細胞といった免疫抑制能を持った細胞群による細胞レベルでの抑制機構であります。がんはこれらの機構を複合的に組み合わせることにより抗腫瘍免疫から逃れるための微小環境を構築し、宿主の免疫応答のみでなくがん免疫療法への抵抗性も生み出しています。
- (注3)抗腫瘍免疫応答
- 宿主ががんを異物であると認識し、がんを排除する機構のことです。抗腫瘍免疫応答が機能するには、7ステップ(①がん細胞からがん抗原の放出、②樹状細胞によるがん抗原の捕獲と提示、③樹状細胞によるT細胞の感作と活性化、④活性化した細胞傷害性T細胞の腫瘍への遊走、⑤細胞傷害性T細胞の腫瘍への浸潤、⑥細胞傷害性T細胞によるがん細胞の認識、⑦細胞傷害性T細胞によるがん細胞の殺傷)にて一巡するがん免疫サイクルが回り続けることが重要です。がん患者の多くは、これらの一連のステップのうち、ひとつまたは複数で障害が生じており、効果的な抗腫瘍免疫応答が誘導されなくなってしまっています。従って免疫によるがん治療は、いかに抗腫瘍免疫応答を賦活化するかがキーポイントとなります。
- (注4)免疫チェックポイント阻害薬
- 免疫チェックポイント分子あるいはそのリガンドであるPD-1やPD-L1、CTLA-4などを標的として、その機能を阻害する治療薬です。PD-1やCTLA-4は主に細胞傷害性T細胞の持つチェックポイント分子であり、どちらもリガンドからのシグナルが入ることでT細胞の活性が抑えられます。この機構は本来自己免疫応答を避けるための機構でありますが、がん細胞はこの機構を自身の防御のために流用してしまいます。特にPD-1のリガンドであるPD-L1は多くのがん細胞でその発現亢進が認められており、細胞傷害性T細胞による攻撃を回避する大きな要因となっています。本阻害薬は、これらの分子を抗体によって塞いでしまうことで、宿主免疫によるがんの攻撃に余計なブレーキが掛からないように働くわけです。
発表情報
- 雑誌名
- Molecular Therapy
- 論文タイトル
- Fusogenic oncolytic vaccinia virus enhances systemic antitumor immune response by modulating the tumor microenvironment
- 著者
- Motomu Nakatake, Nozomi Kuwano, Emi Kaitsurumaru, Hajime Kurosaki, and Takafumi Nakamura
- DOI番号
- 10.1016/j.ymthe.2020.12.024
お問い合わせ先
研究に関すること
鳥取大学医学部医学科 ゲノム再生医学講座分子医学分野
准教授 中村貴史(なかむらたかふみ)
報道に関すること
鳥取大学米子地区事務部総務課広報係
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当