2021-02-09 理化学研究所
理化学研究所(理研)開拓研究本部眞貝細胞記憶研究室の島津忠広専任研究員、眞貝洋一主任研究員らの国際共同研究グループは、タンパク質のヒスチジン残基をpiメチル化する修飾酵素を世界で初めて発見しました。
本研究成果は、生物が持つ普遍的な仕組みであるタンパク質の翻訳後修飾[1]を担う未知の酵素を明らかにしたもので、今回の発見を契機として、ヒスチジンメチル化修飾が関わる生命現象が次々に解き明かされていくことが期待できます。
タンパク質のヒスチジン残基のメチル化には、イミダゾール環のN1の位置で起こるpiメチル化と、N3の位置で起こるtauメチル化の二つがあります。しかし、piメチル化に関与する酵素はこれまで知られていませんでした。
今回、国際共同研究グループは、タンパク質のヒスチジン残基をpiメチル化する修飾酵素「METTL9」を発見しました。この酵素は、ヒトからショウジョウバエ、線虫に至るまで多くの真核生物に存在し、さまざまなタンパク質の繰り返しヒスチジン配列(HxH配列)中のヒスチジン残基をpiメチル化することが分かりました。さらに、METTL9による生命機能調節の例として、ミトコンドリア[2]の呼吸能(酸化的リン酸化)に関わるタンパク質や、免疫・細菌感染防御に関わるタンパク質のpiメチル化を見いだしました。
本研究は、オンライン科学雑誌『Nature Communications』(2月9日付)に掲載されます。
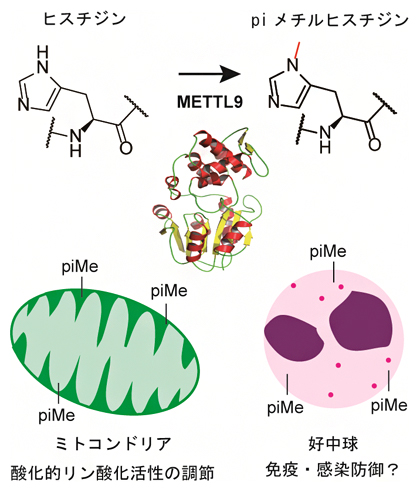
タンパク質ヒスチジン残基のpiメチル化(上)とその生命機能の例(下)
背景
タンパク質の翻訳後修飾は、可逆的な分子調節機構として原核生物から真核生物に至るまで、広くタンパク質に起こることが知られています。特にヒトをはじめとした真核生物では、ヒストンのアセチル化やメチル化がエピゲノム[3]制御の中心的な役割を果たすことなどから、注目を集めています。
タンパク質のヒスチジン残基は、それぞれイミダゾール環のN1またはN3位置のいずれかでメチル化され、piメチルヒスチジン(1-メチルヒスチジン)またはtauメチルヒスチジン(3-メチルヒスチジン)が生成します。ヒスチジンは、タンパク質を構成するアミノ酸の中で最も変化に富むアミノ酸の一つです。そのイミダゾール環の両方の窒素原子がプロトン化(水素イオンが付加)され、生理学的pHで中性および正に帯電した形態のヒスチジンを生成する可能性があります。そのため、ヒスチジンは触媒残基となり、塩基または酸として機能します。さらに、局所pHのセンサーにもなり、金属カチオン(陽イオン)の配位などさまざまな相互作用に関与します。つまり、ヒスチジン残基のメチル化は、広範囲にわたる分子相互作用と細胞プロセスを調節する可能性があります。
ヒスチジン残基のメチル化が最初に発見されたのは50年以上前で、筋肉の収縮時に働くアクチンやミオシンにtauメチルヒスチジンが含まれていることが示されました。以来、それらの触媒酵素は不明なままでしたが、2018年になり、「SETD3」がアクチンのヒスチジン残基へのtauメチルヒスチジン導入(tauメチル化)に関与する酵素であり、SETD3を介したtauメチル化がアクチン機能と筋肉収縮性の調節に重要な役割を果たすことが示されました注1-2)。しかし、piメチル化に関与する酵素については、これまで知られていませんでした。
注1)Wilkinson,A.W. et al. SETD3 is an actin histidine methyltransferase that prevents primary dystocia. Nature 565, 372-376 (2019).
注2)Kwiatkowski,S. et al. SETD3 protein is the actin-specific histidine N-methyltransferase. Elife. 7, e37921 (2018).
研究手法と成果
ゲノム解析から、ヒトゲノム上には200種類以上のメチル化酵素遺伝子が存在すると推定されていますが、そのうち100種類程度の遺伝子の機能は明らかになっていません。今回、国際共同研究グループは、ヒトに存在するメチル化酵素のうち、機能不明な7-βストランド型メチル化酵素(7BSMTase)[4]を調査する取り組みの一環として研究に着手し、タンパク質のヒスチジン残基をpiメチル化する修飾酵素「METTL9」を発見しました。
METTL9は、典型的な7BSMTaseに特徴的なモチーフ[5]を含む以外には、他のヒト7BSMTaseとの有意な配列相同性を示しません。また、METTL9オーソログ[6]は、ヒトからショウジョウバエ、線虫に至るまで真核生物の多くに存在するものの、真菌(カビ)や陸上植物には存在しません(図1a)。METTL9の基質として発見したタンパク質の一つであるARMC6のメチル化を調べたところ、ヒスチジン残基がpiメチル化されることが分かりました(図1b, c)。さらにARMC6だけでなく、METTL9はさまざまなタンパク質の繰り返しヒスチジン配列(HxH配列)中のヒスチジン残基をpiメチル化することが分かりました(図1c)。
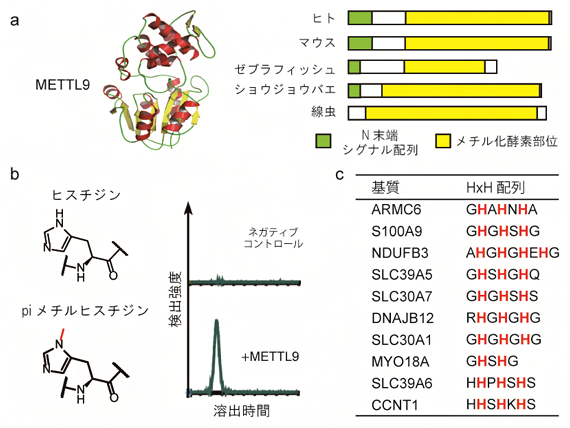
図1 ヒスチジン残基をメチル化する酵素「METTL9」
a)左は、METTL9の7-βストランド型メチル化酵素(7BSMTase)に特徴的な立体構造。右は、METTL9オーソログを示したもので、種間でメチル化酵素部位の配列やモチーフの一種であるN末端シグナル配列が高い相同性を示すことが分かる。
b)METTL9を基質の存在下で反応させた後、液体クロマトグラフィーで分離・検出したところ、piメチルヒスチジンのピークが検出された。
c)METTL9は、ARMC6のほかにもS100A9、NDUFB3、SLC39A5などのタンパク質における繰り返しヒスチジン配列(HxH配列)中のヒスチジン残基をpiメチル化する活性を示した。
次に、METTL9の機能を欠失させたMettl9ノックアウト(KO)マウスを作製し、そのさまざまな組織で、タンパク質中のメチルヒスチジンの量を調べました。その結果、KOマウスの脳、心臓、肝臓など各組織でpiメチルヒスチジンの著しい減少が見られました。また、METTL9依存性のpiメチルヒスチジンの量は組織間で異なっていました(図2)。このことは、METTL9を介したメチル化が哺乳類の組織の広い範囲で発生し、METTL9がタンパク質のpiメチルヒスチジンを生成する主要な酵素であることを示しています。
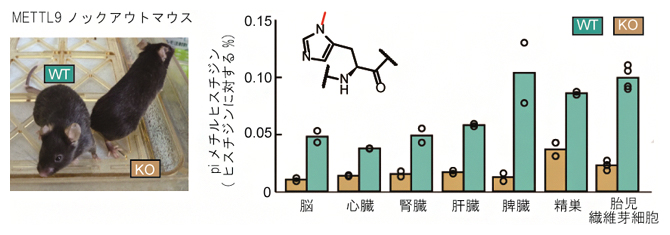
図2 マウス組織中のタンパク質性piメチルヒスチジン
METTL9ノックアウト(KO)マウスでは、野生型(WT)マウスに比べて各組織のタンパク質に含まれるpiメチルヒスチジンの量が著しく減少した。
さらに、METTL9によるヒスチジン残基のpiメチル化が果たす生命機能の一例として、METTL9 KO細胞(ヒト由来)ではミトコンドリアの呼吸能(酸化的リン酸化活性)が低下することを発見しました(図3a)。したがって、METTL9によるpiメチル化はミトコンドリアの呼吸能を調節している可能性があります。
また、HxH配列ペプチドと金属イオンとの相互作用を調べたところ、piメチル化されたHxH配列ペプチドでは亜鉛イオンとの結合が減弱することが分かりました(図3b)。免疫・細菌感染防御に関わるタンパク質S100A9はMETTL9でpiメチル化されますが、金属イオンとの結合活性が重要です。したがって、METTL9によるpiメチル化は免疫・細菌感染防御に関わっている可能性があります。
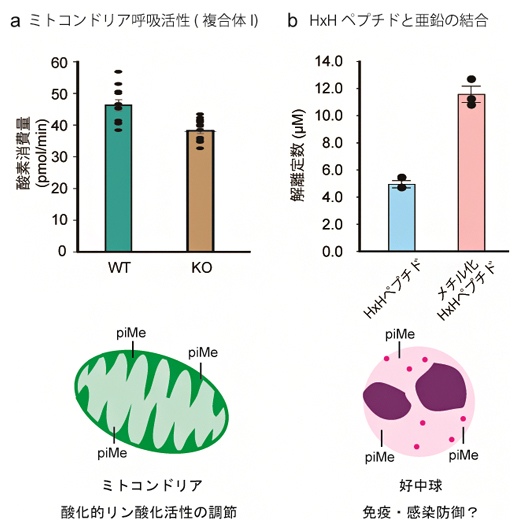
図3 タンパク質ヒスチジンメチル化の生命機能
a)METTL9 KO細胞の複合体I特異的な呼吸活性は、野生型(WT)細胞に比べて著しく下した。
b)HxH配列ペプチドと亜鉛イオンとの解離定数を測定した。HxH配列中のヒスチジン残基をpiメチル化したメチル化HxHペプチドでは、解離定数が著しく上昇し、亜鉛イオンとの相互作用が低下した。
今後の期待
本研究では、これまで未発見であったタンパク質のヒスチジン残基をpiメチル化する酵素として、METTL9を世界で初めて発見しました。
タンパク質の翻訳後修飾は、生物の発生・分化から老化・疾患に至るまで、あらゆる局面で重要な役割を果たす分子調節機構です。今回の発見が契機となり、ヒスチジンのpiメチル化が「タンパク質修飾の新大陸」として認識され、世界中でさらなる研究が進められることが期待できます。
補足説明
1.翻訳後修飾
タンパク質が生合成された後(翻訳後)に,タンパク質へ付加されるさまざまな修飾のこと。リン酸化、アセチル化、メチル化、糖鎖付加などが知られている。
2.ミトコンドリア
真核生物の細胞小器官の一つであり、二重の生体膜につつまれ、独自のDNA(ミトコンドリアDNA)を持つ。酸素呼吸(好気呼吸)の場として知られている。
3.エピゲノム
生物のDNAやヒストンタンパク質に起こる化学修飾で、DNAのメチル化やヒストンのアセチル化、メチル化、リン酸化などがある。これらの修飾状態は、細胞複製を越えて維持され、世代を超えて生物の子孫に受け継がれることもある。
4.7-βストランド型メチル化酵素(7BSMTase)
ヒトでは、タンパク質のメチル化は、SETドメイン型メチル化酵素と7-βストランド型メチル化酵素(7BSMTase)の二つの異なるクラスに属する、S-アデノシルメチオニン(SAM)依存性メチル化酵素によって触媒される。SETドメイン型メチル化酵素は、主としてヒストンのリシン残基特異的なメチル化酵素を含み、エピゲノムに重要である一方、7BSMTaseは広範囲の基質を標的とする。
5.モチーフ
タンパク質の二次構造の簡単な組み合わせが複数のタンパク質の中で共通に見られることがあり、これを超二次構造またはモチーフと呼ぶ。
6.オーソログ
種分岐の過程で共通の祖先遺伝子から生じた相同な遺伝子のこと。
国際共同研究グループ
理化学研究所
開拓研究本部
眞貝細胞記憶研究室
専任研究員 島津 忠広(しまづ ただひろ)
主任研究員 眞貝 洋一(しんかい よういち)
袖岡有機合成化学研究室
専任研究員 五月女 宜裕(そうとめ よしひろ)
テクニカルスタッフⅠ 赤壁 麻依(あかかべ まい)
主任研究員 袖岡 幹子(そでおか みきこ)
環境資源科学研究センター
技術基盤部門生命分子解析ユニット
専任技師 鈴木 健裕(すずき たけひろ)
ユニットリーダー 堂前 直(どうまえ なおし)
生命機能科学研究センター
エピジェネティクス制御研究チーム
研究員 菊地 正樹(きくち まさき)
チームリーダー 梅原 崇史(うめはら たかし)
オスロ大学数 学自然科学部
教授 ポール・ファルネス(PalO. Falnes)
シュトゥットガルト大学 生化学技術研究所
教授 アルバート・ジェルチ(Albert Jeltsch)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究(B)「METTL9によるIDH2ヒスチジンメチル化修飾の意義(研究代表者:島津忠広)」による支援を受けて行われました。
原論文情報
Erna Davydova, Tadahiro Shimazu, Maren Kirstin Schuhmacher, Magnus E. Jakobsson, Hanneke L.D.M. Willemen, Tongri Liu, Anders Moen, Angela Y.Y. Ho, Jędrzej Małecki, Lisa Schroer, Rita Pinto,Takehiro Suzuki, Ida A. Grønsberg, Yoshihiro Sohtome, Mai Akakabe, Sara Weirich, Masaki Kikuchi, Jesper V. Olsen, Naoshi Dohmae, Takashi Umehara, Mikiko Sodeoka, Valentina Siino, Michael McDonough, Niels Eijkelkamp, Christopher J. Schofield, Albert Jeltsch, Yoichi Shinkai, Pål å. Falnes, “The methyltransferase METTL9 mediates pervasive 1-methylhistidine modification in mammalian proteomes”, Nature Communications, 10.1038/s41467-020-20670-7
発表者
理化学研究所
開拓研究本部 眞貝細胞記憶研究室
専任研究員 島津 忠広(しまづ ただひろ)
主任研究員 眞貝 洋一(しんかい よういち)
報道担当
理化学研究所 広報室 報道担当