短腸症候群をはじめとする小腸疾患の病態理解と治療開発に光明
2021-02-25 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授、杉本真也助教、同臓器再生医学寄附講座の小林英司特任教授らの共同研究グループは、上皮を剥がした大腸にオルガノイド(注1)と呼ばれる技術で培養した小腸上皮を移植することで、小腸に特有の吸収・蠕動機能などを備えた大腸(小腸化大腸)を作製する技術を開発しました。
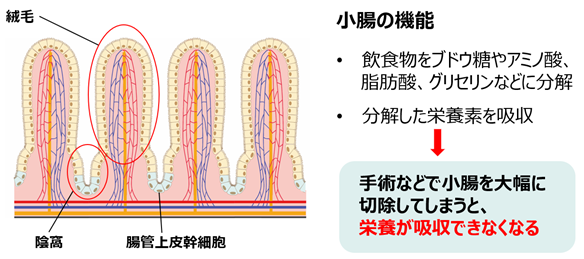
小腸には、絨毛(じゅうもう)という固有の突起構造(図1)があり、食べ物の消化吸収という大切な役割を果たしています。これに対し、大腸にはそうした突起構造がなく、栄養の消化吸収はほとんどできません。なぜ絨毛の突起構造が小腸でのみ作られるのかは長年の謎でした。今回、研究グループは、小腸内側の上皮が腸液の流れを感じとって絨毛突起構造を作り出すことを突き止め、絨毛のある小腸上皮オルガノイドの培養に成功しました。この発見によって、大腸を小腸に類似した移植片に作り変えることを可能とする技術(小腸化大腸技術)を開発しました。さらに、本技術で作成した小腸化大腸をラット短腸症候群モデルに移植することによって、短腸症候群のラットに治療効果があることを世界で初めて示しました。
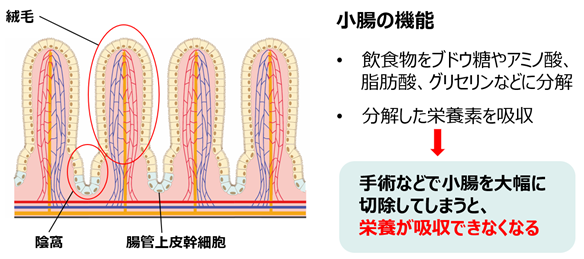
図1 小腸の突起構造(絨毛)と働き
クローン病や腸捻転、新生児期の重篤な腸炎などで小腸の大部分を切除した患者は、タンパク質・糖・脂質などを消化吸収する機能が十分ではないため、極めて予後の悪い短腸症候群を発症します。現在、重症の短腸症候群に対する唯一の根本的治療は小腸移植ですが、ドナー不足や他の臓器と比較し強い拒絶反応を示すなどの問題があり、移植の実施は他の臓器に比べ少数にとどまっています。こうした中、小腸移植に代わる治療法として再生医療の開発が期待されてきましたが、吸収した栄養を全身に運ぶ血管・リンパ管を含めた複雑な臓器を作製することは不可能でした。今回開発された小腸化大腸技術は、既にある別の臓器を必要な臓器に作り変えるものであり、再生医療による拒絶反応のない臓器移植の実現を一歩前進させるものとなります。また、本研究は小腸絨毛の突起構造の成り立ちの一端を解明したことから、様々な小腸疾患の病態理解につながることが期待されます。
本研究成果の詳細は、2021年2月24日(英国時間)に英科学誌『Nature』電子版に掲載されました。
研究の背景と概要
待ち望まれていた新しい概念の小腸移植
小腸粘膜は、栄養や水分の吸収という生命維持に欠かせない機能を有しています。小腸の表面は上皮細胞で覆われており、効率的な消化・吸収のために絨毛と呼ばれる長さ0.5mm程度の無数の突起が存在し、絨毛の間には陰窩と呼ばれるくぼみがあります(図1)。陰窩の底部には腸管上皮幹細胞が存在しており、この細胞が小腸上皮の再生機構を司り、体内で最も速い上皮の新陳代謝を可能としています。腸管上皮幹細胞は、生涯自分自身を複製し続けるとともに(自己複製能)、腸組織の全てのタイプの細胞に分化し(多分化能)、陰窩から絨毛へと移動していきます。
クローン病などの疾患で小腸を大幅に切除すると、消化吸収機能障害が永続する短腸症候群を発症することがあります。重症例では口から食事を取ることができず、チューブから静脈に栄養を注入する中心静脈栄養法で管理することになりますが、その結果、経静脈カテーテル感染症、肝機能障害などの重篤な合併症で生命を落としたり、著しく生活の質が低下したりする場合があります。このような症例の治療法として、残されたわずかな小腸を切り合わせ長さを延長する手術や、海外ではGLP-2製剤という腸の絨毛の発育を促す薬剤を投与する薬物治療があります(国内未承認)。しかし、こうした治療はいずれも効果が不十分であり、根本的な治療法は健全な小腸を他人から移植する小腸移植しかありません。ところが、小腸は他の臓器より拒絶反応が強いため、移植片の生着率も生存率も低く、国内での小腸移植は、初めて行われた1996年から2019年12月までのおよそ20年間でわずか28人の患者に32例(生体移植13例、脳死移植19例)実施されたにすぎず、限られた施設での実施にとどまっています。また、仮に移植が成功したとしても、拒絶反応の心配や、免疫抑制剤内服に伴う感染症、悪性腫瘍の発生などの問題があります。このため他の臓器の移植数の増加に逆行して、小腸移植は少数にとどまっているのが現状です。
現在、絶対的な治療法のない難治性の小腸疾患に対し、革新的な新規治療法へのニーズは大きく、再生医療にも期待が寄せられています。しかし、小腸は、くぼみ(陰窩)と突起(絨毛)の構造に加え、血管、脂質の吸収に関わるリンパ管、神経、筋層などを持つ非常に複雑な構造であるため、すべてを体外で構築することが困難であり、小腸疾患に対する再生医療の構想はこれまで現実的ではありませんでした。
大腸の上皮だけを小腸に置き換え、小腸として機能させる
佐藤俊朗教授、杉本真也助教らの研究グループは、これまでに、腸の上皮から調製した腸管上皮幹細胞をオルガノイドと呼ばれる立体的な培養細胞の塊として永続的に培養可能とする技術を確立してきました(Sato T, et al. Nature 2009、Fujii M, et al. Cell Stem Cell 2018)。オルガノイドは、生体外におけるヒト上皮細胞の研究ツールとしてのみならず、ヒトの腸の細胞をそのまま培養する組織幹細胞であることから、移植細胞としての可能性も期待されています。しかし、前述のようにヒトの小腸上皮細胞の集合体からヒトの小腸そのものを創出することはできず、加えて、ヒトの正常な腸管上皮細胞を移植することは、技術的に困難でした。最近、研究グループは免疫不全マウスの大腸上皮を剥がし、ヒト大腸上皮に入れ替えることで、マウスにヒト正常大腸上皮を構築する技術の開発に成功しました(Sugimoto S, et al. Cell Stem Cell 2018)。この技術を応用し、短腸症候群患者の大腸上皮を培養した小腸上皮に入れ替える再生医療を実現できないかと考え、本研究を着想しました(図2)。
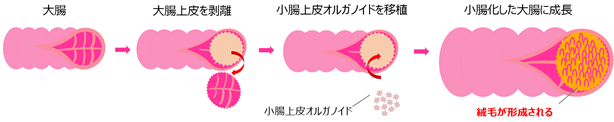
図2 小腸化大腸の作製
研究の成果と意義・今後の展開
ヒト小腸上皮は、マウスの大腸に移植されても小腸上皮の形質を発現
今回、研究グループは、まずマウスの大腸上皮を剥がし、ヒト小腸上皮の移植を試みました。その結果、移植された小腸上皮は、大腸上皮の移植時とは異なる絨毛構造を形成し、小腸にしか見られない消化・吸収に関わるタンパク質の発現を認めました。吸収に重要な微絨毛の形成も電子顕微鏡像で観察されました。さらに、脂質の吸収に重要な乳び管と呼ばれる小腸に特有なリンパ管が、小腸上皮の移植によって大腸でも形成されることを確認しました。これにより、上皮を入れ替えた小腸化大腸は、栄養を消化・吸収し、乳び管様構造を通して体内に運搬できることがわかりました(図3)。
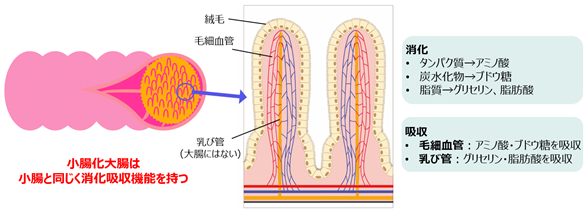
図3 小腸化大腸の絨毛と消化吸収機能
小腸上皮の絨毛突起は、腸液の「流れ」により形成される
一方で、マウスの肛門付近の直腸の部位に移植して形成されたヒト小腸上皮の絨毛構造は、本来のものと比較すると未熟で、不十分な状態でした。ヒトの腸管内容物は小腸を液状で通過し、大腸を進むにつれ水分や塩類を吸収され、糞便として固まっていきます(図4)。このため、大腸の最後の部分にあたる直腸の近傍では腸液の「流れ」が不十分であるために絨毛構造の形成が促進されない可能性が考えられました。
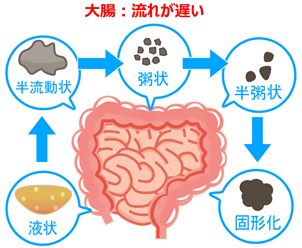
図4 大腸の水分吸収と飲食物の変化:液状→固形に
そこで研究グループは、大腸と小腸のオルガノイドをシート状に培養し、細胞が平面的に広がった状態で培養液を人工的に攪拌して「流れ」を作り、この環境下でさらに培養を行いました。その結果、小腸オルガノイドは管腔側に突出する絨毛様の構造を形成しました。一方、大腸オルガノイドではそのような変化はみられず平面のままであり、「流れ」に依存する小腸上皮に特有の絨毛形成メカニズムが存在することがわかりました(図5)。
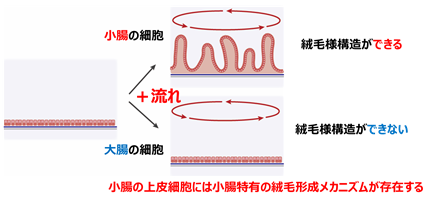
図5 二次元培養での小腸上皮の絨毛様構造の形成
小腸上皮オルガノイドを使用した短腸症候群の治療をラットで実証
次に研究グループでは、これらの知見をもとに、小腸上皮オルガノイドを用いることで短腸症候群が治療可能であることを実証する実験を、ラットで行いました。慶應義塾大学医学部の小林英司特任教授、日本獣医生命科学大学の袴田陽二教授と共同で、ルシフェラーゼという発光物質を発現するラットの小腸の細胞から樹立した小腸オルガノイドを移植した小腸化大腸を作製し、通常のラットへの移植実験を行うことにしました。
まず、栄養血管の血流を保ったまま大腸の一部を切り離しました(図6左)。手術中に、切り離した大腸の上皮を剥ぎ、その部位に小腸オルガノイドを移植しました。さらに、この移植片を腹壁に縫い付け、上皮が生着し育ち始めるまでの間、血流を維持しつつラットの体内で保存しました(図6中央)。この手法により、便の通過がない状態を保てるため、移植した小腸上皮細胞が流されることなく大腸組織に生着するのを待つことが可能となり、広い範囲に小腸オルガノイドを移植することが可能となりました。
しかし腹壁に縫い付けられた状態では移植後の小腸上皮表面には「流れ」がないため、十分な絨毛が形成されませんでした。そこで、全小腸を切除して短腸症候群を再現したラットにおいて、小腸に隣接し腸管内に「流れ」が存在する部位である回腸末端部に移植を行い、移植後に「流れ」のある環境で分化・成熟したオルガノイド由来の腸上皮細胞が形成する構造と移植片の機能、短腸症候群に対する移植の効果について、小腸上皮オルガノイド用いた場合と大腸オルガノイドを用いた場合とで比較検討しました(図6右)。
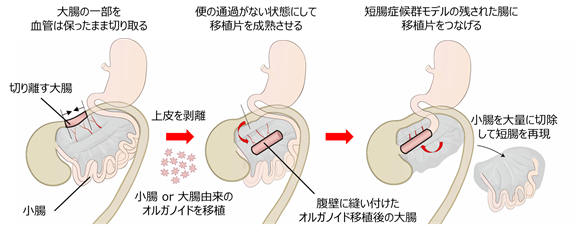
図6 ラットでの小腸化大腸の治療効果の実証
その結果、小腸オルガノイド移植群では生存期間が延長し、生存しているラットでは移植細胞の広範な生着、絨毛の形成が確認できました。これに対し大腸オルガノイド移植群では生存期間の延長はみとめられませんでした。小腸オルガノイド移植群の移植片はマウスでの実験と同様に、乳び管、血管の形成や、神経伝達を伴う腸管蠕動運動を認め、脂質、糖、ペプチドなどの吸収能をもつ機能的な小腸化移植片であることが確認できました。
以上より、小腸上皮は移植された組織の構造を変化させ、再デザインする能力を有することが明らかになりました。小腸オルガノイドを大腸の上皮と置換した小腸化大腸を移植する戦略は、マウスやラットと比較し個体のサイズが大きなヒトにおいても応用可能と考えられ、今後、自身のオルガノイドを用いた免疫抑制剤を必要としない新規治療法開発への道筋となることが期待されます。また、小腸上皮がもつ絨毛構造という消化・吸収に関わる重要な構造の形成についての新たな知見を得られる研究手法でもあることから、様々な小腸疾患の病態理解への糸口となることが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「新しい4次元モデルシステムを用いた腸管線維化疾患の病態解明」(研究開発代表者:佐藤俊朗)・再生医療実現拠点ネットワークプログラム「培養腸上皮幹細胞を用いた炎症性腸疾患に対する粘膜再生治療の開発拠点」、JSPS科研費JP20H03746、JP17H06176、公益財団法人持田記念医学薬学振興財団研究助成金、慶應義塾学事振興資金の支援によって行われました。
論文
- タイトル
- An organoid-based organ-repurposing approach to treat short bowel syndrome
- タイトル和訳
- オルガノイドを用いた臓器転用アプローチによる短腸症候群治療
- 著者名
- 杉本真也、小林英司、藤井正幸、太田悠木、新井一也、股野麻未、石川景子、宮本健太郎、利光孝太、高橋シリラット、南木康作、袴田陽二、金井隆典、佐藤俊朗
- 掲載紙
- Nature(オンライン)
- DOI
- 10.1038/s41586-021-03247-2
用語解説
- (注1)オルガノイド
- 従来の細胞培養技術では、多くの細胞はシート状に培養されている。オルガノイドは細胞の増殖の足場となるジェルと増殖因子と呼ばれる細胞の増殖を促す分子を含む培養液により、立体的な細胞塊を形成するように育てられた培養細胞を指す。1つの幹細胞から生体内の組織に似た構造を培養皿の中で作り出すことが可能であり、胃、小腸、大腸、膵臓、肝臓などのさまざまな組織の正常およびがん幹細胞を無限に増やすことが可能である。本グループの先行研究では、新規の培養法により、生体組織に存在する多様な分化細胞のほとんどを再現したヒト腸管上皮オルガノイドの培養に成功し本研究でもこれを用いた。図5のようにシート状に培養することも可能である。
本発表資料のお問い合わせ先
研究全体について
慶應義塾大学医学部 坂口光洋記念講座(オルガノイド医学)
教授 佐藤俊朗(さとうとしろう)
助教 杉本真也(すぎもとしんや)
手術技術について
慶應義塾大学医学部 ブリヂストン臓器再生医学寄附講座
特任教授 小林英司(こばやしえいじ)
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課