2021-03-02 名古屋大学,名古屋市立大学,川崎市産業振興財団ナノ医療イノベーションセンター,がん研究会,日本医療研究開発機構
名古屋大学大学院医学系研究科・腫瘍生物学分野の近藤豊(こんどうゆたか)教授、田﨑慶彦(たさきよしひこ)大学院生(筆頭著者)らの研究グループは、名古屋市立大学、東京大学、ナノ医療イノベーションセンター、がん研究会との共同研究により、タンパク質に翻訳されないRNA(長鎖非翻訳RNA*1)のうちTUG1*2を標的とした治療薬が膵臓がんに対して有効である可能性を発見しました。
膵臓がんは、がんの中で最も予後不良ながんであり、また抗がん剤に対してがん細胞が耐性を獲得し、薬が効かなくなってしまうことが大きな問題となっています。本研究では、抗がん剤に対する耐性獲得メカニズムの解明と、膵臓がん細胞を狙って効果を発揮する治療薬の開発を試みました。まず膵臓がん細胞で高い発現を示す一方で正常な膵臓細胞では発現しない、長鎖非翻訳RNAのひとつTUG1に注目しました。TUG1は、膵臓がんの治療薬として用いられる抗がん剤5-Fluorouracil(5-FU)の分解を促進する働きを発揮し5-FUの効果を減弱することで耐性獲得に重要な役割を担うことを発見しました。がん細胞を狙って治療薬を効率的に送り届ける“運び屋”と、TUG1の機能を効率的に抑えることができる薬剤を組み合わせた核酸治療薬(TUG1-DDS)は、膵臓がん細胞を移植したマウスにおいて、膵臓がん細胞特異的に5-FUの効果を増強することを見出しました。現在TUG1-DDSは臨床応用に向けての開発を進めています。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)研究開発課題名「がん細胞の分化制御に関わるエピゲノムを標的とした革新的治療法の開発」の支援及びP-CREATE技術支援班のサポートのもとでおこなわれたもので、米科学誌「Cancer Research」(2021年3月1日付(米国東部時間))に掲載されます。
ポイント
- 膵臓がんは、がんの中で最も予後不良ながんとされています。膵臓がんに有効な抗がん剤は限られており、治療薬の開発が急がれています。
- 膵臓がん患者に対する抗がん剤を用いた薬物治療は、抗がん剤に対してがん細胞が耐性を獲得することや、抗がん剤が体の中の正常細胞にも毒性を示してしまうといったことが問題となっています。
- 本研究グループ膵臓がん細胞で高い発現を示す一方で正常な膵臓細胞では発現しない、長鎖非翻訳RNAのひとつTUG1に注目しました。TUG1は、膵臓がんの治療薬として用いられる抗がん剤5-Fluorouracil(5-FU)耐性獲得の重要な因子となっていることを発見しました。
- がん細胞に治療薬を効率的に送り届ける“運び屋”と、TUG1の機能を効率的に抑えることができる薬剤を組み合わせた核酸治療薬(TUG1-DDS)を作製しました。5-FUに耐性を示す膵臓がん細胞を移植したマウスにTUG1-DDSと5-FUを同時に投与すると、5-FUの効果を増強し膵臓がんの縮小を認めました。
- TUG1-DDSは膵臓がん細胞特異的に5-FUの効果を増強するため、5-FUの正常細胞への毒性を抑えつつ、膵臓がんにおいて有効な治療薬となる可能性があります。
背景
膵臓がんは、5年生存率が10%以下とがんの中で最も予後が悪い難治性のがんのひとつであり、有効な治療法の開発は喫緊の課題と考えられています。手術による腫瘍の切除は、膵臓がんの重要な治療方法ですが、診断がついた段階で手術できる患者さんは約20%に過ぎず、切除できても術後の再発率が高く、術後の5年生存率は20~40%と不良です。そのため、ほとんどの膵臓がん患者さんに対して5-FUやゲムシタビンなどの抗がん剤による薬物治療を行いますが、いまだに効果は限られています。現在使用されている抗がん剤には2つの課題があります。がん細胞が抗がん剤に対する耐性を獲得することにより効果を失ってしまうことと、抗がん剤が正常細胞に毒性を示してしまうことです。そこで本研究では、膵臓がん細胞が抗がん剤耐性を獲得するメカニズムを解明し、膵臓がん細胞のみで効果を発揮する治療薬を見つけることを目的としました。
研究成果
正常な膵臓細胞と膵臓がん細胞の遺伝子発現プロファイルを解析した結果、膵臓がん細胞でTUG1の発現が顕著に上昇していることがわかりました。長鎖非翻訳RNAはタンパク質に翻訳されないRNAの一種である小分子RNAと相互作用して、その小分子RNAの標的遺伝子の発現をコントロールします。そこで、TUG1と相互作用する可能性のある小分子RNAとその標的遺伝子を探索したところ、TUG1はmiR-376b-3p*3との相互作用を介して、ジヒドロピリミジン脱水素酵素(DPD)*4の発現を増加させていることがわかりました。DPDは5-FUを分解し、抗がん剤としての効果を減弱させる酵素として知られていますが、TUG1はDPDの発現上昇を介して、膵臓がん細胞の5-FUの耐性獲得に寄与することを証明しました(図1)。
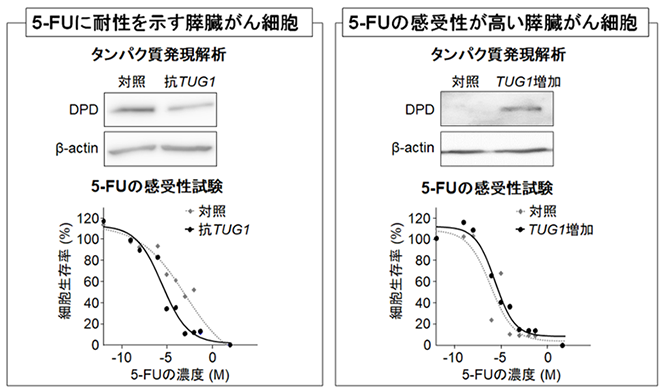
図1 抗TUG1の5-FUに対する作用増強効果
次に本研究グループはTUG1の作用を抑制する薬剤の作製を試みました。薬剤をがん細胞のみに到達させるための“運び屋”をTUG1を抑制する核酸医薬と組み合わせた治療薬(TUG1-DDS)*5をナノ医療イノベーションセンター、東京大学との共同研究で作製しました。このTUG1-DDSを用いることにより、TUG1の作用を抑制する薬剤を膵臓がん細胞のみに送達することができました(図2)。
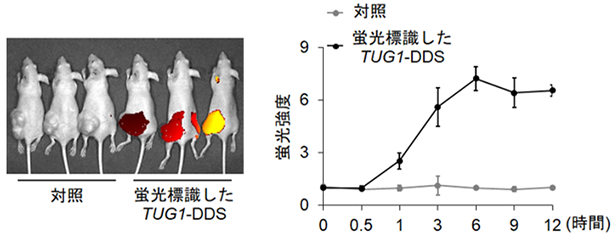
図2 TUG1-DDSの腫瘍への集積
5-FUに耐性を示す膵臓がん細胞を移植したマウスにTUG1-DDSと5-FUを投与し、治療効果を確認した結果、5-FUを単独で投与したマウス(図3、青線)と比較して、TUG1-DDSと5-FUを同時に投与すると、5-FUの薬効が保たれ顕著に腫瘍増殖が抑制しました(図3、赤線)。
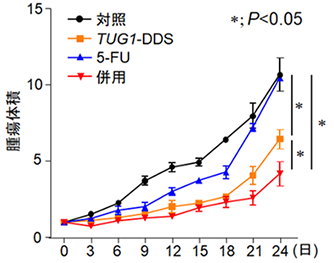 図3 TUG1-DDSの治療効果
図3 TUG1-DDSの治療効果
本研究からTUG1は膵臓がん細胞においてmiR-376b-3pとの相互作用を介してDPDの発現を上昇させることにより、5-FUの耐性を獲得する能力をもたらすことを世界で初めて明らかにしました。TUG1-DDSは膵臓がん細胞のみに送達され効率的に5-FUの効果を増強するため、5-FUの投与量が少なくて済むことにより正常細胞への毒性を抑えつつ、難治性のがんである膵臓がんにおいて有効な治療薬となる可能性を見出すことができました(図4)。
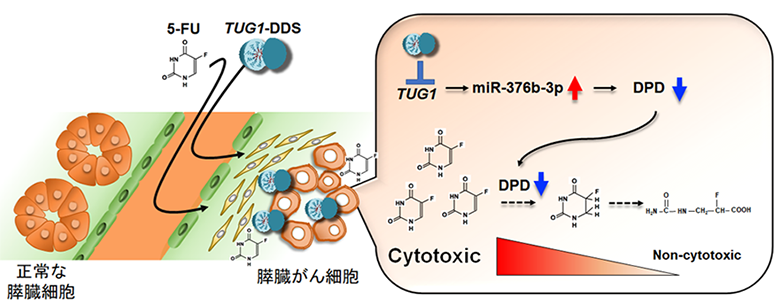
図4 難治性の膵臓がんに対するTUG1-DDSを用いた新規治療法
今後の展開
現在TUG1-DDSは臨床応用に向けての開発を進めています。膵臓がんに対してTUG1-DDSの使用が可能になることを目標とし、TUG1-DDSについて副作用等を含めた解析を進め、安全性について検討していく予定です。
用語説明
- *1 長鎖非翻訳RNA
- 細胞を構成するタンパク質は、RNAを翻訳することで作り出されます。しかしRNAの中にはタンパク質に翻訳されない“非翻訳RNA”が存在し、こうした非翻訳RNAは様々な機能を持つ可能性が明らかになっています。非翻訳RNAの中で全長が200塩基以上のものを長鎖非翻訳RNAといい、がんの発生・悪性化や抗がん剤の耐性に関与していることがわかっています。
- *2 TUG1(Taurine Upregulated Gene 1)
- 長鎖非翻訳RNAのひとつ。多くの膵臓がんで発現が上昇しており、がんの発生・悪性化や抗がん剤の耐性に関与していることがわかっています。
- *3 miR-376b-3p
- マイクロRNA(miRNA)のひとつ。miRNAはメッセンジャーRNAと相互作用することによりタンパク質の発現を変化させます。miR-376b-3pはジヒドロピリミジン脱水素酵素(DPD)のタンパク質発現を低下させます。
- *4 ジヒドロピリミジン脱水素酵素(DPD)
- 酸化還元酵素の一つで、5-FUなどのフッ化ピリミジン系薬剤は体内で主にDPDにより分解・代謝されます。
- *5 TUG1-DDS(がん指向性高分子ミセル型ナノ医薬品)
- TUG1を抑制するアンチセンス核酸を内包した高分子ミセル型ナノ医薬品。本研究で用いられた高分子ミセルは、膵臓がんを狙い打ちするために「がん細胞あるいは腫瘍血管内皮細胞の表面に特異的に結合するペプチド」で修飾されています。
発表雑誌
- 雑誌名
- Cancer Research(2021年3月1日午前10時00分 米国東部時間)
- 論文タイトル
- Cancer-specific targeting of taurine upregulated gene 1 enhances the effects of chemotherapy in pancreatic cancer
- 著者
- Yoshihiko Tasaki1,2, Miho Suzuki1, Keisuke Katsushima1, Keiko Shinjo1, Kenta Iijima1, Yoshiteru Murofushi1, Aya Naiki-Ito3, Kazuki Hayashi4, Chenjie Qiu5, Akiko Takahashi6,7, Yoko Tanaka6, Tokuichi Kawaguchi8, Minoru Sugawara8, Tomoya Kataoka2, Mitsuru Naito9, Kanjiro Miyata10, Kazunori Kataoka11,12, Tetsuo Noda13, Wentao Gao5, Hiromi Kataoka4, Satoru Takahashi3, Kazunori Kimura2 and Yutaka Kondo1
- 所属
-
- Division of Cancer Biology, Nagoya University Graduate School of Medicine, 65 Tsurumai-cho, Showa-ku, Nagoya, Aichi, 466-8550, Japan.
- Department of Clinical Pharmaceutics, Nagoya City University Graduate School of Medical Sciences, 1 Kawasumi, Mizuho-cho, Mizuho-ku, Nagoya, Aichi, 467-8601, Japan.
- Department of Experimental Pathology and Tumor Biology, Nagoya City University Graduate School of Medical Sciences, 1 Kawasumi, Mizuho-cho, Mizuho-ku, Nagoya, Aichi, 467-8601, Japan.
- Department of Gastroenterology and Metabolism, Nagoya City University Graduate School of Medical Sciences, 1 Kawasumi, Mizuho-cho, Mizuho-ku, Nagoya, Aichi, 467-8601, Japan.
- Pancreas Center, The First Affiliated Hospital with Nanjing Medical University, Nanjing, 210029, People’s Republic of China.
- Project for Cellular Senescence, Cancer Institute, Japanese Foundation for Cancer Research, 3-8-31 Ariake, Koto-ku, Tokyo, 135-8550, Japan.
- PRESTO, Japan Science and Technology Agency, 4-1-8 Honcho, Kawaguchi, Saitama, 332-0012, Japan.
- Cancer Precision Medicine Center, Japanese Foundation for Cancer Research, 3-8-31 Ariake, Koto-ku, Tokyo, 135-8550, Japan.
- Center for Disease Biology and Integrative Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Department of Materials Engineering, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Innovation Center of NanoMedicine, Kawasaki Institute of Industrial Promotion, 3-25-14 Tonomachi, Kawasaki-ku, Kawasaki 210-0821, Japan.
- Institute for Future Initiatives, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-0033, Japan.
- Director’s Room, Cancer Institute, Japanese Foundation for Cancer Research, 3-8-31 Ariake, Koto-ku, Tokyo, 135-8550, Japan.
- DOI
- 10.1158/0008-5472.CAN-20-3021
お問い合わせ先
名古屋大学大学院医学系研究科 腫瘍生物学
教授 近藤豊
広報担当
名古屋大学医学部・医学系研究科総務課総務係
名古屋市立大学医学・病院管理部経営課経営係
川崎市産業振興財団ナノ医療イノベーションセンター
がん研究会広報課
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部医薬品研究開発課