2021-04-08 理化学研究所
理化学研究所(理研)生命医科学研究センター遺伝子制御回路研究チームのジョアキム・ルーギンブエル研究員(研究当時)、ジェイ・シンチームリーダーらの研究グループは、ヒト線維芽細胞[1]に複数の転写因子[2]を導入しさまざまなタイプの神経細胞に変換する過程において、どの転写因子が細胞変換を決定するのかを一細胞解析[3]から導き出す手法を開発しました。
本研究成果は、再生医療やiPS細胞[4]の品質向上に貢献できると期待できます。
近年、細胞に外から転写因子を導入し、発現する遺伝子を調整することで、目的の細胞へ直接変換できることが分かってきました。しかし、どの転写因子をどれだけ入れれば効率良く目的細胞へ変換できるかを調べる方法はありませんでした。
今回、研究グループは一細胞解析技術を応用し、目的細胞へと変換させるのに必要な転写因子の種類と量を決定する手法を開発しました。実際に本手法を用いて、ヒト線維芽細胞を多様な神経細胞へ変換させるために複数の転写因子を導入し、各神経細胞へと変換させる際に必要な転写因子を同定することに成功しました。
本研究は、科学雑誌『Stem Cell reports』(4月13日号)の掲載に先立ち、オンライン版(3月11日付:日本時間3月12日)に掲載されました。
背景
私たちの体はさまざまな種類の細胞で構成されています。これらの細胞をさかのぼると、全て受精卵という一つの細胞にたどり着きます。受精卵から細胞分裂を繰り返し、胚期へと移行し、その後どのような細胞になるのかが決定されます。これを細胞の運命決定といい、いったん細胞の運命が決まってしまうと、他の細胞種へと変換することは難しく、受精卵の状態に戻す必要があると考えられていました。
しかし近年、iPS細胞に代表されるように、分化して体の組織や臓器になった細胞(体細胞)をいったん初期化し、未分化な状態(幹細胞)に戻してから目的の細胞へ分化させ、疾患部位に移植するといった再生医療の研究が盛んに行われています。この体細胞を幹細胞に戻したり、幹細胞を経ずともある細胞種を他の細胞種へ変換したりするには、膨大なデータから特定のRNAの発現をつかさどる「転写因子」というタンパク質を探し出し、運び屋となるウイルスベクターなどを用いて外来転写因子として細胞の中に取り込ませる必要があります。
しかし、この特定の転写因子を同定するには複雑でコストのかかる実験設定が必要であり、候補の転写因子が得られたとしてもそれを検証するためにさらなる時間と労力を要します。
また、外来転写因子は全ての細胞に均等に導入されるわけではないため、細胞ごとに細胞変換の効率に差が生じてしまいます。これに対して、一細胞を用いたRNAシーケンシング[5]におけるマルチプレックス解析[6]では、不均一な細胞の条件下であっても、一度の実験で多数の一細胞の状態を遺伝子発現から定義することが可能です。同時に、どの外来転写因子が導入されるかを検出することで、細胞変換効率を調べることもできます。
研究手法と成果
神経細胞は機能によって、光などに反応する感覚神経細胞、筋肉に出力する運動神経細胞、感覚神経細胞から運動神経細胞へ刺激を伝達する介在神経細胞に分けられ、これら三つの神経細胞にはさらにさまざまな種類が存在します。今回、研究グループは介在神経細胞を対象に研究を行いました。
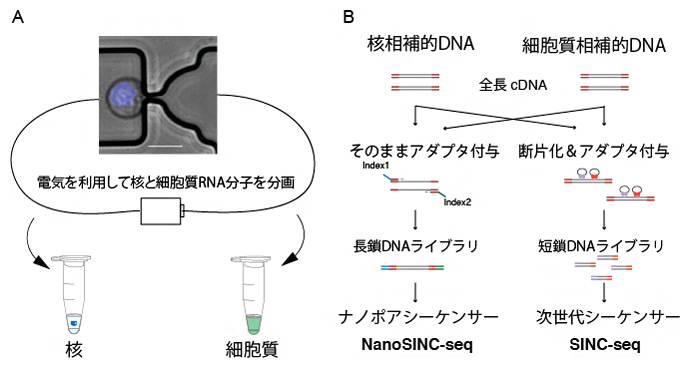
まず、既に報告されているヒト繊維芽細胞から5種類の神経細胞への分化を可能とする外来転写因子と、データーベースから神経細胞への分化中に発現が亢進している内在性の転写因子を合わせて20個の転写因子を選び出しました。それらを多重化したものを外来転写因子としてヒト線維芽細胞に導入し、さまざまな神経細胞へと分化させました。その分化過程で、一細胞完全長RNAシーケンシング[5]と独自に開発したKallisto[7]を用いたデータ解析手法を組み合わせることで、一細胞の細胞状態と同時に外来転写因子がどのくらい導入されているかを定量する方法を開発しました(図1)。
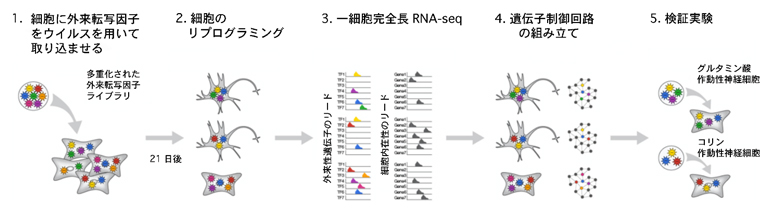
図1 本研究で開発した一細胞解析から外来転写因子を定量する手法
ヒト線維芽細胞に多重化した外来転写因子を導入し、細胞を神経細胞へと分化させる。分化したのち一細胞完全長RNA-seqにて複数の一細胞の網羅的な発現解析を行う。コンピュータ解析から、どの因子が各神経細胞への分化にどれだけ必要なのかを探る。その結果を検証実験にて確認した。
そして、この手法が外来転写因子を正確に検出・定量できたのか検証実験を行いました。まず、導入した外来転写因子によってどのような神経細胞へ分化されたのかを確認するために、細胞集団を用いた実験と数千個の一細胞のトランスクリプトーム解析[8]により、既報の低分子化合物を用いて分化させる手法と比較したところ、開発した手法がより多様な神経細胞を誘導していることが分かりました。この結果と公開されているヒト脳の一細胞トランスクリプトームデータを参照し、転写因子の導入により誘導されるそれぞれの神経細胞の種類をマーカー遺伝子[9]から推測、決定をしました(図2)。
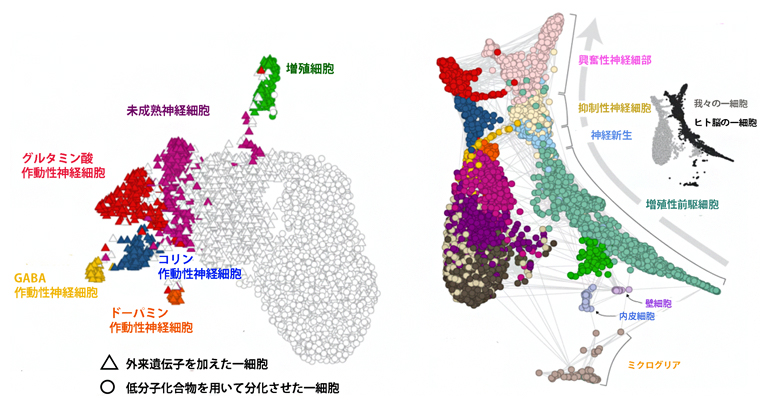
図2 一細胞解析から見たヒト繊維芽細胞に外来転写因子導入後に誘導される神経細胞集団
左)一細胞の遺伝子発現から次元圧縮を行い、形成される細胞集団を見た。三角は今回用いた転写因子を導入し分化させた細胞、○は低分子化合物を用いて分化させた細胞を示す。
右)ヒト脳の一細胞データを参照し、本研究で変換させた細胞と神経の発生の軌跡を関連づけた。今回人工的に変換・分化させた神経細胞(右側)が、脳内における神経細胞の発達(左側)と類似していることを示す。
次に、実際に開発した手法を評価するために、ヒト線維芽細胞に外来転写因子を導入後、9日目と21日目における一細胞解析から細胞状態の変化を調べました。実際の時間軸の情報と組み合わせ、擬似時間解析[10]を行った結果、細胞状態変化の後期において細胞の分化過程を大きくブランチ1と2の二つに枝分けすることができ、ブランチ2には神経発生に伴う遺伝子が点在していることが分かりました(図3)。これにより、一細胞の遺伝子発現から外来転写因子を導入後、神経細胞へと分化する過程を捉えることに成功しました。
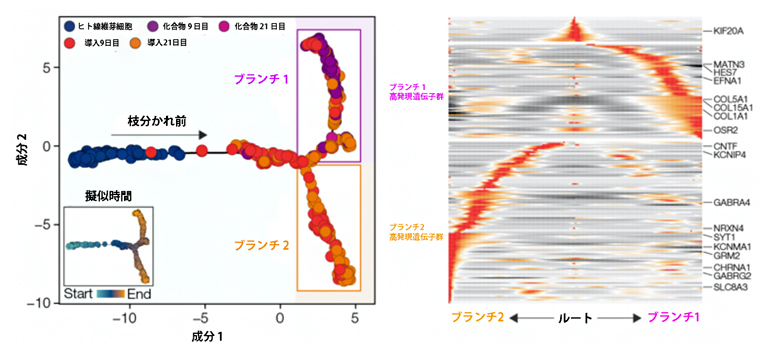
図3 二つに枝分かれした細胞の分化過程
左)外来転写因子を導入した後、ヒト線維芽細胞から神経細胞へと分化する細胞を擬似的時系列で並べた。分化の後期で、二つに枝分かれしたことが分かる。また、既報の低分子化合物を用いて分化させる手法よりも、開発した手法の方が多様な神経細胞を誘導したことも分かる。
右)擬似的時間解析により得られたブランチ特異的に活性化している遺伝子を示した。中央(ルート)は、ブランチに分かれる前の状態を示す。ブランチ1には血管系の発生に関する遺伝子が高発現しているのに対し、ブランチ2では神経発生に伴う遺伝子が高発現している。
このブランチ2の一細胞群から検出された外来転写因子の種類は10個ほどでした。そのうちの10個と最初の候補20個をそれぞれヒト繊維芽細胞に導入し比較したところ、10個導入した細胞の方により強く神経細胞のマーカー遺伝子の発現と神経細胞特有の形態学的特徴が見られました。これにより、細胞変換に必要な転写因子は10個で十分であることが分かりました。
さらに、誘導される神経細胞の中でも、神経伝達物質[11]のグルタミン酸を放出するグルタミン酸作動性神経細胞とアセチルコリンを放出するコリン作動性神経細胞に誘導するための外来転写因子をそれぞれ四つずつ選び出し、誘導しました。その後、電気生理学的解析[12]を用いて、これらの神経細胞が遺伝子発現しているだけでなく、実際に神経伝達物質を放出する機能を持つことを確認しました(図4)。
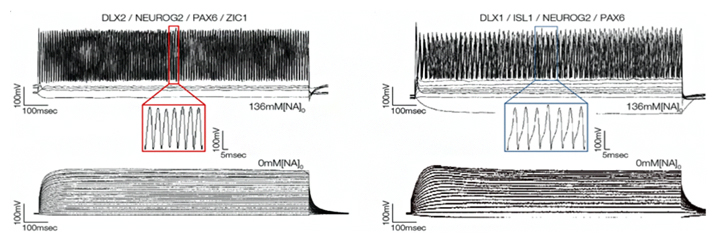
図4 活動電位の測定結果
左)上は、四つの外来転写因子(DLX2/NEUROG2/PAX6/ZIC1)を加え、グルタミン酸作動性神経細胞に変化させた細胞の活動電位。下はコントロール。
右)上は、四つの外来転写因子(DLX1/ISL1/NEUROG2/PAX6)を加え、コリン作動性神経細胞に変化させた細胞の活動電位。下はコントロール。
今後の期待
本研究で開発した技術は、外来転写因子の取り込み情報とともに一細胞の遺伝子発現を完全長で捉える新しい手法です。これにより、どの転写因子をどの程度細胞に入れればどの細胞に変換されるのかを定義できます。
また、遺伝子制御回路研究チームが大きく貢献しているヒトアトラス計画[13]の中で、本手法がヒトの臓器における細胞の不均一性、多様性を理解するのに役立つものと期待できます。ヒトアトラス計画で得られたデータを参照することで、将来、細胞変換した細胞をヒトの体に移植する細胞治療用に「細胞を設計」することも可能になります。
補足説明
1.線維芽細胞
皮膚の真皮に存在し、結合組織を構成する細胞の一つ。
2.転写因子
DNAに直接もしくは間接的に結合し、細胞核の中で行われる転写(RNAの発現)をつかさどるタンパク質のこと。
3.一細胞解析
平均化された細胞集団ではなく、個々の細胞を一つずつ解析すること。一細胞解析により、一細胞間での不均一性などを捉えることができる。
4.iPS細胞
皮膚や血液などから採取した細胞に、少数の遺伝子などを導入して作製された多能性幹細胞。iPSはinduced Pluripotent Stemの略。
5.RNAシーケンシング、一細胞完全長RNAシーケンシング
RNAシーケンシングは、次世代シークエンサーを利用してDNAから転写されるRNAの量を網羅的に定量する手法の総称。一細胞完全長RNAシーケンシングとは、一細胞において転写されているRNAの全長を読む方法。
6.マルチプレックス解析
1回のアッセイで複数の分析対象を試験する技術。ここでは、一細胞の発現情報を一度の次世代シークエンス解析で数百から数千程度得ることを指す。
7.Kallisto
次世代シークエンサーにより得られたデータから、マッピングをせずに遺伝子発現定量を高速で行うためのプログラム。
8.トランスクリプトーム解析
トランスクリプトームとは、一つのゲノム、または特定の細胞・組織・器官の中で生産される転写産物(転写によって合成されたRNA)全体を指す。トランスクリプトーム解析は、特定の遺伝子発現に着目するのではなく、全ての発現遺伝子に関して網羅的に解析する手法。マイクロアレイや、次世代シークエンサーを用いたRNAシークエンスなどの方法がある。
9.マーカー遺伝子
細胞集団を定義づけるための遺伝子。ここでは、細胞タイプ特異的に高く発現している遺伝子のことを指す。
10.擬似時間解析
遺伝子発現のパターンから擬似的な時間軸を推定し、細胞の状態で並べていく解析手法。発生の過程などには有効な手段である。
11.神経伝達物質
シナプス(神経細胞間などに形成される神経活動に関わる接合部位)で情報伝達を介在する物質。グルタミン酸やアセチルコリンは代表的な神経伝達物質。
12.電気生理学的解析
細胞の電気的性質と生理機能との関係を解明する実験手法。
13.ヒトアトラス計画
ヒトの体内に存在する約37兆個の細胞を1細胞単位で解析して分類・カタログ化し、細胞の標準となるアトラス(地図)データを集める計画。疾患治療、再生医療の分野への貢献が期待されている。
研究グループ
理化学研究所
生命医科学研究センター
遺伝子制御回路研究チーム
研究員(研究当時) ジョアキム・ルーギンブエル(Joachim Luginbuhl)
(現同チーム客員研究員)
リサーチアソシエイト 河野 掌(こうの つかさ)
特別研究員(研究当時) ディビヤ・シバラマン(Divya Sivaraman)
国際プログラム・アソシエイト(研究当時) フィリップ・ロドニッキー(Fillip Roudnicky)
チームリーダー ジェイ・シン(Jay Shin)
細胞機能変換技術研究チーム
基礎科学特別研究員 中野 令(なかの れい)
テクニカルスタッフⅠ 木嶋 真美(きしま まみ)
一細胞解析技術研究チーム
チームリーダー(研究当時) チャールズ・プレシ(Charles Plessy)
副センター長 ピエロ・カルニンチ(Piero CarnincI)
脳神経科学研究センター
シナプス可塑性回路制御研究チーム
研究員 トーマス・チェイター(Thomas Chater)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金特別研究員奨励費「リプログラミングの論理的制御による神経細胞の作製」の支援を受けて行われました。
原論文情報
Joachim Luginbühl, Tsukasa Kouno, Rei Nakano, Thomas E.Chater, Divya M.Sivaraman, Mami Kishima, Filip Roudnicky, Charles Plessy, and Jay W. Shin, “Decoding Neuronal Diversification by Multiplexed Single-cell RNA-Seq”, Stem Cell Reports, 10.1016/j.stemcr.2021.02.006
発表者
理化学研究所
生命医科学研究センター 遺伝子制御回路研究チーム
理化学研究所 生命医科学研究センター 遺伝子制御回路研究チーム
研究員(研究当時) ジョアキム・ルーギンブエル(Joachim Luginbühl)
(現 同チーム 客員研究員)
チームリーダー ジェイ・シン(Jay Shin))
報道担当
理化学研究所 広報室 報道担当