2021-04-08 理化学研究所
理化学研究所(理研)生命機能科学研究センター器官誘導研究チームの辻孝チームリーダー、武尾真上級研究員らの研究チームは、肝臓[1]の損傷によって生じる機械的な刺激(血流速度の変化)が肝臓再生の開始と停止に関与することを明らかにしました。
本研究成果は、肝臓をはじめとする器官発生や再生などの基礎的研究に貢献するとともに、将来の人工的な三次元立体器官の実現に向け、機械的恒常性[2]を利用した器官再生や育成を制御する技術開発への応用が期待できます。
器官形成と再生は発生過程において重要であり、形態形成、器官サイズや機能の制御は全身の恒常性の発現に深く関与しています。肝臓は高い再生能力を備え、3分の2を切除しても元の大きさに戻ることができます。しかし、肝臓がどのように再生を開始し、適切なサイズで再生を停止するかのメカニズムには、不明な点がまだ多く残されていました。
今回、研究チームは、肝臓の機能単位である肝小葉[1]内の類洞(るいどう)[1]と呼ばれる毛細血管系の空間的配置を三次元的なネットワークとして分析し、その特徴的なパラメータの変動を肝臓の静止期と肝部分切除後の再生期で比較しました。その結果、類洞の細胞が切除後の血流速度の変動を機械的刺激として感知し、サイトカインネットワーク[3]と協調することで、肝臓再生の開始と停止の両方に不可欠な役割を果たすことが明らかになりました。
本研究は、オンライン科学雑誌『Communications Biology』(4月7日付)に掲載されました。
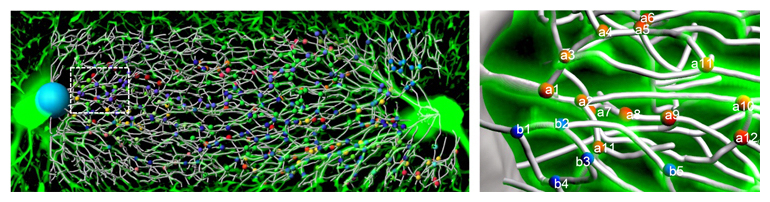
肝臓、肝小葉内部の毛細血管(類洞)の空間的配置
(左図は肝小葉の門脈から中心静脈までの類洞の構造、右図は類洞を拡大し、血管を白のワイヤーで、分岐部に球を配置した)
背景
肝臓は、機能的な単位である「肝小葉」の三次元空間配置を介して、物質の貯蔵や代謝、解毒、胆汁の生成などを行い、全身の恒常性を維持する上で重要な役割を果たしています(図1a)。その機能発現には、全形が不可欠というわけではなく、肝小葉の形態と肝臓全体の重量、体積が肝機能に重要であると考えられています(図1b, c)。
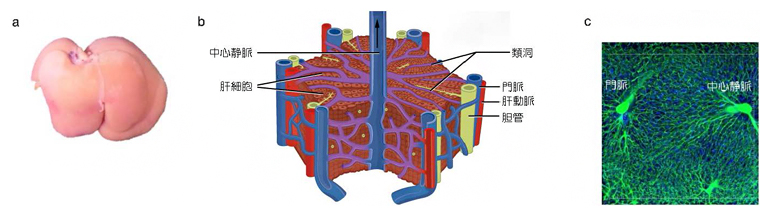
図1 肝臓と肝小葉の構造、類洞の配置
aはラット肝臓の外観写真。bは肝小葉の構造(『Anatomy and Physiology』を改変注1))を示す。六角柱の構造をしており、直径と高さはそれぞれ1~2mmほどである。cは肝小葉内部の血管の蛍光イメージ像。
肝臓は、哺乳類の内臓としては例外的に高い再生能力があり、ヒトでは3分の2を切除しても2週間ほどで元の大きさに戻ります。損傷を受けた肝臓は構成細胞が膨張(肥大)および増殖(過形成)し、器官の体積が増加・回復する(代償性肥大)ことが知られています。
これまでの研究から、肝臓の再生は、内皮細胞や骨髄細胞などの複数の種類の細胞が関与する複雑なプロセスであり、肝細胞増殖因子(HGF)[4]や、上皮成長因子(EGF)[4]、腫瘍増殖因子(TGF-β1)[4]などのサイトカインネットワークによって厳密に調節されていることが分かっています。一方、肝蔵の再生中には、血液の流動が大きく変化することが知られています。しかし、この血流変化が再生にどのように影響するのか、また再生の開始と停止がどのように制御されているのかは、ほとんど分かっていません。
細胞は、細胞骨格や膜の変化などの細胞形状の形態変化を介して、周囲の環境からの摩擦力(せん断応力、ずり応力)や張力・牽引力などの機械的刺激を感知し、応答します。このような生体応答は「機械的恒常性」と呼ばれ、器官および組織の発達にも重要な役割を果たしています。血管構造では、せん断応力や血管内皮細胞表面の牽引力など、血流によって生じるさまざまな機械的刺激が、血管の形態的・物理的特性に関わります。そのため、肝臓の血管の機械的センサーは再生の開始および停止シグナルとして働くと考えられてきました。
そこで研究チームは、肝蔵の再生過程において、肝小葉内の毛細血管系における機械的恒常性の変化を解析するとともに、この機械的恒常性が再生の開始と停止にどのように関与するかについて調べました。
注1)Access for free at Introduction Anatomy and Physiology | openstax
J. Gordon Betts, Kelly A. Young, James A. Wise, Eddie Johnson, Brandon Poe, Dean H. Kruse, Oksana Korol, Jody E. Johnson, Mark Womble, Peter DeSaix, Anatomy and Physiology, Apr 25, 2013, OpenStax, Houston, Texas
23.6 Accessory Organs in Digestion: The Liver, Pancreas, and Gallbladder
研究手法と成果
1)肝小葉の類洞の空間的配置の解析
肝臓は、左葉、左正中葉、右正中葉、右葉、尾状葉の五つの葉に分けられます(図2a)。これらの葉は、主に肝細胞と血管で構成されています。各肝小葉では、血液は門脈から「類洞(るいどう)」と呼ばれる毛細血管を通って中心静脈に流れます(図2b)。肝機能は肝小葉と類洞に依存しているため、肝小葉の血管構造を蛍光色素注入により可視化し、肝小葉の血管を線形の画像として描写し、各類洞の位置関係や分岐の順序と角度を解析しました。その結果、類洞の分岐角度の中央値は75.75°であることが分かりました(図2c)。類洞の直径も、分岐回数に関係なく、約3マイクロメートル(μm、1μmは1000分の1mm)の一定値を示しました(図2d)。さらに、類洞血管網は水平の層を形成して分布しており、これらの層状構造をつなぐ類洞が一定の割合で存在していることが判明しました(図2e)。
これらの結果は、類洞血管網が分岐角度や直径など、安定した構造パラメータを持っていることを示しており、固有の血管ネットワーク構造が個々の器官に存在し、定常状態に維持されていることが示唆されました。
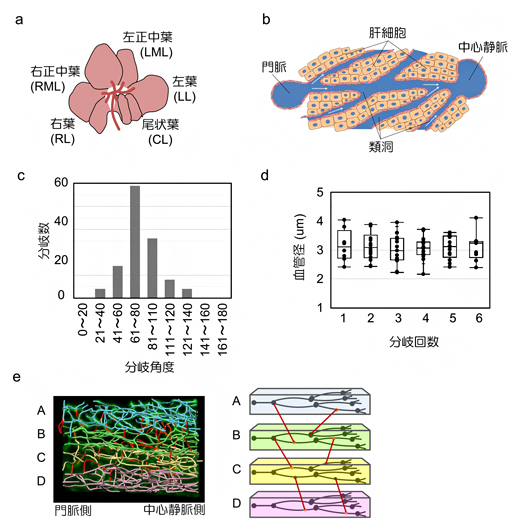
図2 肝小葉の類洞の空間的配置の解析
a)肝臓の構造。五つの葉から構成される。
b)肝小葉内部の血管配置と血流の方向。門脈から入った血液は類洞で混じり合い、中心静脈に流れる。
c)肝小葉の類洞分岐部の分岐角度。中央値は75.75°だった。
d)肝小葉の類洞の直径は、分岐回数にかかわらず約3μmだった。
e)類洞の空間的配置。A~Dのように、類洞血管網は水平の層を形成して分布し、これらの層状構造をつなぐ類洞(赤線)が一定の割合で存在することが分かった。
2)肝蔵の再生における類洞構造の動的変化
肝臓が再生の必要性をどのように感知するかを明らかにするために、部分切除された残存肝臓の類洞の三次元的なパラメータを解析しました。すると、肝臓は切除してから1週間後までに元と同じ重量に再生しましたが、小葉構造は回復しませんでした(図3a, b)。また再生過程では、肝細胞内部の脂肪滴の蓄積が切除後24時間でピークに達し、類洞構造は切除後120時間までに実質的に定常状態に戻りました(図3c)。この過程で、類洞の分岐角度は約74°の安定した値を示したものの、血管の体積と表面積の増加がともに切除後24時間でピークに達し、再生が進むにつれて元のレベルに戻ることが明らかになりました(図3d)。類洞周囲の肝細胞は、切除後に核密度が急速に減少し、細胞の肥大が見られました。
一方、類洞の血流速度は切除後12時間で3倍に増加し、肝臓が再生するにつれて徐々に低下することが分かりました。従って、血流量の変化は類洞構造の変化前に発生することから、血行動態の変化は血管構造の変化とそれに続く肝臓の再生を引き起こし、血行動態は肝臓が定常状態に戻るまで続くことが示唆されました。
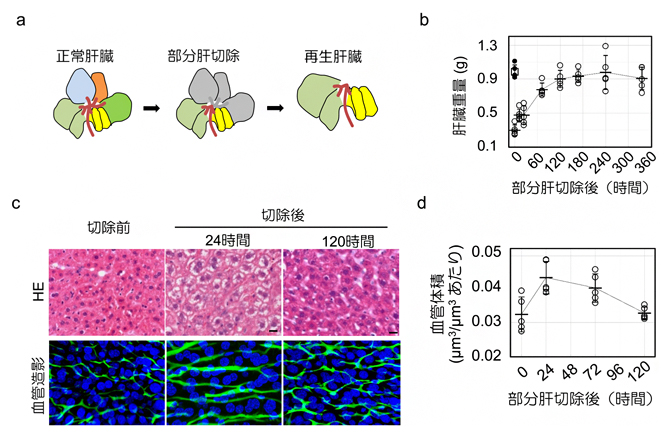
図3 肝部分切除による肝臓の再生時における類洞の動的変化
a)肝臓の葉構造と部分切除(灰色)、再生後の肝臓のイメージ。
b)肝臓の部分切除後の重量の回復。切除から1週間(168時間)後までに元の肝臓と同じ重量に再生した。
b)肝再生過程における肝細胞と類洞構造の変化。HEは組織学的な染色像。血管造影は、血管(緑)と細胞核(青)を蛍光色素で染色した像。肝細胞内部の脂肪滴の蓄積が切除後24時間でピークに達し、類洞構造は切除から120時間後までに実質的に定常状態に戻った。
b)部分肝切除後の類洞の体積変化。類洞の体積は切除後24時間でピークに達し、肝臓の再生が進むにつれて元のレベルに戻った。
3)肝臓への流入血流量の低下は肝再生を遅らせる
次に、肝臓門脈[1]の血流速度の増加と肝再生との因果関係を調べました。ラットの門脈を結紮(けっさく)し、門脈の血流の約70%を下大静脈にバイパスさせたところ、切除後の急激な血流速度の上昇は見られず、肝細胞の増殖が抑制され再生が有意に遅れることが判明しました(図4)。
また、肝細胞増殖の阻害因子として知られるTGFβ1の血清中濃度は、通常の切除群では切除後12時間まで低濃度を維持するのに対して、バイパス切除群ではTGFβ1濃度の有意な低下は観察されませんでした。これらの結果から、肝臓の血流速度の増加がTGFβ1産生の抑制と肝細胞増殖に不可欠であり、肝臓の再生をもたらすことが示されました。
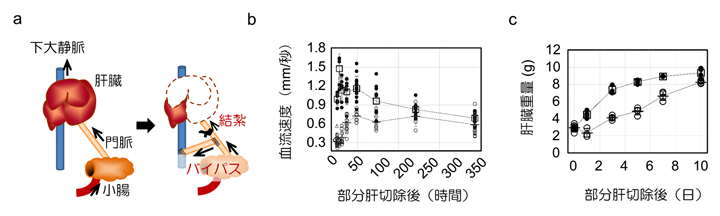
図4 肝臓への流入血流量と肝臓の再生速度
a)肝臓を部分肝切除した後、門脈を結紮、バイパスして肝臓への流入を制御するモデル。
b)部分肝切除後に肝臓への流入血液流量を制御すると、血流速度は低下した。
c)肝臓への流入速度を低下させると、肝臓の再生が遅れた。
4)血管内皮細胞がせん断応力を感知する
次に、血管内皮細胞が肝臓再生の開始にどのように関与しているかを解析しました。この解析のため、スライド上に培養した類洞の内皮細胞に培養液を流し、せん断応力の強さを制御する灌流培養システムを開発しました(図5a)。
臍帯静脈の内皮細胞は、血液の流れを感知するとカルシウムイオンが細胞膜の陽イオンチャネルを介して流出し、細胞内カルシウムイオン濃度が低下します。類洞内皮細胞でも、せん断応力を加えると細胞内カルシウムイオン濃度の低下が観察されました(図5b)。この応答は、機械的刺激の感知に関わる膜タンパク質GPCR[5]の阻害剤を添加することで、中和されることが分かりました。さらに、培養液によるせん断応力は、TGFβ1の産生を劇的に減少させることが判明しました。また、内皮細胞の増殖を誘導するシグナルタンパク質MAPK[6]のリン酸化状態を解析したところ、せん断応力を加えた直後、MAPKのリン酸化レベルは徐々に増加し、GPCR阻害剤によって抑制されることが分かりました。
これらの結果は、類洞内皮細胞がせん断応力を感知する能力を持ち、それがGPCR-MAPKのサイトカインカスケード[3]を介して、TGFβ1の産生低下を誘導することを示しています。
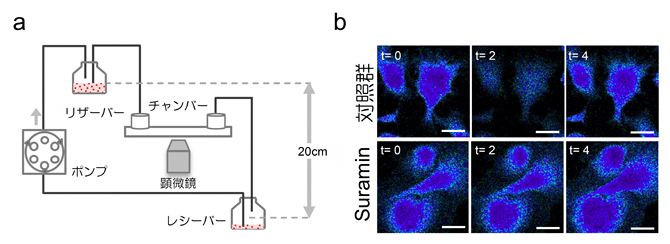
図5 血管内皮細胞へのせん断応力の負荷モデルと内皮細胞の生理反応
a)類洞内皮細胞をチャンバーに付着させ、培養液の流速により細胞にせん断応力をかける灌流培養システム。
b)類洞内皮細胞にせん断応力をかけると、速やかに細胞内カルシウムイオン濃度が低下する。この濃度の低下は、GPCRsの阻害剤(Suramin)により抑制された。時間経過(t)は応力負荷後の秒数を示す。スケールバーは全て10μm(1μmは1000分の1mm)。
5)速やかな肝再生は門脈血流速の上昇により誘導される
1)~4)の解析により、血流の変化が再生肝臓のサイズの制御に関与している可能性が示されました。そこで次に、若いラットから分離した小さな肝臓を高齢の大きなラットに同所移植する同所性小肝移植モデルを開発しました(図6a)。肝臓の門脈における血流量はラットの大きさに相関しており(図6b)、移植された小さな肝臓は、肝部分切除モデルと同様に血流量が増加され再生すると考えられます。
実際に移植を行ったところ、肝部分切除の後に見られるような移植肝臓の腫れが観察され、移植後の時間に伴い、肝臓重量は増加しました(図6c, d)。また、移植してから24時間後までに類洞の血管の表面積と体積が大幅に増加し、類洞周辺の細胞数も移植後48時間で劇的に減少しました。さらに、類洞内皮細胞でのTGFβ1の発現も著しく減少しました。
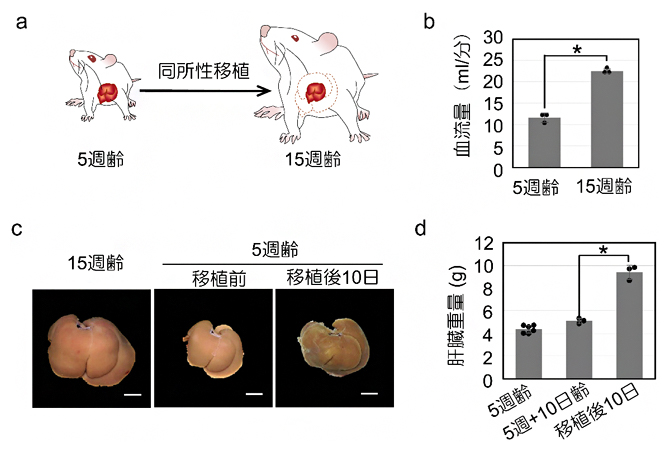
図6 小型ラット肝臓の大型ラットへの同所的肝臓移植モデルとその反応
a)小型ラット(5週齢)の肝臓を摘出し、大型ラット(15週齢)の肝臓の部位へ同所的に移植するモデルのイメージ図。
b)小型ラットと大型ラットの肝臓血流量の差。血流量はラットの大きさに相関していた。
c)大型ラットの肝臓と小型ラットの肝臓。大型ラットへの移植10日目には小型ラット由来の肝臓は肥大化した。スケールバーは1cm。
c)5週齢のラット肝臓は小型であったものの、移植10日目には肝臓は肥大化した。
これらの結果は、血流量の増加が類洞構造の変化、TGFβ1産生の抑制制御、およびその後の肝臓再生をもたらすことを示しています(図7)。すなわち、類洞血流量の変化が、肝臓の成長と再生の開始と停止を引き起こすことが明示されました。
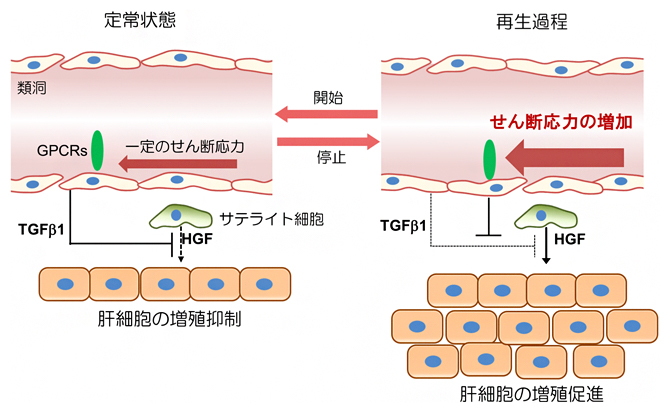
図7 血管内皮細胞へのせん断応力が肝再生の開始と停止を制御するモデル
定常状態では、類洞内を流れる血流速は一定であり、TGF-β1の産生を介して、肝細胞増殖因子(HGF)による肝細胞の増殖を抑制している(図左)。部分肝切除や同所性小肝移植などで類洞内血流量の上昇が起こると、せん断応力は上昇し、内皮細胞に存在するスラミン反応性のGPCRsが活性化してTGF-β1の産生を抑制し、肝細胞の増殖が開始する(図右)。肝臓が一定の大きさに達すると、血流速度は一定状態に戻るため、定常状態へと戻り、肝臓の増殖は低下する。
今後の期待
本研究により、肝臓は肝障害などにより減少した自らの体積を血流速度により感知し、肝細胞の増殖を制御する生理活性物質の発現量を制御することで、再生を誘導・停止させる仕組みを備えていることが明らかになりました。
肝臓をはじめとする器官の発生や再生において、機械的恒常性が深く関与する可能性を示した本研究成果は、器官発生や再生などの基礎研究に大きく貢献すると期待できます。さらに、将来の人工的な三次元立体器官の作製において、従来の生理活性物質の調節のみならず、機械的恒常性を利用した技術開発への応用も期待できます。
補足説明
1.肝臓、肝小葉、類洞(るいどう)、門脈
肝臓はヒトの内臓では最大の臓器であり、代謝や解毒など多様な機能を持つ。肝小葉は肝臓の機能単位で、典型的には六角柱の構造をとり、直径と高さはそれぞれ1~2mmほどである。心臓からの肝動脈と、小腸などを経由した静脈(門脈)が肝内に入り、肝小葉の類洞と呼ばれる毛細血管で混じり合った血液が、肝静脈として流出する。
2.機械的恒常性
重力やせん断応力(ずれ応力)、浸透圧、張力など、機械的な刺激の変動に対して生体が反応し、一定の状態を維持すること。
3.サイトカインネットワーク、サイトカインカスケード
細胞の増殖や分化を制御する分泌因子(サイトカイン)は、標的となる細胞に受容されると細胞内タンパク質の連鎖的なリン酸化などを介して、遺伝子発現を制御する。この一連の反応をサイトカインカスケードと呼ぶ。またサイトカインにはさまざまな種類が存在し、それぞれが相互作用して細胞に作用を及ぼすことをサイトカインネットワークと呼ぶ。
4.肝細胞増殖因子(HGF)、上皮成長因子(EGF)、腫瘍増殖因子(TGF-β1)
サイトカインの一種。
5.GPCR
Gタンパク質共役受容体とも呼ばれ、細胞膜上に存在し、細胞の外から内へ情報を伝達する役割を果たす。GPCRは1,000種類以上存在するといわれ、7回膜貫通型という特徴的な形をしている。GPCRはG-protein coupled receptorの略。
6.MAPK
細胞内シグナル伝達因子の一つ。GPCRからのシグナルによりリン酸化され、核内に移行し遺伝子発現を制御する。複数の種類があり、本研究で解析したMAPKはErk1 / 2である。MAPKはMitogen Activated Protein Kinaseの略。
研究チーム
理化学研究所生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
上級研究員 武尾 真(たけお まこと)
研究員 石川 潤(いしかわ じゅん)
原論文情報
Jun Ishikawa, Makoto Takeo, Ayako Iwadate, Junko Koya, Miho Kihira, Masamitsu Oshima, Yuki Suzuki, Kazushi Taniguchi, Ayaka Kobayashi & Takashi Tsuji, “Mechanical homeostasis of liver sinusoid is involved in the initiation and termination of liver regeneration.”, Communications Biology, 10.1038/s42003-021-01936-2
発表者
理化学研究所
生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
上級研究員 武尾 真(たけお まこと)
報道担当
理化学研究所 広報室 報道担当