2021-04-23 理化学研究所,東京工業大学,日本医療研究開発機構
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(東京工業大学物質理工学院応用化学系教授、理研科技ハブ産連本部バトンゾーン研究推進プログラム糖鎖ターゲティング研究チーム副チームリーダー)、ケンワード・ヴォン研究員(同チーム研究員)らの国際共同研究グループは、マウスの体内で遷移金属触媒[1]反応を行うことにより、がん細胞に対して選択的に抗がん活性分子を共有結合(タギング)し、治療に成功しました。
本研究成果は、薬効を遷移金属触媒反応で制御する「生体内合成化学治療」をマウスの体内で実現した初めての例であり、がん治療の新たな戦略としての応用が期待できます。
遷移金属触媒反応を用いて、不活性あるいは弱活性の薬剤をがん細胞上で選択的に活性化できれば、薬剤による副作用の軽減につながります。しかし、体内のがん細胞に選択的に金属触媒を送り込むことは難しく、また体内では金属触媒が容易に失活するため、これまで効率的に治療できませんでした。
今回、国際共同研究グループは、独自に開発した「糖鎖を付加したアルブミンタンパク質と金触媒の複合体」を用いることによって、マウス体内のがん細胞に選択的に抗がん活性物質を結合させました。その結果、薬効ががん細胞で選択的に増強され、副作用を起こさずにがん転移の阻害やがん細胞の増殖を抑えることに成功しました。
本研究は、科学雑誌『Science Advances』オンライン版(4月23日付:日本時間4月24日)に掲載されます。
背景
がんの薬剤開発では、高い抗がん活性を示すだけではなく、副作用を抑えることが重要です。このため、活性がない、あるいは活性の弱い薬剤を体内のがん細胞で選択的に活性化する「プロドラッグ法[2]」が、効果的ながん治療戦略として盛んに検討されています。
遷移金属触媒は、さまざまな反応基質に対して多種多様な反応を起こすことができるため、体内での薬剤活性化法の一つとして注目を浴びています。しかし、体内のがん細胞に選択的に遷移金属触媒を送り込むことは難しく、また遷移金属触媒はグルタチオン[3]をはじめとするさまざまな生体分子と配位して触媒活性が失われます。このため、これまで体内での遷移金属触媒によって効率的にがん治療を行うことはできませんでした。
これまでに国際共同研究グループは、血清アルブミンタンパク質の疎水性ポケットの中へ、疎水性リガンド[4]を介して遷移金属触媒を導入することで、遷移金属触媒が生体内環境で安定化されて、効率的に反応が進行することを発見していました注1)(図1)。さらに、アルブミン表面のアミノ基にアスパラギン結合型糖タンパク質糖鎖(N-型糖鎖)を複数個導入することで、アルブミンが「糖鎖パターン認識」の効果により、体内の特定の臓器やがんへと選択的に移行することを見いだしました注2-3)。これらの発見により、糖鎖を付加し組織指向を持たせたアルブミンに遷移金属触媒を導入することで、体内の望む臓器に「糖鎖付加アルブミン・金属触媒複合体」を移行させ、その現地で望む金属触媒反応を起こすことに成功しました注4)。
そこで今回、マウス体内のがんで選択的に遷移金属触媒反応を行うことにより、副作用のないがん治療を目指しました。
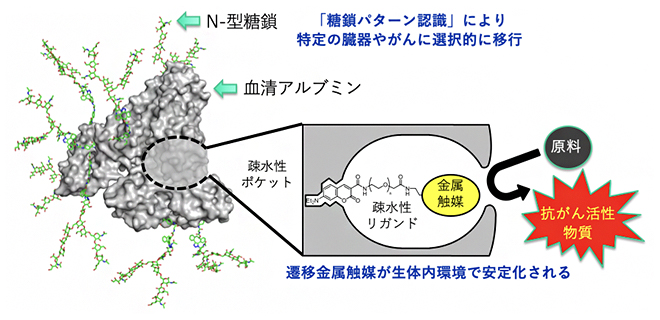
図1 マウス体内の特定の部位で機能する人工金属酵素
血清アルブミンの疎水性ポケットに遷移金属触媒を入れることにより、体内でも金属触媒が安定化される。さらにアルブミンの表面にN-型糖鎖を導入することにより、体内の特定の部位まで金属触媒を運ぶことが可能となり、その体内の現地で金属触媒反応を起こすことができる。
注1)2019年7月2日プレスリリース「触媒的「現地合成」によるがん治療」
注2)2018年7月4日プレスリリース「がんを糖鎖のパターンで認識」
注3)2020年10月21日プレスリリース「糖鎖の不均一性を秩序よく高次化してがんを見つける」
注4)2017年2月15日プレスリリース「狙った臓器で金属触媒反応を実現」
研究手法と成果
国際共同研究グループは遷移金属触媒反応により、抗がん活性物質を体内のがん細胞表面に共有結合(タギング)して治療することを試みました(図2)。α(2,3)シアル酸を持つ糖鎖付加アルブミン・金触媒複合体により、体内のHela細胞(子宮頸がん細胞)へ金触媒を選択的に移行(ターゲティング)させます。次いで、抗がん活性物質にプロパルギルエステルを結合させたものを注射し、金触媒によるアミド化反応で、がん細胞表面タンパク質のアミノ基へ抗がん活性物質を結合させます。このように、がんへ選択的に抗がん活性物質をタギングした結果、周辺の正常組織に影響を与えることなく、がんでのみ抗がん活性を発揮させられるのではないかと考えました。
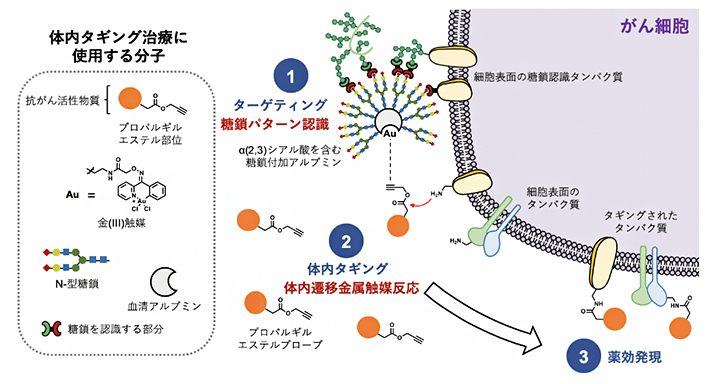
図2 体内タギング治療の概略
まず、α(2,3)シアル酸を持つ糖鎖付加アルブミンの「糖鎖パターン認識」でHelaがん細胞をターゲティングする(①)。ついで細胞表面にあるタンパク質のアミノ基に対して、金触媒によるプロパルギルエステルのアミド化反応により抗がん活性分子をタギングする(②)。この結果、がんで選択的に抗がん活性物質の薬効が発現し、副作用なくがんの転移や増殖が阻害される(③)。
まず、体内タギング治療によってがんの転移を阻害できるかを調べました(図3A)。この際、がん細胞にタギングする抗がん活性物質としては、細胞接着に関わる膜タンパク質インテグリンの阻害分子である、環状RGDyKペプチドを用いました。すなわち、マウスの腹腔内に蛍光酵素のルシフェラーゼで標識したHela細胞を注射して、転移がんモデルを作製しました。この時点からがんの転移が徐々に進行します。Hela細胞を注射してから15分後、糖鎖付加アルブミン・金触媒複合体、およびプロパルギルエステルを持つ環状RGDyKペプチドを順に腹腔内に注射して、体内タギングを行いました。その結果、がんの転移は抑えられ、マウスの生存率が著しく向上しました(図3B-D)。
対照とした環状RGDyKペプチドのみを注射した群では、がん転移を全く抑えることができませんでした。これは、マウスの腹腔内全体に環状RGDyKペプチドが分散し、がん細胞表面のインテグリンへの効果が薄まるためだと考えられます。すなわち、体内タギング治療では、糖鎖付加アルブミン・金触媒複合体がマウスの腹腔内に浮遊するがん細胞を選択的に認識して、このがん細胞表面のアミノ基に環状RGDyKペプチドをタギングします。すると、がん細胞表面での環状RGDyKペプチドの濃度が著しく上昇し、インテグリンと強い相互作用を起こすことができます。その結果、がん細胞の接着を効率的に阻害して、がんの転移を防ぐことができたと考えられます。
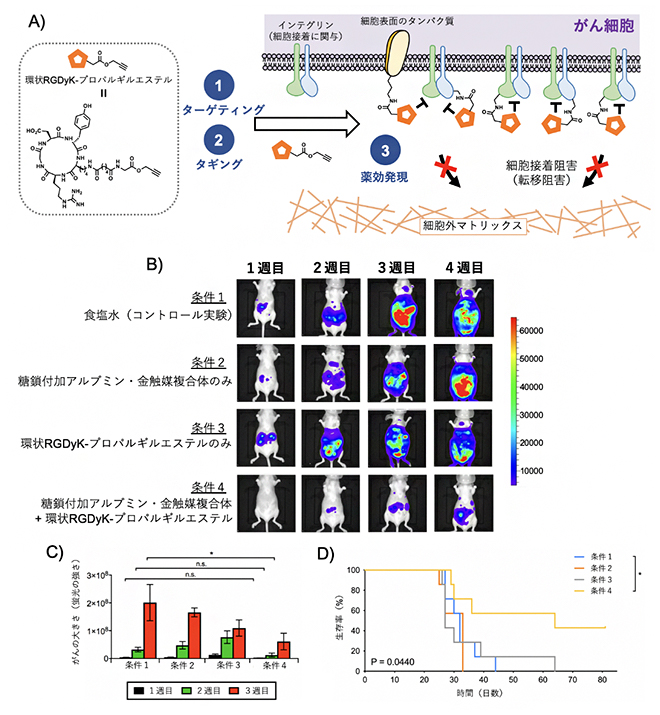
図3 体内タギング法によるがんの転移阻害
(A)体内タギング法によるがん転移阻害の機構:体内でがんをターゲティング(①)した後、金触媒反応により環状RGDyKペプチドをタギングする(②)。環状RGDyKペプチドが、がんの細胞表面で細胞接着に関与するインテグリンと強く相互作用する結果、がんの細胞接着、すなわち転移が阻害される(③)。
(B)ルシフェラーゼ発光イメージングによるがん転移の可視化。色が強いほど転移が起こりやすいことを示す。条件4の場合に、がんの転移が最も抑制されたことが分かる。
(C)発光イメージングの定量データ。
(D)マウスの生存曲線。
さらに、腹腔内で生着したがんに対して、より強い抗がん活性物質であるドキソルビシン[5]をタギングしてがんの増殖を抑制できるかを調べました(図4A)。先の方法と同様にして、マウスの腹腔内にHela細胞を注射した後、1週間経過すると腹腔内にがんが生着しました。このがん生着モデルに対して、糖鎖付加アルブミン・金触媒複合体、そしてプロパルギルエステルを持つドキソルビシンを腹腔内に順に注射しました。その結果、がん細胞の増殖が著しく抑えられ、マウスの生存率も向上することが分かりました(図4B-D)。
金触媒反応により、がん細胞の表面タンパク質にプロパルギルエステルを持つドキソルビシンがタギングします。その後、エンドサイトーシス(細胞内移行)により細胞内に取り込まれ、細胞内酵素によりタンパク質とドキソルビシンをつなぐ結合部分が切断され、抗がん活性本体のドキソルビシンががん細胞内で放出され、がん細胞を消滅させ治療効果が得られたと考えられます。
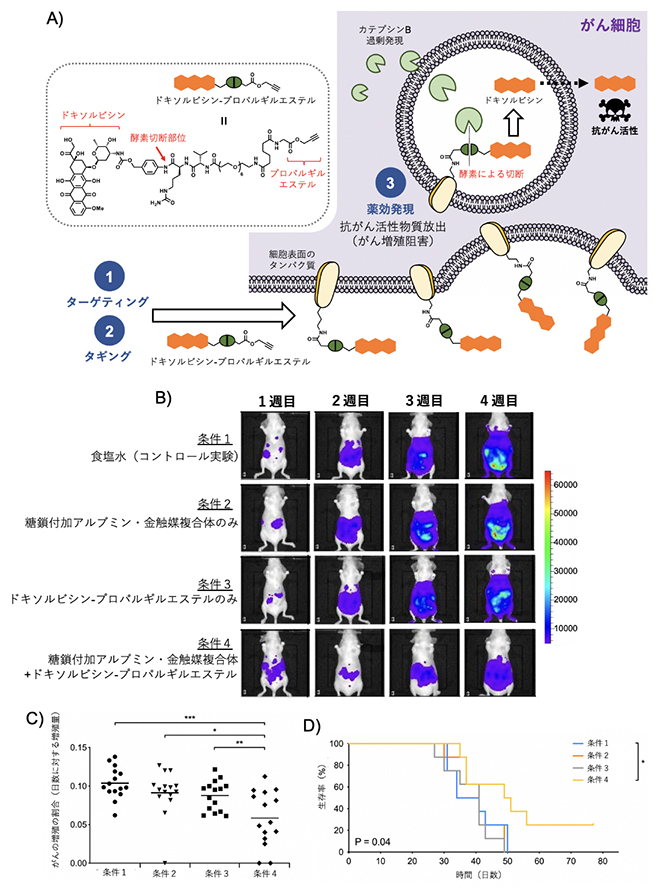
図4 体内タギング法によるがんの増殖阻害
(A)体内タギング法によるがん増殖阻害の機構:①がんをターゲティングした後、②ドキソルビシン誘導体をタギングする。③表面タンパク質にタギングされたドキソルビシンがエンドサイトーシス(細胞内移行)され、細胞内でカテプシンB(酵素)による切断を受けて、活性本体であるドキソルビシンが放出される。その結果、がんがアポトーシスに導かれる。
(B)発光イメージングによるがん増殖の可視化。条件4の場合に、がんの増殖が最も抑制されたことが分かる。
(C)がんが増殖する割合。
(D)マウスの生存曲線。
今後の期待
今回、新しい薬剤活性化の戦略として、抗がん活性物質を体内の遷移金属触媒反応でタギングする方法を開発しました。本研究成果は、薬効を遷移金属触媒反応で制御する「生体内合成化学治療」をマウスの体内で実現した初めての例です。
糖鎖付加アルブミン・遷移金属触媒複合体を用いることにより、薬剤をタギングして薬効を調整するだけでなく、今後、さまざまな薬剤を自在に合成できる可能性を示しています。体内での遷移金属触媒反応ががん治療の新たな戦略としての利用が期待できます。
補足説明
1.遷移金属触媒
周期表の第3族から第11族までに属する遷移金属元素により構成される触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
2.プロドラッグ法
プロドラッグは、薬剤の標的部位での生体内反応を引き金として、薬効を持つ化合物へと変換されるようにデザインされた薬剤。プロドラッグを用いる手法によって、薬剤の組織選択性の向上による副作用の軽減、吸収性の向上、代謝安定性の向上が期待できる。
3.グルタチオン
グルタミン酸、システイン、グリシンからなるトリペプチドで、細胞内に高濃度で存在する。活性酸素種や生体分子と反応することで細胞を守るなど、生命維持に重要な役割を果たしている。一般的に、システインのチオール基が遷移金属触媒を不活化する。
4.リガンド
特定の生体分子と結合することで、生理的な作用を発揮する物質のこと。一般的には受容体に結合する分泌因子(ホルモンや成長因子など)を指すことが多い。
5.ドキソルビシン
アントラサイクリン系の抗がん活性物質の一つであり、がん細胞のDNAの塩基対間に入り込んでDNAとRNAの生合成を阻害することで抗がん活性を示す。
国際共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系教授、理研 科技ハブ産連本部 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)
研究員 ケンワード・ヴォン(Kenward Vong)
(理研 科技ハブ産連本部 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 研究員)
テクニカルスタッフⅡ 浦野 清香(うらの さやか)
特別研究員 イゴール・ナシブリン(Igor Nasibullin)
大学院生リサーチ・アソシエイト(研究当時) 坪倉 一輝(つぼくら かずき)
生命機能科学研究センター
生体機能動態イメージング研究チーム
研究員 田原 強(たはら つよし)
生体機能評価研究チーム
チームリーダー(研究当時) 尾上 浩隆(おのえ ひろたか)
健康・病態科学研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
早稲田大学大学院 理工学術院
教授 中尾 洋一(なかお よういち)
研究支援
本研究は、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
原論文情報
Kenward Vong, Tsuyoshi Tahara, Sayaka Urano, Igor Nasibullin, Kazuki Tsubokura, Yoichi Nakao, Almira Kurbangalieva, Hirotaka Onoe, Yasuyoshi Watanabe, and Katsunori Tanaka, “Disrupting tumor onset and growth via selective cell tagging (SeCT) therapy”, Science Advances, 10.1126/sciadv.abg4038
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授、理研 科技ハブ産連本部 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)
研究員 ケンワード・ヴォン(Kenward Vong)
(理研 科技ハブ産連本部 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 研究員)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当