内在性リガンドと協調的に機能する新たな機能性核酸分子の発見
2021-04-30 東京大学,株式会社リボミック,日本医療研究開発機構
発表者
高橋 理貴(東京大学医科学研究所 RNA医科学社会連携研究部門 特任准教授)
発表のポイント
- 創薬標的として重要でありながら、活性制御分子の取得が極めて困難である膜受容体GPCR(注1)に対して、核酸抗体「RNAアプタマー」(注2)を活用した汎用的な活性制御分子創製法を開発しました。
- 開発技術によって、GPCRの内在性リガンド結合状態(注3)に依存して受容体の活性を制御するユニークな新規核酸分子の創製に成功しました。
- これまで困難とされた種々のGPCRに対する創薬実現に加え、ユニークな活性制御分子を創製することでGPCRの機能発現機構の解明とその制御を目的とした学術研究の発展に貢献することが期待されます。
発表概要
東京大学医科学研究所RNA医科学社会連携研究部門の高橋理貴特任准教授、株式会社リボミックの中村義一代表取締役社長(東京大学名誉教授)らの研究グループは、創薬標的として重要でありながら、一般的な医薬形態である低分子化学物質や抗体などでは活性制御分子の創製が極めて困難であった膜受容体GPCRに対して、核酸抗体「RNAアプタマー」を用いたGPCR活性制御分子の新たな創製法を開発しました。構造が不安定なGPCRを生理的構造に安定化するウイルス様粒子(以下VLP、注4)や核酸分子の情報処理技術(HTS、注5)やバイオインフォマティクス)など種々の技術を包括的に活用することによって、GPCRの活性制御分子を効率的に探索する新たな技術「VLP-SELEX法」を開発しました(図1)。また、開発技術によって取得された分子の一つは、内在性リガンドの結合状態に依存して機能するユニークな活性制御分子であることを明らかにしました(図2)。
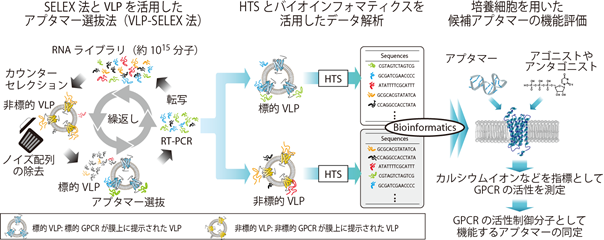
図1.GPCRの活性制御分子として機能する核酸抗体・RNAアプタマー創製法の概略図標的および非標的のGPCRが膜上に提示されたVLPを用いて、ノイズとなる目的としないアプタマーを除去し(カウンターセレクション)、目的とするアプタマー分子を取得します(VLP-SELEX法)。次いで、標的および非標的VLPにそれぞれ結合した膨大な種類のアプタマー分子を、HTSによって数百万分子以上のアプタマー塩基配列を解読します。バイオインフォマティクスを用いて候補分子を絞り込み、最終的に培養細胞を用いた試験によって、GPCRの活性に影響を与えるアプタマーを同定します。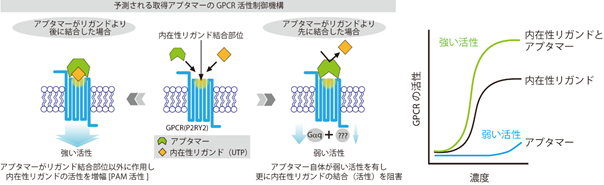
図2.GPCRに対してユニークな活性を持つ機能性核酸分子の作用機構の予測概略図VLP-SELEX法にて取得されたアプタマー分子の一つは、P2RY2受容体の内在性リガンド結合状態に依存して機能するユニークな活性制御分子であることを明らかにしました。アプタマーが内在性リガンドより後に結合した場合、リガンドの活性を大きく増幅しましたが(PAM活性)、後から結合した場合、アプタマー単独で弱い活性を示しつつ内在性リガンドの結合(活性化)を阻害しました。リガンドとアプタマーが同時に結合(作用)でき、後続のリガンド結合(作用)を断つことから、GPCRの内在性リガンド結合部位を覆い塞ぐように結合するアプタマーであることが予想されます。
本研究成果は、これまで困難とされたGPCR機能制御分子の取得技術に新たな選択肢を提案するもので、創薬や学術研究ツールとして幅広い研究領域の発展に貢献することが期待されます。本研究成果は、2021年4月26日(米国東部夏時間)以降に米国科学誌「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」オンライン版に掲載されます。
発表内容
本研究グループは、膜受容体GPCRに対して、機能性核酸分子の一つである核酸抗体「RNAアプタマー」を用いたGPCR活性制御分子の新たな創製法を開発しました。GPCRは生体の恒常性維持に極めて重要な役割を果たしており、現在の上市医薬の約30%がこの受容体を標的としています。しかし、その生体における重要性や高い創薬需要がありながらも、効果的な結合分子や活性制御分子の創製は依然困難であり、手付かずのGPCRが未だ数多く残されています。これを解決するためには、従来から医薬分子として活用されてきた低分子化学物質よりも高い特異性を持ち、抗体よりも多様なスクリーング材料を許容できる創薬モダリティが必要だと考えられます。
本研究グループは上記課題を解決するために、抗体のような機能を有する核酸分子「RNAアプタマー」に着目し、新たなGPCR活性制御分子の創製法開発に取り組みました。RNAアプタマーは一本鎖のRNAであり、配列依存的に特有の立体構造をとることで、標的とする任意のタンパク質に対して構造相補的に強く特異的に結合します。1990年に確立されたSELEX法(注6)と呼ばれるスクリーニング法よって創製される当該分子は、医薬分子としての有益な分子特性が多いことから、次世代の医薬分子として期待されています。今回、本研究グループは、そのRNAアプタマーとスクリーニング法の特徴に着目して、構造が不安定なGPCRを生理的構造に安定化するVLPのメリットを活かしながら、VLP使用においてデメリットとなるGPCR以外のタンパク質を多く含有する点を克服することで、GPCRの活性制御分子を効率的に探索する新たな技術(VLP-SELEX法)を開発しました(図1)。
具体的には、今回モデル標的としたGPCRであるP2RY2(注7)を膜上に有する標的VLPと、標的としないGPCRを膜上に有する非標的VLPを用意し、非標的VLPに結合するノイズとなるアプタマー分子を効率的に除去する方法を構築しました。さらに、標的VLPと非標的VLPとに結合する膨大な数のアプタマー分子(塩基配列)をそれぞれHTSで解読し、各VLPに結合した分子を塩基配列情報へと変換しました。その後、バイオインフォマティクスを利用して標的VLPつまり目的とするGPCR(P2RY2)への結合が期待できる配列を絞り込みました。そして、それら候補配列の機能について、培養細胞を用いた試験で調べた結果、候補配列の一つは、GPCRのアロステリック部位(注8)に結合し内在性リガンドの結合状態に依存して受容体を活性化するユニークな機能があることを明らかにしました。内在性リガンドが結合していないときは、アプタマー単独で弱いアゴニスト活性を示し、また後続で内在性リガンドを添加した場合、リガンドの活性(結合)を阻害しました。一方、内在性リガンドが先に結合する状況では、内在性リガンドの活性を大きく増幅する作用、すなわち「PAM活性」(注9)があることが分かりました(図2)。つまり、当該アプタマーは、機能面ではPAM分子に大別され、また結合様式としてはアロステリック部位に結合し内在性リガンド結合部位を覆い塞ぐような形式が推測されるユニークな活性制御分子であると考えられます。
また、これまでアプタマーの多くは、タンパク質間の相互作用を阻害する機能抑制剤として単離・開発されており、このような受容体活性化能を有する分子は極めて稀で、またGPCRに対してこのような機能を発揮するアプタマーは世界で初めての報告となります。このことから、今回の研究で構築した技術は、非常に多様な機能を持つ活性制御分子を創製できる技術であることが分かりました。今後、構造生物学的な解析により、分子レベルでの作用機序の解明に取り組んでいきたいと考えています。
本研究から得られた活性制御分子とその創製技術の確立は、内在性リガンドの結合をトリガーとしてGPCRを活性化する新たな医薬分子の開発、また未だ不明な点が多く残されているGPCRの複雑な活性化機構を解明する学術研究などに貢献すると期待されます。
※本研究は、日本医療研究開発機構(AMED)創薬基盤推進研究事業、科学研究費補助金挑戦的研究(萌芽)(17k20087)の支援を受けて実施されました。
発表雑誌
- 雑誌名:
- Proceedings of the National Academy of Sciences of the United States of America(PNAS)
- 論文タイトル:
- Nucleic acid ligands act as a PAM and agonist depending on the intrinsic ligand binding state of P2RY2
- 著者:
- Masaki Takahashi*, Ryo Amano, Michiru Ozawa, Anna Martinez, Kazumasa Akita, Yoshikazu Nakamura*(*責任著者)
- DOI番号:
- 10.1073/pnas.2019497118
- アブストラクトURL:
- https://www.pnas.org/cgi/doi/10.1073/pnas.2019497118
用語解説
- (注1)GPCR:
- Gタンパク質共役型受容体(G-Protein Coupled Receptor)。細胞膜を7回貫通する特徴的な構造を持ち、生体の恒常性維持に非常に重要な役割を担っている膜受容体の一つ。
- (注2)RNAアプタマー:
- おおよそ30~80塩基程度の一本鎖のRNA分子であり、配列に依存して特有の立体構造を形成し、標的分子に対して構造相補的に結合する分子。
- (注3)内在性リガンド結合状態:
- ある受容体に対して、それに結合する生体内にもともと存在するリガンド(内在性リガンド)が結合しているのか否か。
- (注4)VLP:
- ウイルス様粒子(Virus-Like Particle)。ウイルスと同様あるいは極めて類似した外部構造を持つ粒子。種々の膜タンパク質を表面に提示することができ、様々な研究分野で利用されている
- (注5)HTS:
- ハイスループットシーケンシング(High-Throughput Sequencing)。数百万規模のDNA分子の配列を特定できる技術。
- (注6)SELEX(Systematic Evolution of Ligands by EXponential enrichment) 法:
- 1990年に開発されたアプタマー創製技術。膨大な数(約10の15乗分子)のDNAもしくはRNA分子のライブラリーと、標的分子とを混ぜ、結合する核酸分子を選抜し、増幅する。増幅した分子群を再度ライブラリーとして用い、選抜と増幅を繰り返すことで、標的分子に強く特異的に結合するアプタマーを取得する技術。
- (注7)P2RY2:
- Purinergic receptor P2Y2。GPCRの一つであり、ヌクレオチドをリガンドとして活性化される受容体。生体内で広範囲に発現しており、様々な疾患への関与が報告されている。
- (注8)アロステリック部位:
- 酵素の基質や受容体のリガンドが結合する部位(オルソステリック部位)以外で、活性に影響を与える部位。この部位に結合し相互作用する分子はアロステリックモデュレーターと呼ばれ、これまでに様々な種類の分子(化学物質やペプチド)が見つかっている。
- (注9)PAM:
- ポジティブアロステリックモデュレーター(Positive Allosteric Modulator)。アロステリックモデュレーターの中でも活性を促進する分子であり、そのような活性をPAM活性と呼ぶ。
お問い合わせ先
研究に関するお問い合わせ
東京大学医科学研究所 RNA医科学社会連携研究部門
特任准教授 高橋 理貴(たかはし まさき)
報道に関するお問い合わせ
東京大学医科学研究所 国際学術連携室(広報)清水
AMEDの事業に関するお問い合わせ
日本医療研究開発機構 創薬事業部 医薬品研究開発課