2021-05-01 東京大学
金 尚宏 (研究当時:生物科学専攻 特任助教/現:名古屋大学トランスフォーマティブ生命分子研究所 特任講師)
岩本 隆宏 (福岡大学医学部 薬理学 教授)
深田 吉孝 (研究当時:生物科学専攻 教授/現:大学院医学系研究科 特任研究員)
発表のポイント
- 哺乳類、昆虫、植物、細菌で共通する初めての体内時計の部品として、カルシウムイオン(Ca2+)制御因子を発見し、一日周期の細胞内Ca2+の増減が体内時計の中心であることを提唱。
- 体内時計は動物、植物、細菌で独立に誕生したと考えられていた。しかし、体内時計の起源はずっと古く、生命の共通祖先の体内時計にCa2+が関わっていたことが示唆された。
- カルシウムイオンの制御により体内時計を操作する薬剤を見出し、睡眠障害やうつ病を克服する新しい薬の開発が期待される。また、全生物最終共通祖先(注1)の体内時計を知る手がかりとなった。
発表概要
名古屋大学トランスフォーマティブ生命分子研究所 金 尚宏 特任講師(研究当時:東京大学大学院理学系研究科 特任助教)、東京大学大学院理学系研究科生物科学専攻の深田 吉孝 教授(研究当時)、福岡大学医学部薬理学の岩本 隆宏 教授らの研究チームは、哺乳類、昆虫、植物および細菌の体内時計に共通して働く因子として、カルシウムイオン(Ca2+)制御タンパク質であるNa+/Ca2+交換輸送体 (NCX)(注2)を発見した。24時間周期の体内時計である概日(がいじつ)時計(注3)を構成する遺伝子は時計遺伝子(注4)と呼ばれる。これまでに見つかっていた時計遺伝子は動物、植物、細菌で保存性が低いことから、体内時計は生物種ごとに独立に誕生したと考えられてきた。
研究チームは、体内時計の重要な性質である温度補償性(体内時計が環境温度によらず一定の周期を保つ性質)に着目して解析を進めたところ、NCXによる細胞内Ca2+の制御が体内時計の機能に必須であることを見出し、一日周期の細胞内Ca2+の増減が体内時計の本体であることを提唱した。さらに研究グループは、NCX活性を阻害する薬剤によって、体内時計の周期や時刻を操作できることを見出した。(図1)
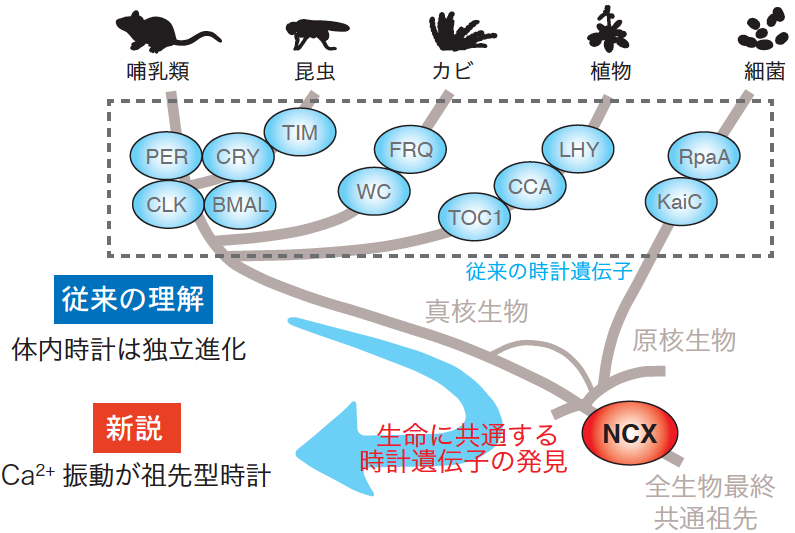
図1:これまで発見されていた時計遺伝子は哺乳類や昆虫などの動物、カビ、植物、細菌で保存性が低いことから、体内時計は独立進化したと考えられていた。本研究では、生命に共通する時計因子としてNa+/Ca2+交換輸送体(NCX)を見出した。NCXは細胞内Ca2+濃度を制御するタンパク質である。多くの生物種で細胞内Ca2+濃度は一日周期で増減を繰り返すことから、Ca2+振動が体内時計の起源として働いていたと考えられる。
本発見は、体内時計の操作により、睡眠障害やうつ病を克服する医薬品の開発につながる。そして、私たち生命の共通祖先において、どのようにして体内時計が生まれたのかを知る画期的な手がかりとなった。
発表内容
私たちの睡眠や情動、記憶力などの脳機能は体内時計によって制御されている。そのため、体内時計の仕組みの理解は、睡眠障害やうつ病の克服など臨床的な応用に直結しており、注目を集めている。24時間周期の体内時計は概日時計と呼ばれ、ヒトからバクテリアまで存在している。概日時計によって生み出される一日周期のリズムは概日リズムと呼ばれ、時計遺伝子による転写・翻訳フィードバックループ (以下、転写ループ)が重要な役割を果たしている。最初の時計遺伝子をショウジョウバエにて発見した米国の3名の科学者は、2017年のノーベル医学生理学賞の対象となった。これまで、時計遺伝子は動物、真菌類、植物、細菌で見つかっているが、それらの間で相同性が低いことから、生物種ごとに独立進化したと考えられてきた。
時計遺伝子による転写ループが概日リズム生成に必須であることは分かっていたが、概日時計の本体と考えるには不思議な部分があった。概日時計は温度補償性という、環境温度が変化しても周期が24時間に保たれる性質を有する。転写や翻訳などの生化学反応は、温度によって反応速度が変化し、例えば温度を10度下げるとその反応速度は1/2倍から1/3倍に遅くなってしまう。そこで、単純に転写ループだけで体内時計が構成されているとすると、温度が10度下がった場合に時計の周期が48時間や72時間となってしまう。温度補償性を説明するためには、温度低下による生化学反応の速度低下を補償する仕組みが必要であることが70年近く前から提唱されていたが、その実体は謎に包まれていた。
名古屋大学トランスフォーマティブ生命分子研究所 金 尚宏 特任講師(研究当時:東京大学大学院理学系研究科 特任助教)、東京大学大学院理学系研究科生物科学専攻の深田 吉孝 教授(研究当時)、福岡大学医学部薬理学の岩本 隆宏 教授らの研究チームは、培養細胞にも概日時計が存在するという性質に着目し、細胞時計の温度補償性に影響を及ぼす薬剤をスクリーニングした。その結果、Na+/Ca2+交換輸送体 (NCX)とCa2+/カルモジュリン依存性キナーゼII (CaMKII)という細胞内カルシウムシグナルに関わる2つのタンパク質の阻害剤存在下では、温度補償性が破綻することを見出した。
解析を進めたところ、環境温度の低下に伴ってNCXが細胞内Ca2+流入を促進し、それによって活性化したCaMKIIが転写ループの振動速度の低下を防いでいることが分かった。すなわち、本来は温度低下によって速度低下する転写ループは、低温で活性化するCa2+シグナルによって24時間の周期に保たれていたのである。この低温性Ca2+シグナルは哺乳類だけでなく昆虫、植物、細菌の概日時計でも機能していることが判明し、幅広い生命に保存された仕組みであることが分かった。NCXの機能が広い生物種の時計機能に保存されているという事実は、NCXがこれらの共通祖先の時計機能に関わっていたことを示唆する。すなわち、時計遺伝子の転写ループは動物や植物、細菌が系統的に分岐した後に生まれた一方で、カルシウムによる概日時計の制御は共通祖先から機能していたと考えられる。
そこで研究チームは、NCXは温度補償性だけでなく概日時計そのものにも関わると推定し、NCX機能が低下した動物を解析した。その結果、マウスおよびショウジョウバエにおいて、一日周期の行動リズムが著しく障害されることが分かった。これらの動物の体内時計のペースメーカー神経において、細胞内Ca2+は一日周期で増減を繰り返している。そこで研究チームは、細胞内Ca2+振動が転写ループの上流で機能する祖先的な振動体なのではないかとの見解に至っている。
現在の生命は、全生物最終共通祖先 (Last Universal Common Ancestor, このあとLUCAと略)から多様化し進化して生まれたと考えられている。そこで、現生の生物において広く保存された遺伝子群を調べれば、LUCAが保持していたであろう遺伝子が予測される。2016年、ドイツの研究者らは細菌と古細菌の間で高度に保存された355の遺伝子を同定し、それらをLUCAの遺伝子群と結論した [Nature Microbiology, 1, 16116 (2016)]。興味深いことに、今回の研究で見つかったNCXをコードする遺伝子は、その355の遺伝子群に含まれている。ここから、体内時計の起源はこれまで考えられていたよりもずっと古く、もしかしたらLUCAが存在した時代である約38億年前から存在した可能性も考えられる。今回の研究成果は、私たち生命の共通祖先において、どのようにして体内時計が生まれたのかを知る画期的な手がかりとなった。
共通祖先の体内時計の仕組みは、現生の生物でも中心的な役割を保持している。研究グループは、NCXやCaMKII阻害剤を用いることによって、概日時計の周期や時刻を制御することに成功している。これらの発見は、細胞内Ca2+の制御により私たちの体内時計を自由に制御できる技術開発につながるものであり、睡眠障害やうつ病など、体内時計に関わる疾患の克服へ新しい道を切り開いたと言える。
発表雑誌
- 雑誌名
Science Advances論文タイトル
Na+/Ca2+ exchanger mediates cold Ca2+ signaling conserved for temperature-compensated circadian rhythms著者
Naohiro Kon†, Hsin-tzu Wang, Yoshiaki S. Kato, Kyouhei Uemoto, Naohiro Kawamoto, Koji Kawasaki, Ryosuke Enoki, Gen Kurosawa, Tatsuto Nakane, Yasunori Sugiyama, Hideaki Tagashira, Motomu Endo, Hideo Iwasaki, Takahiro Iwamoto*, Kazuhiko Kume, Yoshitaka Fukada*DOI番号
10.1126/sciadv.abe8132論文URL
用語解説
注1 全生物最終共通祖先 (Last Universal Common Ancestor, LUCAと略)
生命の遺伝子系統樹を作製すると、原核生物と真核生物の分岐よりも以前に、古細菌と真正細菌の分岐が起きていることが分かる。全生物最終共通祖先(LUCA)とは古細菌と真正細菌の共通祖先である。真核生物は、古細菌の一種が真正細菌を取り込んで誕生したと考えられている。LUCAがいかなる生物であるかは、分子生物学だけでなく古生物学や地質学、合成化学からも多くの提案がなされており、ゲノムサイズの小さい好熱菌であると考えられている。古細菌と真正細菌の間で高度に保存された遺伝子群を抽出した解析から、LUCAが保持していたであろう355遺伝子が発表されている。その中には、NCXの祖先型をコードするyrbG遺伝子も存在する。
注2 Na+/Ca2+交換輸送体 (NCX)
細胞膜を介して3個のNa+と1個のCa2+を交換輸送するイオン輸送体。このイオン輸送は両方向性(Ca2+流出モードとCa2+流入モード)であり、その輸送方向は細胞内外のNa+とCa2+の濃度勾配と膜電位によって決定される。
注3 概日時計(がいじつとけい)
概日リズムを生み出す中枢機構。一日に近い周期で自律的に振動し、種々の生理機能に作用して概日リズム [下記の(注5)参照]を発現させるはたらきをもつ。概日時計の三大性質として、自律振動性、環境同調性、温度補償性がある。哺乳類では視床下部のsuprachiasmatic nuclei (視交叉上核)に概日時計のペースメーカーが存在しており、全身の細胞に存在する概日時計の位相 (時刻)を同調している。
注4 時計遺伝子
概日リズムの発生機構を構成する蛋白質をコードする遺伝子。多くは概日リズムの周期の突然変異体や無周期変異体からクローニングされた。真核生物の場合、時計遺伝子の多くは転写制御因子をコードしており、自己抑制フィードバックループを形成している。2017年、最初の時計遺伝子Periodを発見した米国の3人の研究者がノーベル医学生理学賞を受賞した。現在、時計遺伝子による転写・翻訳フィードバックループは分子生物学の教科書でも説明されている概日リズムの生成メカニズムである。本研究では、その上流に存在する新たな振動メカニズムとして、細胞内Ca2+振動とその制御タンパク質を発見した。
注5 概日リズム (circadian rhythm)
生物の内因的な周期現象で、環境の周期変動のない状態でも起こる。すなわち、概日リズムは変動をできるだけ一定に保った、恒常環境に移されたあとも約一日周期で継続する。