2021-05-18 京都大学iPS細胞研究所,日本医療研究開発機構
ポイント
- iPS細胞にゲノム編集を施し、移植先の免疫細胞に攻撃されないT細胞を作製した。
- 作製したT細胞にCAR遺伝子注1)を導入し、腫瘍とヒトの免疫細胞を持つマウスモデルに移植して観察すると、T細胞がヒト免疫細胞の反応を避けながら腫瘍を小さくしている様子が観察された。
- 本手法で作製したT細胞はドナーとレシピエント注2)の型を合わせる必要がなく、患者さんを選ばないユニバーサルながん免疫療法として、広く活用できることが期待できる。
要旨
がんの治療法の1つとして、T細胞を移植する免疫療法が注目されていますが、患者さん自身の細胞ではなく、他人のT細胞を患者さんに移植する場合、レシピエントの免疫拒絶反応を制御する必要があります。王 博研究員(CiRA増殖分化機構研究部門)および金子 新教授(CiRA同部門)らの研究グループは、iPS細胞にゲノム編集を施してT細胞に分化することで、レシピエントの免疫細胞から攻撃を受けず、尚且つがん細胞を攻撃する“ステルスファイターT細胞”を作製することに成功しました。
まず、レシピエントのキラーT細胞注3)とヘルパーT細胞注4)の反応をなくすため、iPS細胞においてHLA注5)分子の存在に重要な遺伝子をノックアウト注6)し(概要図①)、次にレシピエントのNK細胞注7)の攻撃を回避するため、NK細胞の活性に関わるリガンド注8)を改変しました(概要図②)。最後に、CAR遺伝子を導入し(概要図③)、ステルスファイターT細胞を作製しました。このT細胞を移植することにより、レシピエントの免疫拒絶反応を受けずに病態に反応して腫瘍を小さくしていることをマウスモデルで確認しました。本手法を用いることで、患者さんを選ばないユニバーサルなT細胞免疫療法として、広く活用できることが期待できます。
この研究成果は2021年5月18日午前0時(日本時間)に英国科学誌「Nature Biomedical Engineering」でオンライン公開されます。
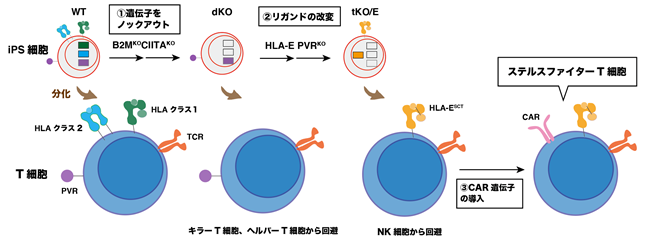
概要図
研究の背景
がんや感染症の治療法としてCAR遺伝子や、TCR(T細胞受容体)注9)を導入したT細胞療法が注目され、研究が進んでいます。しかし、患者さん自身の細胞を移植する自家移植においては、時間と費用がかかることから広く普及するのは容易ではありません。そこで、他人の細胞から予めT細胞を作製して保存し、必要なときに患者さんに移植する他家移植が開発されています。しかし、他家移植の最大の懸念は、レシピエントとドナーの細胞の型が一致しないことによるレシピエントの免疫拒絶反応です。
金子 新教授らの研究グループはこれまで、iPS細胞ストック注10)で保存されている細胞株を用いてTCRを導入した、抗原特異性の安定したキラーT細胞を作製することに成功しています(CiRAニュース:2018年11月16日「ヒトiPS細胞からがん免疫療法の効果を高める再生キラーT細胞の作製に成功~ゲノム編集した患者さん由来iPS細胞・ヒトiPS細胞ストックともに成功」 )。しかし今後の臨床に向けて、iPS細胞を含む多能性幹細胞由来のT細胞療法が有効であると結論付けるには、以下の条件を満たさなければなりません。
(1)病態に対してドナーT細胞が充分に反応すること(ファイター性)
(2)レシピエントの免疫細胞からの反応を受けにくいこと(ステルス性)
(1)を満たすためにはTCRを導入する方法の他、他家移植の際はドナーとレシピエントの細胞の型の一致を必要としないCAR遺伝子を導入する方法が一般的です。しかし、T細胞に直接遺伝子導入やゲノム編集を何度も施すと、T細胞が弱ってしまい、病態に反応する機能が衰えてしまうという問題があります。(2)を満たすためには、移植する細胞のHLAクラス1分子注5)を除去することにより、レシピエントのキラーT細胞からの免疫反応を回避する方法がありますが、HLAクラス1分子が無いことにより逆に活性化されるNK細胞や、HLAクラス2分子注5)を認識するヘルパーT細胞の免疫拒絶反応は残ります。研究グループはこれまで、ドナー細胞のHLA-AとHLA-Bを壊し、HLA-Cを保持する手法によって免疫拒絶反応の少ないiPS細胞を作製することに成功しました。この手法によって、多くの患者さんを十数種のiPS細胞株でカバーできると考えられています(CiRAニュース:2019年3月8日「ゲノム編集技術を用いて拒絶反応の少ないiPS細胞を作製することに成功」 )。
今回本研究グループは、上記とは異なる方法で、数少ないiPS細胞株で多くの患者さんの免疫療法を実現するアプローチを検討しました。具体的には、HLAクラス1分子を無くした上で、HLAクラス2分子を無くし、さらにNK細胞の活性に関わるリガンド2つの改変を試みました。最後にCAR遺伝子を導入することで、(1)と(2)を満たす“ステルスファイターT細胞”の作製を目指しました。また、本手法はT細胞に直接ゲノム編集を行うのではなく、iPS細胞の段階でゲノム編集を行ってからT細胞に分化させることで、T細胞の弱体化を防止しました。
研究結果
1)B2M遺伝子とCIITA遺伝子をノックアウトし、HLAクラス1とクラス2分子を除去する(“dKO”の作製)→レシピエントのキラーT細胞とヘルパーT細胞の反応を回避。
HLAクラス1分子はキラーT細胞に自己か非自己を認識する“型”を提示し、キラーT細胞はHLAクラス1の“型”が非自己と認識された場合のみ攻撃を開始します。一方、HLAクラス2分子はヘルパーT細胞に“型”を提示し、非自己と認識された場合は、ヘルパーT細胞自身は攻撃を行いませんが、キラーT細胞を活性化させる物質を放出します。
本研究ではまず、CRISPR-Cas9ゲノム編集技術注11)を用いて、HLAクラス1分子とHLAクラス2分子それぞれの構成に重要なタンパク質B2MとCIITAをヒトiPS細胞からノックアウトさせました(作製したこのB2MノックアウトiPS細胞を”B2MKO”B2MとCIITAをノックアウトしたiPS細胞を“dKO”とする)。それらのiPS細胞をT細胞に分化させ、ドナーiPS細胞とは別人由来のキラーT細胞あるいはヘルパーT細胞と共培養させると、 WT(ゲノム編集をしていないiPS細胞から分化させたT細胞)と比べレシピエントのT細胞の活性が減ることが確認できました(図1b)。このことは、dKO由来のT細胞が、レシピエントのキラーT細胞からの攻撃や、ヘルパーT細胞からのキラーT細胞を活性化させる物質の放出を受けていないことを意味します。
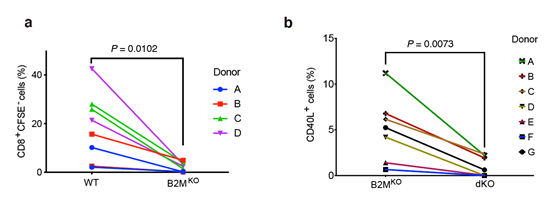
図1:共培養させたレシピエントのキラーT細胞とヘルパーT細胞の活性の変化(a)WT(ゲノム編集をしていないiPS細胞から分化させたT細胞)とB2MKO(B2MのみをノックアウトしたiPS細胞から分化させたT細胞)とキラーT細胞を共培養させ、キラーT細胞の活性を調べた。縦軸はキラーT細胞の活性を表す。B2Mをノックアウトすると活性が下がっていることが分かる。
(b)B2MKOとdKO由来のT細胞とヘルパーT細胞を共培養させ、ヘルパーT細胞の活性を調べた。縦軸はヘルパーT細胞の活性を表す。B2MKOではヘルパーT細胞の活性は残るが、dKO由来のT細胞では活性が下がっていることが分かる。
2)iPS細胞に単鎖HLA-E遺伝子を付加し、PVR遺伝子をノックアウトする(“tKO/E”の作製)→レシピエントのNK細胞の攻撃を回避。
HLAクラス1分子とHLAクラス2分子を除去することにより、レシピエントのキラーT細胞とヘルパーT細胞の反応を防ぐことはできましたが、HLAクラス1分子がないことによって自己性を喪失した異常な細胞(missing self)であると見なされ、NK細胞からの攻撃を受けるようになります。そこで、研究グループは、HLA-EというNK細胞を抑制させるリガンドに着目しました。これまでの研究で、HLAクラス1分子が無い状態の細胞に新たにHLA-Eを付加させることで“missing self”ではないと見なされ一部のNK細胞からの細胞障害を抑えることが確認されています。そこで、本研究では、ウイルスベクター注12)を用いてdKOにHLA-Eを導入し、“missing self”によるNK細胞の攻撃を回避させました(作製したこのiPS細胞を“dKO/E”とする)。
これまでの研究で、NK細胞はさまざまなセンサー群により細胞を認識していることが分かっており、HLA-Eのみでは制御できないNK細胞が存在することが確認されています。本研究では、HLA-Eとは独立してNK細胞の活性に関わるリガンドを見つけるため、iPS細胞から作ったT細胞のさまざまなリガンドをスクリーニング注13)しました。すると、PVRというリガンドがNK細胞の制御に強く関連していることを突き止め、dKO/EにCRISPR-Cas9ゲノム編集技術を用いてPVRをノックアウトさせました(作製したこのiPS細胞を“tKO/E”とする)。tKO/Eから分化させたT細胞を活性させたNK細胞と共培養させると、ゲノム編集を施していない場合(WT)と同等にT細胞が生存し、NK細胞から攻撃を受けていないことが確認できました(図2)。
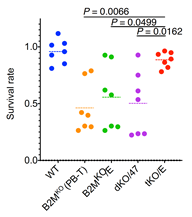
図2:NK細胞を共培養させたときのT細胞の生存率WT:ゲノム編集をしていないiPS細胞から分化させたT細胞、
B2MKO(PB-T):B2MをノックアウトさせたT細胞(iPS細胞由来ではない)、
B2MKO/E:B2MとCIITAをノックアウト+HLA-Eを付加したiPS細胞由来のT細胞
dKO/47:B2MとCIITAをノックアウト+CD47を付加したiPS細胞由来のT細胞
tKO/E:B2M、CIITA、PVRをノックアウト+HLA-E付加したiPS細胞由来のT細胞
tKO/Eから分化させたT細胞はWTと同等の生存率を示す。
3)tKO/E由来T細胞にCAR遺伝子を導入し、ヒト免疫細胞と腫瘍を同時にマウスモデルで評価した。
最後に、作製したT細胞が生体内で病態に対して充分に反応しているかを確かめるため、マウスモデルを用いて実験を行いました。tKO/EをT細胞に分化させ、ウイルスベクターを使ってCAR遺伝子を導入し、ヒトの免疫細胞を移植した、Bリンパ球増殖性腫瘍を持つ免疫不全マウス注14)に移植しました。T細胞免疫療法のプラットフォームとして、9日ごとに計3回のT細胞の移植を行い、腫瘍の変化を調べました(図3a)。その結果、比較としてゲノム編集をしていないiPS細胞由来T細胞(CAR遺伝子導入)を移植した場合(WT)に比べ、tKO/Eでは移植後すぐに腫瘍細胞の増加を抑えられていることが分かりました。さらに、複数回の移植を経て、腫瘍が制御されていることも分かりました(図3b)。よって、tKO/E由来T細胞は移植したヒトの免疫細胞から攻撃されること無く生き残り、移植後すぐに腫瘍細胞を攻撃して腫瘍を抑制する役割を果たしていることが確認できました。
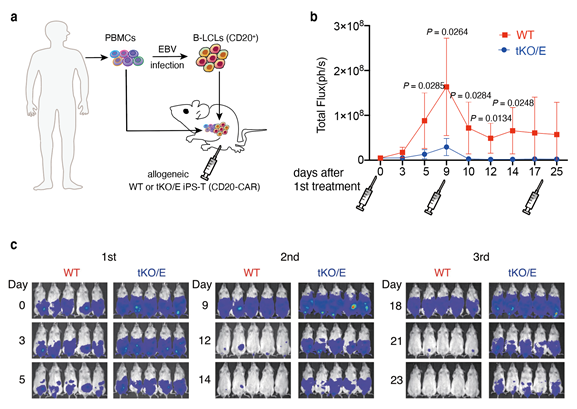
図3:マウスモデルを用いたtKO/Eの生体内実験(a)実験概要図。ヒトの免疫細胞を移植するため、免疫不全にしたマウスにヒトのPBMC(末梢血単核細胞)を入れ、一方でPBMCをEBV(エプスタイン・バール・ウイルス:悪性リンパ腫などの腫瘍形成をもたらす)に感染させた細胞も移植し、Bリンパ球増殖性腫瘍を形成させる。このマウスモデルにWTとtKO/E由来T細胞を移植し、腫瘍の変化を観察する。
(b)T細胞の初回移植後の経過日数ごとの腫瘍の変化(Total FluxはLuciferaseによる発光反応の観測によって腫瘍の大きさを定量化したもの)。9日ごとに計3回のT細胞の移植を行った。tKO/EはWTに比べ、移植後すぐに腫瘍の増加が抑えられていることが分かる。さらに、3回の移植を経て腫瘍が制御されていることが確認できる。
(c)3回目の移植ごとに体内に残存するT細胞を示す。WTは2回の移植により活性化された免疫細胞により移植後速やかに除去されるが、tKO/Eは免疫反応を逃れて残存することがわかる。
本研究の意義と今後の展望
これまで、ユニバーサルなT細胞免疫療法を目指してT細胞に直接ゲノム編集を行うさまざまな研究が行われてきましたが、ゲノム編集を行うことでT細胞の能力が弱まってしまうため、ステルスファイターT細胞を作製することは極めて困難でした。本研究はこの問題を解決する方法として、iPS細胞の段階でゲノム編集を行い、それを分化させることでT細胞の弱体化を防ぎ、かつレシピエントの免疫細胞から攻撃を受けない、ステルスファイターT細胞を作製することに成功し、試験管内と生体内の両方で効果を確認しました。
今回、多段階に渡りゲノム編集を行いましたが、iPS細胞はゲノム編集のステップごとに複製することが出来るので、逐一編集結果と効果が確認できます。このことは、T細胞に直接ゲノム編集を加える手法より安全性において優れている点であり、国内外で開発の進む他家iPS細胞を用いたT細胞免疫療法において、近い将来に応用される可能性があります。
論文名と著者
- 論文名
- “Generation of hypoimmunogenic T cells from genetically engineered allogeneic human induced pluripotent stem cells”
- ジャーナル名
- Nature Biomedical Engineering
- 著者
- Bo Wang1*, Shoichi Iriguchi1, Masazumi Waseda1, Norihiro Ueda1, Tatsuki Ueda1, Huaigeng Xu1, Atsutaka Minagawa1, Akihiro Ishikawa1, Hisashi Yano1, Tomoko Ishi1, Ryoji Ito2, Motohito Goto2, Riichi Takahashi2,Yasushi Uemura3, Akitsu Hotta1, and Shin Kaneko1**
- 著者の所属機関
-
- 京都大学 iPS細胞研究所(CiRA)
- 実験動物中央研究所(CIEA)
- 国立がん研究センター 先端医療開発センター
*:筆頭著者、**:責任共著者
用語説明
- 注1)CAR(キメラ抗原受容体、Chimeric antigen receptor)
- 特定のタンパク質を持つがん細胞に結合することができる人工的に作られた受容体。免疫細胞の一種であるT細胞に導入されると、T細胞が特定のタンパク質を持つがん細胞を発見し、攻撃するようになる。
- 注2)レシピエントとドナー
- 組織や細胞の移植において、受け入れる側をレシピエント、移植する組織や細胞を提供する側をドナーという。
- 注3)キラーT細胞
- 免疫においてはたらくT細胞の一種。主にHLAクラス1分子注5)に提示された抗原ペプチドや、非自己のHLA型を認識すると活性化して増殖し、異物及び病的な細胞を傷害して排除する。
- 注4)ヘルパーT細胞
- 免疫においてはたらくT細胞の一種。ヘルパーT細胞自身は攻撃性を持たないが、HLAクラス2分子注5)に提示された抗原を認識してその情報を他の免疫細胞に伝えるはたらきをもつ。すると、その抗原に対応するキラーT細胞が活性化し、異物を攻撃して分解する。
- 注5)HLA
- ヒトの主要組織適合遺伝子複合体(MHC)であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する型。ヒトの免疫に関わる重要な分子として働く。自身の持っている型と異なるHLA型の人から細胞や臓器の移植を受けると、T細胞が「異物」と認識し、免疫拒絶反応が起こる。そのため、細胞や臓器を移植する際にはHLA型をできるだけ合わせて行われている。HLAが持つタンパク質は、タンパク質の構造および機能の違いから、クラス1(HLA-A、-B、-C、-E、-F、-G)、とクラス2(HLA-DR、-DQ、-DP など)に分類される。
- 注6)ノックアウト
- ゲノム編集技術において、標的の遺伝子を破壊する(タンパク質が発現しないようにする)ことをノックアウトという。これに対し、標的ゲノム部位に外来遺伝子を挿入することをノックインという。
- 注7)NK細胞(ナチュラルキラー細胞)
- 免疫においてはたらく細胞の一種。NK細胞は抗原特異的な免疫反応を示さず、非特異的に細胞を障害するといった免疫反応(自然免疫)。ただし、主に自己HLAのC座(HLA-C)、E座(HLA-E)、G座(HLA-G)の存在によって、活動が抑制されることが分かっている。
- 注8)リガンド
- 特定の受容体に特異的に結合する物質。
- 注9)TCR(T細胞受容体、T cell receptor)
- T細胞の細胞膜上に発現している抗原受容体分子のことを示す。TCRを使った療法では、ヒト白血球抗原(HLA)の一致が必要になる。CARはTCR由来の細胞内分子と別の抗体を人工的に結合させて作られる受容体のため、TCRと受容体の構造が異なり、HLAの一致は必要ないが、CAR-T療法では標的が細胞表面抗原に限定されると言われている。
- 注10)iPS細胞ストック
- HLAホモ接合体の細胞を有する健康なドナーからiPS細胞を作製し、あらかじめ様々な品質評価を行った上で、再生医療に使用可能なiPS細胞株を保存することを目的として、再生医療用iPS細胞ストックプロジェクトにより構築された。
- 注11)CRISPR-Cas9 ゲノム編集技術
- ゲノム編集技術とは、ゲノムの特定標的部位にDNA損傷を誘導することでDNA配列を編集する技術の一つ。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)-Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。切断されたDNAが修復する際にゲノムDNAの一部が欠失するため、遺伝子の機能(タンパク質発現)をノックアウトすることができる。
- 注12)ウイルスベクター
- ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。ウイルスはヒトの細胞に感染するので、この仕組みを利用して目的の機能をもつ遺伝子を導入する。ウイルス由来のベクターは、遺伝子導入効率の高さから盛んに開発されてきた。染色体のDNAのランダムな部位に遺伝子導入が起こり、長期にわたって遺伝子を保持することが、特徴として挙げられる。
- 注13)スクリーニング
- ランダムな母集団からある特定の目的に応じた部分集合、サンプルを抽出する操作。
- 注14)免疫不全マウス
- 免疫機能が低下しているマウス。異種の細胞を移植しても拒絶反応を起こさず体内に生着するため、動物実験に用いられる。ヒトの細胞を移植し、マウスの体内でヒト由来細胞の機能などを研究することを可能にしている。
お問い合わせ先
研究・報道に関する問い合わせ先
京都大学iPS細胞研究所(CiRA)研究支援部門
国際広報室 大内田 美沙紀
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム
革新的がん医療実用化研究事業