周囲環境再構築による組織パターン形成の誘導
2021-06-29 理化学研究所
理化学研究所(理研)開拓研究本部萩原生体模倣システム理研白眉研究チームの萩原将也理研白眉研究チームリーダーらの共同研究グループは、細胞が周囲にある「細胞外マトリックス[1]」を分解・再構築することで、自分だけでなく他の細胞も通りやすい道を作っていることを発見しました。
本研究成果は、細胞の組織形成メカニズムの解明や複雑組織の体外再構築に向けた設計・制御理論の構築に貢献すると期待できます。
細胞は周囲のコラーゲンなどの細胞外マトリックスに積極的に働き掛け、細胞外マトリックスを分解・再構築することが知られています。しかし、この細胞外環境の再構築が細胞行動に与える影響についてはよく分かっていません。
今回、共同研究グループは微細加工技術を用いて、細胞集団をさまざまな形状に並べた環境下で、細胞の動態を解析しました。その結果、細胞が周囲に存在する細胞外マトリックスから物理的な抵抗を受け、新しい場所に進むのを阻まれていることが明らかになりました。さらに、光ピンセット[2]を用いた解析と数理モデルにより、この抵抗は細胞とマトリックスとの相互作用で徐々に低減され、細胞が「場」を再構築しながら新たな道を作り、他の細胞がそれに追随して細胞の進行方向を決定していることを明らかにしました。
本研究は、科学雑誌『Communications Biology』オンライン版(6月28日付)に掲載されました。
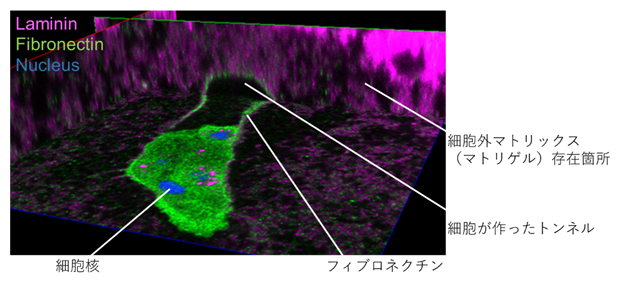
細胞が細胞外マトリックス(マトリゲル)内に作製したトンネル(黒い部分)
背景
細胞が集団で固有の組織形状を成すメカニズムについてはこれまで、形態形成因子の濃度勾配に誘引されて動く化学走性や、細胞間の力学相互作用を主要因とした細胞行動の数理モデルが多く提唱されてきました。また、細胞の周囲にはコラーゲンなどの非細胞素材の細胞外マトリックスが存在しており、細胞はこの細胞外マトリックスに積極的に働きかけ、細胞外マトリックスを分解・再構築することが知られています。
しかし、細胞によるアクティブな細胞外環境の再構築が、細胞行動にどの程度、あるいはどのように影響し、組織パターン形成[3]に寄与しているかについては不明な点が多く残されています。
研究手法と成果
共同研究グループは、細胞による「場」の再構築が細胞行動に与える影響を調べるために、微細加工や光ピンセットなどの工学手法を用いて人為的に場を制御できる環境を作製し、細胞行動を計測・解析しました。
まず、三角の形をしたヒト気管支上皮細胞の細胞集団において、細胞外マトリックスの一種であるフィブロネクチン[4]という糖タンパク質を、細胞が一旦凝集したタイミングで染色しました。フィブロネクチンは細胞同士の接着を促進する働きをします。その結果、移動した細胞が存在している領域だけでなく、細胞が移動して不在になった領域にも、フィブロネクチンの染色が見られることが分かりました。つまり、細胞はフィブロネクチンを分泌することで、自らがその場所にいた痕跡を残していたのです(図1上段)。
このフィブロネクチンの影響を調べるため、人為的にフィブロネクチンを細胞集団の周囲にコーティングし、細胞行動を観察しました。すると、コーティングした領域とその外側のコーティングしていない領域との境界まで単独で近づいた細胞は全て、境界の外に出ることなく引き返すことが分かりました(図1中段)。一方、集団で境界まで近づいた細胞は、境界の外に出ないようにしていたものの、細胞同士で押し合ったことで境界の外に出てしまいました。そして、外に出た細胞がその場でフィブロネクチンを新たに分泌する様子が観察されました(図1下段)。このことから、細胞はフィブロネクチンの領域内にとどまろうとする習性があるものの、一旦領域外に出た場合は新たに場にマーキングをし、領域を拡大することが分かりました。
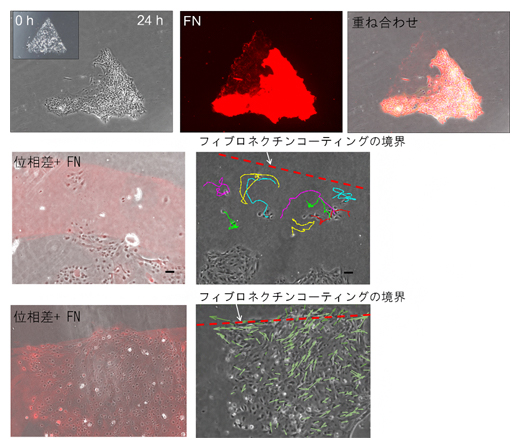
図1 細胞が残すフィブロネクチンによる細胞行動の変化
(上段) 初めは三角の形をしていたヒト正常気管支上皮細胞の細胞集団の変化。左は0hと24h後の光学顕微鏡像、中はフィブロネクチン染色画像、右はそれらを重ね合わせた画像。フィブロネクチン染色は現在細胞が存在する領域だけでなく、左上のかつて存在していた領域にも見られた。
(中段) フィブロネクチンの領域をあらかじめ人為的にコーティングすると、境界(赤破線)に単独で近づいた細胞はフィブロネクチンの領域から出ることなく引き返した。
(下段) 集団でフィブロネクチンの境界に近づいた細胞群は、一部が押し出され境界の外に飛び出したが、外に出た細胞がフィブロネクチンを分泌し、領域を拡大した。
次に、細胞の周囲に存在する細胞外マトリックスがどのように細胞に影響するのかを調べるため、細胞外マトリックスの一種であるマトリゲル[5]を細胞の上から被せた場合とそうでない場合とで細胞行動を観察しました。すると、マトリゲルを被せない場合は、細胞が周囲の細胞と接着し、集団サイズが大きくなりました。マトリゲルを被せた場合は、散在していた細胞が、初めは動くことができずその場で停滞したままでしたが、時間の経過とともに徐々に活動範囲を広げていくことが分かりました。また、細胞が通った後の一部には道が残されており、同じ道を他の細胞も追随したことが分かりました(図2上)。この道を染色すると、マトリゲル内で細胞がトンネルをつくり、壁にフィブロネクチンが塗布されていることが確認できました(図2下)。
これらの結果から、細胞は周囲にある細胞外マトリックスの抵抗を受け、動きを制限されているものの、この周囲からの抵抗を時間をかけて弱めることで、細胞外マトリックス内に通りやすい道を作り出し、他の細胞もその道を積極的に通るという仮説を立てました。
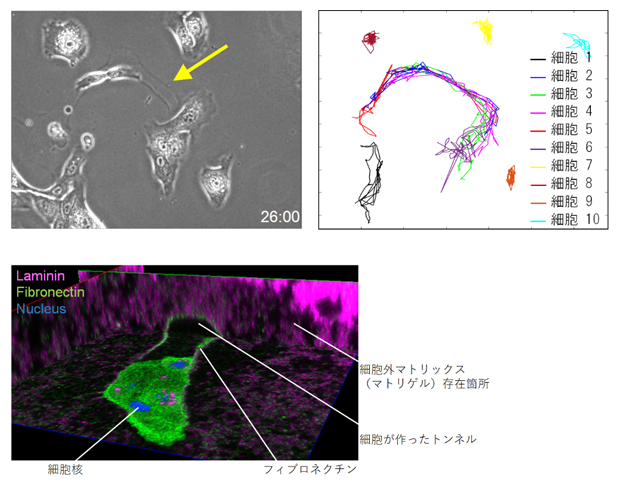
図2 細胞が細胞外マトリックスからの抵抗を弱めてつくった道
(左上) 黄色矢印は、マトリゲルの中を動いた細胞の軌跡を示す。
(右上) 細胞トラッキングの結果。他の細胞も同じ軌跡を動いているのが分かる。
(下) 三次元共焦点画像。細胞がマトリゲル内にトンネルをつくって、そのトンネルの壁にフィブロネクチンが残されている。
この仮説を立証するため、10マイクロメートル(μm、1μmは1000分の1mm)のポリスチレンビーズをマトリゲル内における細胞行動に見立てて、光ピンセットで往復操作し、マトリゲルから受ける抵抗値の変化を計測しました。その結果、ビーズの往復回数が増えれば増えるほどマトリゲルから受ける抵抗値は小さくなり、同じ力で動ける範囲が徐々に広くなることが分かりました。つまり、細胞は細胞外マトリックスとの間で抵抗を受けて移動範囲が限定されていても、時間をかけて抵抗を弱めてトンネルを掘り、道を作り出すことにより、その道を他の細胞も追随した可能性が示されました。数理モデルを用いた細胞行動シミュレーションにおいても同様の結果が得られ、上記仮説の確からしさを裏付けました。
このように、細胞外環境の再構築が細胞行動に与える影響は決して少なくないことが明らかになりました。そこで次に、細胞外マトリックスの状態を操作し、細胞の集団形成パターンを恣意的に制御することを試みました。細胞集団を囲むマトリゲルの一部分を柔らかく、あるいは硬くして局在させた状態で細胞を培養したところ、細胞が形成する集団パターンをコントロールすることができました。そしてヒト気管支上皮細胞の三次元培養[6]を、架橋剤のゲニピン[7]を用いて細胞集団の左半分のゲルを硬くし、右半分を通常通りで行ったところ、細胞の移動方向に指向性が生まれ、右半分の細胞集団では分岐(細胞集団が形成する枝状の形)を発生させることができました(図3)。

図3 硬さの異なる2種類のゲルの境界で細胞を三次元培養した結果
境界線左側のみに0.5mMゲニピンをマトリゲル内に入れ、硬さの異なるゲルを局在させた状態で、ヒト気管支上皮細胞を培養した。黒く見える同じ細胞集団の中でも、ゲルが硬い左側では細胞は道をつくることができず、分岐はできない一方、ゲルが柔らかい右側では多数の分岐が発生している。
今後の期待
本研究の結果から、細胞自らが行う細胞外環境の再構築は、細胞の移動方向および組織パターンの形成に与える影響が少なくないことが明らかになりました。現在、体外で臓器を再構築するオルガノイド[8]技術の開発が世界中で進められています。組織パターンを制御するために、工学技術を駆使して細胞の配列や形態形成因子の勾配を操作することは行われていますが、今回の結果を細胞外マトリックスの設計・制御理論へとつなげていくことで、体外での組織再構築に貢献すると期待できます。
補足説明
1.細胞外マトリックス
コラーゲンなど細胞の外側に存在し、三次元的に細胞が存在するための足場となる物質。細胞に直接働き掛ける役割もある。
2.光ピンセット
レーザー光の集光を操作することにより、微小物体を操る技術。
3.組織パターン形成
血管のネットワーク構造、気管支の枝分かれ構造など、各組織が持つ固有のパターンの形成のこと。
4.フィブロネクチン
細胞外マトリックスの一種でもある糖タンパク質。細胞の接着を促進する。
5.マトリゲル
コーニング社販売の細胞外マトリックス。
6.三次元培養
細胞を三次元的に播種して、生体内環境により近い環境を与えた培養方法。
7.ゲニピン
植物由来の化学物質。毒性は低く、コラーゲン、ゼラチンなどの架橋剤として用いられる。
8.オルガノイド
人工的に作られる、生体内の組織または臓器に似た細胞組織体。
共同研究グループ
理化学研究所 開拓研究本部 萩原生体模倣システム理研白眉研究チーム
理研白眉研究チームリーダー 萩原 将也(はぎわら まさや)
特別研究員 コウ・イザベル(Koh Isabel)
名古屋大学 大学院工学研究科
准教授 丸山 央峰(まるやま ひさたか)
明治大学 研究・知財戦略機構
准教授 秋山 正和(あきやま まさかず)
東京大学 大学院工学系研究科
教授 新井 史人(あらい ふみひと)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「制御ー計測ー情報の高度融合による組織形成場におけるダイナミクス解析(研究代表者:萩原将也)」、同新学術領域研究(研究領域提案型)「生物の3D形態を構築するロジック(領域統括:近藤滋)」、「3D計測・制御プラットフォームによる気管支分岐形成メカニズム解析(研究代表者:萩原将也)」による支援を受けて行われました。
原論文情報
Weakening of resistance force by cell-ECM interactions regulates cell migration directionality and pattern formation, “Masaya Hagiwara, Hisataka Maruyama, Masakazu Akiyama, Isabel Koh, Fumihito Arai”, Communications Biology, 10.1038/s42003-021-02350-4
発表者
理化学研究所
開拓研究本部 萩原生体模倣システム理研白眉研究チーム
理研白眉研究チームリーダー 萩原 将也(はぎわら まさや)
報道担当
理化学研究所 広報室 報道担当