2021-08-03 京都大学
西澤茉由 工学研究科博士課程学生(研究当時)、森本大智 同助教、白川昌宏 同教授、菅瀬謙治 同准教授、Erik Walinda 医学研究科助教、Benjamin Kohn ドイツ・ライプニッツ・ポリマー研究所研究員、Ulrich Scheler 同部門長の研究グループは、アデノシン三リン酸(ATP)とタンパク質との非特異的な弱い相互作用を原子レベルで検出することに世界で初めて成功しました。
ATPは、従来生命活動に必要なエネルギーの貯蔵や利用に関わる分子と考えられています。興味深いことに、近年、ATPにはタンパク質のアミロイド線維化を抑制するという別の作用があることが同定されました。しかし、どのようにATPがタンパク質を安定化するのかは不明でした。本研究では主にNMR(核磁気共鳴)を用いて、細胞内と同程度の濃度のATPが、タンパク質と弱く非特異的に相互作用すること、および自己会合することを明らかにしました。タンパク質のアミロイド線維化はパーキンソン病などの神経変性疾患と関わるため本成果は将来的に神経変性疾患の新たな治療法の開発に繋がることが期待されます。
本研究成果は、2021年8月3日に、国際学術誌「Journal of the American Chemical Society」のオンライン版に掲載されました。
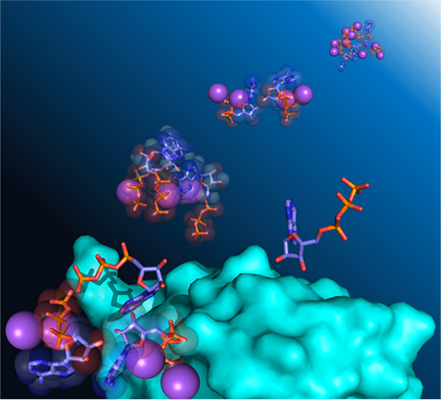
図:ATPがわずかに自己会合し、タンパク質と相互作用することを明らかにしました。ATP分子をスティック、イオンを球で表し、タンパク質の表面を水色で表示。
研究者情報
研究者名:森本大智
研究者名:白川昌宏
研究者名:菅瀬謙治
研究者名:Erik Walinda