重症化を防ぐ経口治療薬として期待されるCDM-3008
2021-11-17 理化学研究所,東京慈恵会医科大学
理化学研究所(理研)開拓研究本部肝がん予防研究ユニットの古谷裕上級研究員(東京慈恵会医科大学臨床検査医学講座訪問研究員)、前田瑞夫ユニットリーダー(理研研究政策審議役)、松浦知和客員主管研究員(東京慈恵会医科大学臨床検査医学講座教授)らの共同研究チームは、新型コロナウイルス(SARS-CoV-2)ゲノムRNAに対して分解作用を持つ化合物のスクリーニング系を開発し、低分子化合物CDM[1]-3008がSARS-CoV-2に対して抑制作用を持つことを発見しました。
本研究成果は、CDM-3008を新型コロナウイルス感染症(COVID-19)の新たな経口または吸入治療薬として提案するもので、特に重症化を予防する効果が期待できます。
今回、共同研究チームは、インターフェロン(IFN)[2]により発現誘導される因子がウイルス由来ゲノムRNAの2本鎖ループ構造を認識し、分解を促進することに注目し、SARS-CoV-2の部分配列を用いて1日(24時間)以内でIFNの抗SARS-CoV-2活性を測定する実験系を構築しました。この実験系を用いて、IFNα/β[2]受容体2のアゴニスト[3]として働くCDM-3008が抗SARS-CoV-2活性を示すこと明らかにしました。さらに、IFNの活性によりエキソヌクレアーゼ[4]であるISG20[5]が発現誘導され、SARS-CoV-2サブレプリコン[6]RNAを分解することを明らかにしました。
本研究は、科学雑誌『International Journal of Molecular Sciences』に10月28日付でオンライン掲載されました。
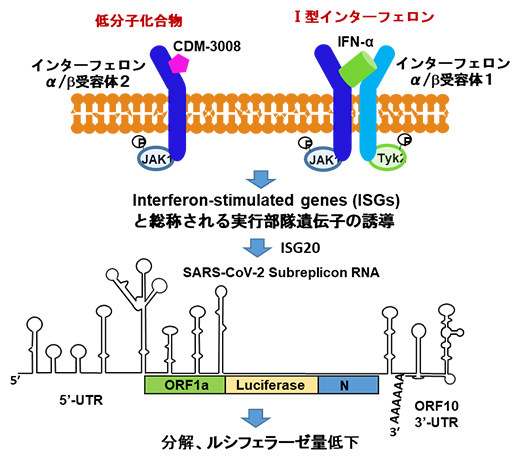
CDM-3008とIFN-αによるSARS-CoV-2サブレプリコン RNAの分解機構
背景
新型コロナウイルス感染症(COVID-19)の治療薬の開発が待たれる中、現在、ウイルス抑制作用を持つ承認薬として、低分子化合物のレムデシビルと抗体医薬[7]のカシリビマブ/イムデビマブ、ソトロビマブが用いられています。どちらも注射投与剤で、使用には入院・通院が必要であるため、自宅でも服用可能な経口または経肺投与できる治療薬の開発が急がれています。
新型コロナウイルス(SARS-CoV-2)に感染し、重症化した患者を調べた研究により、患者にはインターフェロン(IFN)に対する自己抗体[8]ができており、その自己抗体が体内で産生されるIFNの作用を阻害していることが報告されました注1)。さらに、重症化した患者にはIFN受容体とシグナル伝達分子に変異が見られ、インターフェロン誘導性遺伝子(ISGs)[9]の発現誘導が阻害されていることが示されました注2)。このように、新型コロナウイルス感染症患者の重症化とIFNシグナルの関連性が明らかになっています。
低分子化合物CDMは、インターフェロンα/β(IFNα/β)受容体2のアゴニストとして働き、JAK/STAT経路[10]を活性化し、ISGsの発現を誘導します。IFNα/βを吸入投与する臨床試験により、新型コロナウイルス感染症患者の回復が早くなることが分かっていますが、IFNと比較すると、CDMは低分子化合物であるため、自己抗体による阻害を受ける可能性が低いという利点があります。そこで、共同研究チームは、CDMを経口または吸入投与によるCOVID-19の治療薬として使えないか検討しました。
注1)Paul Bastard et. al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19.Science, 2020, 370(6515):eabd4585. doi: 10.1126/science.abd4585.
注2)Qian Zhang et. al. Inborn errors of type I IFN immunity in patients with life-threatening COVID-19.Science, 2020 370(6515):eabd4570. doi: 10.1126/science.abd4570.
研究手法と成果
SARS-CoV-2はバイオセーフティーレベル[11]3(BSL3)で扱う必要があることから、大規模スクリーニングには不向きです。そのため、感染に重要な部位をルシフェラーゼや蛍光タンパク質などのレポーター遺伝子に置換した「レプリコンシステム」を用いてスクリーニングを行います。しかし、SARS-CoV-2ゲノムRNAは約30kbもあり、全長を用いてレプリコンを作製することは容易ではありません。
そこで共同研究チームは、IFNによるウイルスRNAの分解作用に注目し、作用部位である5’非翻訳領域(5′-UTR)[12]、ORF(open reading flame)[13]1a、ヌクレオカプシド[14]、ORF10、3’非翻訳領域(3′-UTR)[12]にルシフェラーゼを挿入した「SARS-CoV-2サブレプリコンRNA発現ベクター[15]」を作製しました(図1A)。SARS-CoV-2サブレプリコンRNAはCMVプロモーター[16]により転写されmRNAとなり、翻訳されORF1aの部分配列とルシフェラーゼとヌクレオカプシドからなる融合タンパク質が産生されます(図1B)。
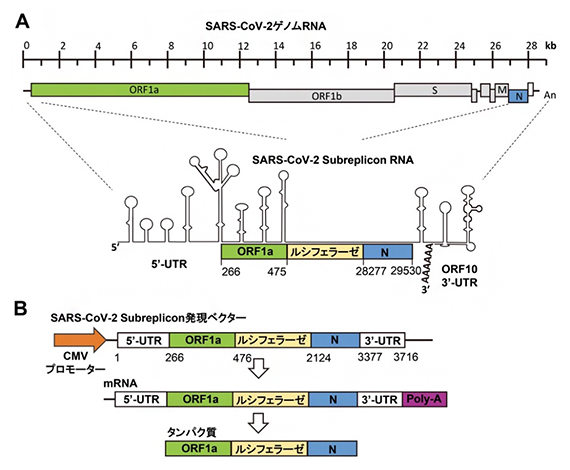
図1 SARS-CoV-2ゲノムRNAとSARS-CoV-2サブレプリコンRNA発現ベクターの作製
(A)SARS-CoV-2ゲノムRNAとSARS-CoV-2サブレプリコンRNAの構造模式図。SARS-CoV-2サブレプリコンRNAの5′-UTRと3′-UTRは、ウイルス由来RNA特有の2本鎖RNAからなるループ構造をとる。
(B)SARS-CoV-2サブレプリコンRNA発現ベクターは、5′-UTR、ORF1a部分配列、ルシフェラーゼ、ヌクレオカプシド(N)、3′-UTR、polyAからなるmRNAをCMVプロモーター下で発現する。このmRNAから翻訳され、ORF1aの部分配列とルシフェラーゼとヌクレオカプシドからなる融合タンパク質が発現する。
次に、SARS-CoV-2サブレプリコンRNA発現ベクターをSARS-CoV-2が感染・増殖可能なCalu-3細胞(肺がん由来ヒト気管支腺培養細胞株)に発現させ、IFN-αとCDM-3008で3日間(72時間)処理したところ、50%阻害濃度[17]はそれぞれ193IU/mLと2.54μMでした(図2)。この結果から、Calu-3細胞において、IFN-αとCDM-3008はSARS-CoV-2サブレプリコンRNAの発現を抑制する作用を持つことが示されました。
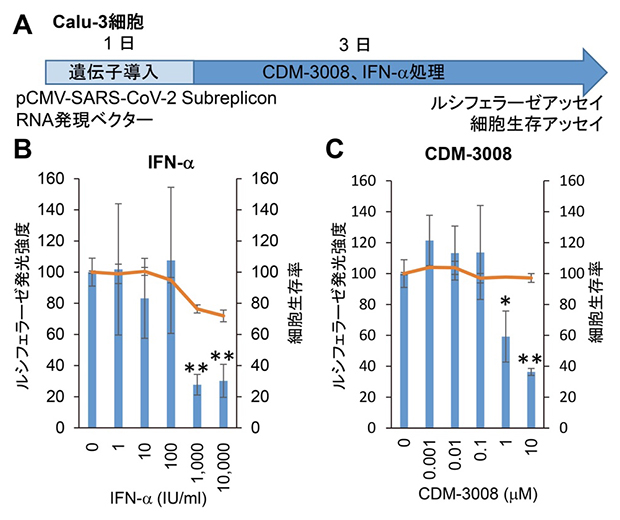
図2 Calu-3細胞でのIFN-αとCDM-3008のSARS-CoV-2サブレプリコンRNA抑制作用
(A) Calu-3細胞(肺がん由来ヒト気管支腺培養細胞株)を用いた実験工程。Calu-3細胞にSARS-CoV-2サブレプリコンRNA発現ベクターを導入し、72時間IFN-αとCDM-3008で処理し、ルシフェラーゼアッセイと細胞生存アッセイを行った。
(B,C) IFN-αとCDM-3008はルシフェラーゼの発光強度を有意に抑制したことから、SARS-CoV-2サブレプリコンRNAを分解したことが示された。
また、Calu-3細胞は、増殖スピードが遅く化合物スクリーニングには不向きなため、増殖スピードが速く、遺伝子操作も容易なHeLa細胞(ヒト子宮頸がん由来培養細胞)を用いて活性を測定しました。HeLa細胞にSARS-CoV-2サブレプリコンRNA発現ベクターをエレクトロポレーション[18]により導入し、同時にIFN-αとCDM-3008で24時間処理しました。その結果、50%阻害濃度はそれぞれ667IU/mLと0.78μMでした(図3)。このようにして、Calu-3細胞を用いた測定結果と同等の結果を、HeLa細胞を用いて24時間以内に得ることができました。
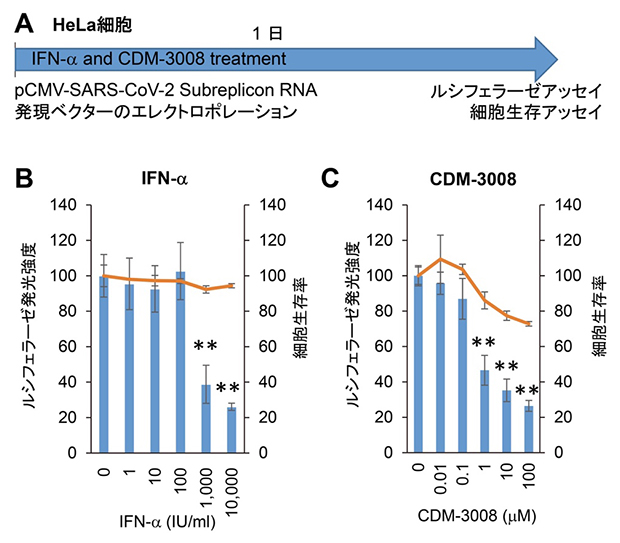
図3 HeLa細胞でのIFN-αとCDM-3008のSARS-CoV-2サブレプリコンRNA抑制作用
(A) HeLa細胞(ヒト子宮頸がん由来培養細胞)を用いた実験工程図。HeLa細胞にSARS-CoV-2サブレプリコンRNA発現ベクターをエレクトロポレーションにより導入し、24時間IFN-αとCDM-3008で処理し、ルシフェラーゼアッセイと細胞生存アッセイを行った。
(B,C) HeLa細胞でも、IFN-αとCDM-3008はルシフェラーゼの発光強度を有意に抑制し、SARS-CoV-2サブレプリコンRNA分解作用を確認した。
さらに、HeLa細胞でSARS-CoV-2サブレプリコンRNAを恒常的に発現する細胞株を作製しました。この細胞をIFN-αで24時間処理したところ、50%阻害濃度は1,875IU/mLでした。このSARS-CoV-2サブレプリコンRNA抑制活性は、JAK阻害剤であるピリドン6により消失しました(図4)。このことから、IFN-αによりJAK/STAT経路が活性化され、ISGsが誘導されSARS-CoV-2サブレプリコンRNAを分解している可能性が示されました。
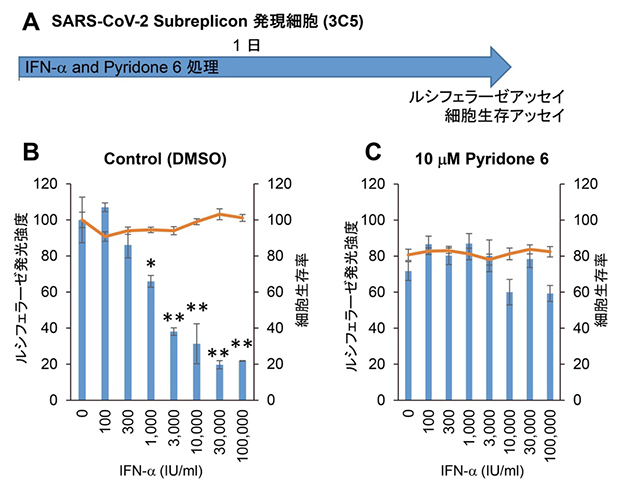
図4 HeLa細胞でのIFN-αの活性測定とJAK阻害剤ピリドン 6による活性阻害
(A) SARS-CoV-2サブレプリコン発現細胞(3C5)を用いた実験工程図。SARS-CoV-2サブレプリコン発現細胞を24時間IFN-αとピリドン6で処理し、ルシフェラーゼアッセイと細胞生存アッセイを行った。
(B,C) 恒常的にサブレプリコン RNAを発現する細胞でもIFN-αの活性が確認でき、この活性はピリドン6により阻害されることからJAK/STAT経路を介し発現したISGsによるウイルス由来RNA分解作用であることが分かった。
ISGsはさまざまな抗ウイルス活性を発揮する遺伝子の集まりで、その中にはウイルス由来のRNAを認識し分解する因子が複数あります。その中から、OAS1、OAS2、OAS3、ISG20を選択し、siRNA[19]を用いた遺伝子発現抑制実験を行いました。その結果、主にDNAやRNAを末端から分解するエキソヌクレアーゼであるISG20がSARS-CoV-2 サブレプリコンRNAの分解を促進しており、ISG20 siRNA処理により分解が抑制されました(図5)。このことから、SARS-CoV-2ゲノムRNAを分解し、複製を抑制するために働く分子としてISG20を同定しました。
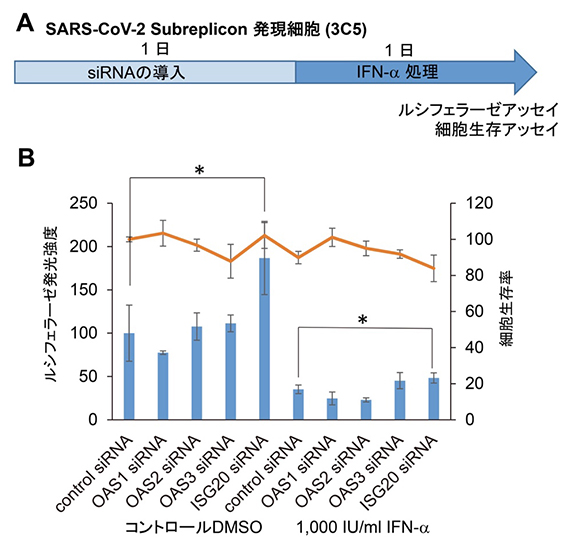
図5 ウイルス由来のRNA分解作用を持つOAS1, 2, 3, ISG20遺伝子の発現抑制実験
(A) SARS-CoV-2サブレプリコン発現細胞(3C5)を用いたsiRNAにより遺伝子発現抑制実験の工程図SARS-CoV-2サブレプリコン発現細胞にOAS1 siRNA、OAS2 siRNA、OAS13 siRNA、ISG20s siRNAを導入し、1日後にIFN-αで24時間処理した。
(B,C) ルシフェラーゼの発光強度がISG20 siRNAで処理することにより有意に上昇したことから、SARS-CoV-2サブレプリコンRNAはISG20のエキソヌクレアーゼ活性により分解されることが示された。
今後の期待
今回開発したSARS-CoV-2ゲノムRNA分解作用を持つ化合物スクリーニングシステムを用いることで、新しい治療薬をさらに同定できると期待できます。
さらに共同研究チームは、CDM-3008の構造を基にして合成展開し、特異的にIFNシグナルを活性化するCDM誘導体を複数同定しています。今後、CDM-3008やCDM誘導体を用いて治療薬を開発し、IFNに対する自己抗体が体内で産生されているためにIFNが効かず、重症化する可能性のある患者にCDM治療薬を投与すれば、重症化を防ぐことができると期待できます。
また、IFNと比較して安定であり、常温での備蓄も可能なCDMは、さまざまなウイルス由来のRNAを分解する作用があります。次に起こり得るコロナウイルスやフラビウイルス[20]によるパンデミックの際の治療薬としても使用可能であり、次世代治療薬としての活用が期待できます。
補足説明
1.CDM
インターフェロンα/β受容体2のアゴニストとして働く低分子化合物。
2.インターフェロン(IFN)、IFNα/β
ウイルス感染に反応して感染細胞で産生されるサイトカイン。
3.アゴニスト
生体内の受容体に働いてリガンドと同等の効果を示す薬。
4.エキソヌクレアーゼ
DNAやRNAを5’末端または3’末端から分解する酵素。
5.ISG20
インターフェロン誘導性遺伝子(ISGs)の一つで、一本鎖DNAとRNAを分解するエキソヌクレアーゼ。
6.レプリコン
ウイルスの感染に必要な遺伝子を欠損させ、代わりにルシフェラーゼや緑色蛍光タンパク質などのレポーター遺伝子を挿入し、自己増殖を可能にしたウイルス遺伝子。
7.抗体医薬
培養細胞を用いて人工的に病気の原因となる物質を認識する抗体を作製し、患者に抗体を投与することにより病気の原因を排除する医薬品。
8.自己抗体
抗体は一般的に体外から侵入してきた異物を抗原として作製されるが、自己抗体は体内で産生されたタンパク質などを抗原として産生され、自己免疫疾患の原因となる。
9.インターフェロン誘導性遺伝子(ISGs)
インターフェロンにより発現誘導される抗ウイルス活性を発揮する遺伝子群。ISGsはInterferon-stimulated genesの略。
10.JAK/STAT経路
インターフェロン受容体は活性化するとJAKをリン酸化し、JAKはSTATをリン酸化し、核に移行したリン酸化STAT複合体はインターフェロン誘導性遺伝子の発現を誘導する。
11.バイオセーフティーレベル(BSL)
細菌やウイルスを実験室で扱う際の実験室のレベル分けのことで、扱う微生物によってBSL-1, 2, 3, 4 に分けられ、新型コロナウイルスはBSL-3の実験室で扱う必要がある。
12.5’非翻訳領域(5′-UTR)、3’非翻訳領域(3′-UTR)
mRNAのタンパク質に翻訳される領域の5’側と3’側にある非翻訳領域で、タンパク質の発現制御などに関与している。
13.ORF(open reading flame)
遺伝子配列のうちタンパク質として翻訳されうる領域で、開始コドンから始まり終止コドンで終わる。
14.ヌクレオカプシド
ウイルスRNAまたはDNAに結合し、多量体を形成し包み込むタンパク質。
15.ベクター
ベクターは遺伝子を細胞間で運ぶために用い、一般的に大腸菌での増幅が可能で、精製したのちに培養細胞に導入し、導入遺伝子の発現を促進する。ベクターに抗生物質耐性遺伝子を付加することで、発現細胞の選択が可能になる。
16.CMVプロモーター
ヒトサイトメガロウイルスのプロモーター配列で、哺乳類細胞での発現誘導能が高くタンパク質の発現に用いられている。
17.50%阻害濃度
薬の効果を示す指標で、薬のターゲットとなる因子を50%抑制する濃度を示す。
18.エレクトロポレーション
電気パルスにより細胞内にDNAやRNAを導入する方法。電気穿孔法ともいう。
19.siRNA
ループ構造を持つ2本鎖RNAで、RNA干渉を引き起こし、標的となるmRNAを分解する。
20.フラビウイルス
ジカウイルス、デングウイルス、日本脳炎ウイルスなどがフラビウイルス科フラビウイルス属のウイルスで、蚊またはダニにより媒介され、これらのウイルスが原因となり公衆衛生上問題となる感染症を引き起こす。
共同研究チーム
理化学研究所 開拓研究本部 肝がん予防研究ユニット
上級研究員 古谷 裕(ふるたに ゆたか)
(東京慈恵会医科大学 臨床検査医学講座 訪問研究員)
客員主管研究員 松浦 知和(まつうら ともかず)
(東京慈恵会医科大学 臨床検査医学講座 教授)
研究員 ガイユスト・ルック(Gailhouste Luc)
研究員 秦 咸陽(しん かんよう)
テクニカルスタッフⅠ 戸口 真理子(とぐち まりこ)
テクニカルスタッフⅠ 樋口 祥子(ひぐち しょうこ)
テクニカルスタッフⅠ 屋中 香織(やなか かおり)
ユニットリーダー 前田 瑞夫(まえだ みずお)
(理研 研究政策審議役)
東京慈恵会医科大学 臨床検査医学講座
准教授 政木 隆博(まさき たかひろ)
准教授 越智 小枝(おち さえ)
研究支援
本研究は、東京慈恵会医科大学研究費、肝炎等克服実用化研究事業「次世代抗B型肝炎ウイルス薬導出に向けた創薬研究(領域代表者:松浦知和)」による支援を受けて行われました。
原論文情報
Furutani, Y., Toguchi, M., Higuchi, S., Yanaka, K., Gailhouste, L., Qin, X.-Y., Masaki, T., Ochi, S., Matsuura, T., “Establishment of a Rapid Detection System for ISG20-Dependent SARS-CoV-2 Subreplicon RNA Degradation Induced by Interferon-α”, International Journal of Molecular Sciences, 10.3390/ijms222111641
発表者
理化学研究所
開拓研究本部 肝がん予防研究ユニット
上級研究員 古谷 裕(ふるたに ゆたか)
(東京慈恵会医科大学 臨床検査医学講座 訪問研究員)
ユニットリーダー 前田 瑞夫(まえだ みずお)
(理研 研究政策審議役)
客員主管研究員 松浦 知和(まつうら ともかず)
(東京慈恵会医科大学 臨床検査医学講座 教授)
報道担当
理化学研究所 広報室 報道担当
学校法人慈恵大学 法人事務局 経営企画部 広報課